二甲双胍介导的增强CD8阳性T细胞肿瘤浸润与增加的肿瘤灌注的相关性
王吉昌,李雄雄,李光月
(西安交通大学第一附属医院:1. 血管外科;2. 乳腺外科;3. 科技部,陕西西安 710061)
CD8阳性T细胞是人体T淋巴细胞群中非常重要的一群细胞,在介导机体细胞免疫中发挥极其重要的作用。目前,在众多肿瘤治疗的研究方向中,以增强CD8阳性T细胞杀伤肿瘤细胞为基础的免疫疗法被认为是一种可能治愈肿瘤的方法。而抗肿瘤免疫中,只有当CD8阳性T细胞浸润到肿瘤内部才可能通过接触性杀伤导致肿瘤细胞凋亡。研究表明,CD8阳性T细胞向包括肿瘤在内的组织内浸润的程度与肿瘤的灌注情况存在密切关系。本课题组在前期研究中发现,抗代谢异常药物二甲双胍可增加恶性肿瘤内部的血液灌注,从而抑制肿瘤的严重缺氧。近来有研究发现,二甲双胍可以增加CD8阳性T细胞在肿瘤内的浸润数量。而关于二甲双胍介导的增强CD8阳性T细胞浸润与增加的肿瘤灌注是否有关,目前仍不十分清楚。本研究通过检测原位小鼠4T1乳腺癌中CD8阳性T细胞的浸润数量、肿瘤灌注情况及两者间的相关性,探讨二甲双胍介导的增加肿瘤灌注与增强CD8阳性T细胞浸润之间的关系。
1 材料与方法
1.1细胞、动物及试剂6~8周雌性BALB/C小鼠20只,体质量16~20 g,全部由西安交通大学医学动物实验中心提供。本研究所涉及动物实验通过西安交通大学第一附属医院伦理委员会审核。兔抗小鼠CD8抗体购自上海生工生物工程有限公司;TRITC标记的Lectin由Vector Labs公司提供;Fitc标记的山羊抗兔二抗购自Invitrogen公司;Dapi核复染试剂购自Sigma公司;40 g/L多聚甲醛及PBS购自西安壮志生物有限公司;胎牛血清蛋白及DMEM培养基购自Gibco公司;实验用二甲双胍粉剂及Triton X-100购自Sigma公司;4T1小鼠转移性乳腺癌细胞购于空军军医大学细胞库;OCT冰冻标本包埋剂购自日本樱花公司。
1.2细胞准备4T1小鼠乳腺癌细胞使用含有100 mL/L胎牛血清的DMEM进行培养。并连续传代3代后行分皿培养。当细胞生长融合接近80%~90%时,用PBS充分冲洗后,胰蛋白酶消化细胞。镜下观察视野内多数细胞变圆并开始脱离培养皿底板时,终止消化。离心后弃去上清,并使用PBS冲洗后再次清洗后离心。弃去PBS上清后使用不含胎牛血清蛋白的DMEM培养基重悬细胞,经细胞计数后将悬液中细胞密度调整至1×106/mL,置于冰上备用。
1.3原位乳腺癌模型构建及动物分组原位接种细胞前用移液器充分重悬细胞。用胰岛素针穿刺BALB/C小鼠的第四对乳腺的脂肪垫,并注射细胞悬液100 μL。接种后第9天平均肿瘤体积达到50 mm3时,将20只小鼠随机分为对照组和二甲双胍组。对照组小鼠给予普通饮用水,干预组小鼠给予含有二甲双胍的饮用水。小鼠平均饮水量为3 mL/d。二甲双胍干预剂量为250 mg/kg。
1.4血管灌注实验及标本准备连续干预2周后,使用10 g/L戊巴比妥钠麻醉小鼠。后经尾静脉注射TRITC-Lectin共约100 μL。15 min后过量注射戊巴比妥钠处死小鼠后,经心脏灌注40 g/L多聚甲醛约50 mL,完整提取肿瘤组织,并于40 g/L多聚甲醛中避光固定约4 h。后使用200~300 g/L蔗糖溶液对标本行避光脱水后吸干,并使用OCT包埋剂包埋标本,后置于-80 ℃备用。于-22 ℃下进行切片,厚度约6 μm,于-80 ℃避光保存备用。
1.5免疫荧光染色冰冻切片经PBS清洗和2 mL/L Triton X-100溶液透膜,再次清洗后用50 g/L BSA于37 ℃下封闭切片30 min。甩掉BSA后滴加CD8抗体(工作液稀释比为1∶90),于4 ℃下孵育过夜后,PBS清洗并滴加Fitc标记的荧光二抗,室温孵育1 h,清洗并复染Dapi。充分清洗切片后,使用盖玻片及抗荧光淬灭剂封片。避光37 ℃下烘干1 h,Leica共聚焦荧光显微镜下记录染色结果。
1.6CD8阳性T细胞浸润程度及灌注程度测定荧光共聚焦显微镜下连续观察10个视野(同时记录红色信号的灌注图像),记录每个视野中的CD8阳性T细胞(绿色荧光)的数量,并取平均值作为每一个标本的平均CD8阳性T细胞浸润数量,并换算计量为数量/mm2。灌注情况的测定:首先取与测量CD8阳性T细胞浸润数量视野相对应的红色荧光信号视野。使用ImageJ软件测量红色Lectin阳性信号的面积,10个视野的平均值作为每个标本的Lectin阳性信号面积(即肿瘤血管的灌注面积),并最终换算为μm2的计量形式。
1.7统计学分析使用Graphpad Prism5进行统计学分析。比较计量资料之前,行Levene方差齐性检验。两组间的计量资料采用独立样本的t检验进行分析。每一标本的CD8阳性T细胞浸润数量及相应的Lectin阳性信号面积用于进行相关性分析,采用Spearman Correlation方法进行统计学分析。P<0.05为差异有统计学意义。
2 结 果
2.1二甲双胍增加CD8阳性T细胞的浸润数量对照组和二甲双胍干预组肿瘤组织内CD8阳性T细胞(绿色信号)数量差异有统计学意义(t=4.707,P<0.001)。两组结果的Levene方差齐性检验P>0.05,提示方差齐。结果分析显示,二甲双胍干预组小鼠4T1乳腺癌肿瘤组织内浸润的CD8阳性T细胞数量[(120.8±26.9)个/mm2]显著高于对照组[(67.9±22.9)个/mm2](图1、图2,表1),这提示持续二甲双胍干预明显增加了小鼠乳腺癌中的CD8阳性T细胞的浸润数量。
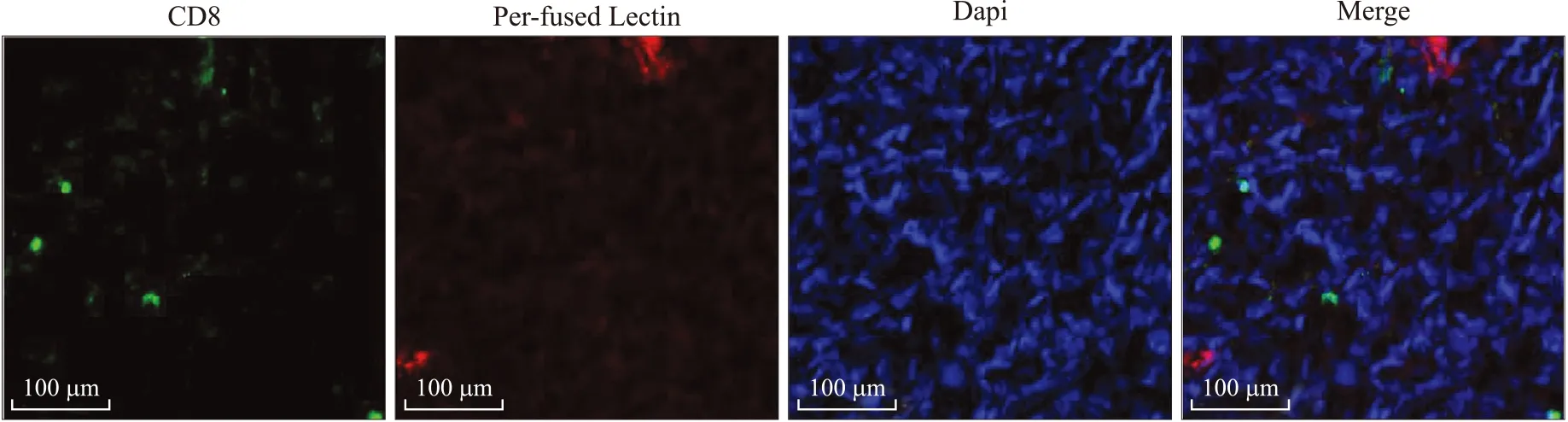
图1对照组4T1肿瘤内部仅可见少量浸润CD8阳性T细胞及Lectin灌注区域
Fig.1 Only a small number of CD8+T cells and lectin-perfused area were found in the untreated 4T1 cancer
绿色荧光:CD8抗体染色;红色信号:预先经心脏灌注的Lectin;蓝色:Dapi核染色。标尺:100 μm。
2.2二甲双胍可增加4T1肿瘤灌注对照组及二甲双胍干预组4T1肿瘤内部的Lectin阳性信号面积差异有统计学意义(t=3.494,P=0.003)。两组数据方差齐性(Levene检验P>0.05)。二甲双胍干预组4T1肿瘤内的Lectin阳性面积[(18 357.0±5 865.0)像素/μm2]显著高于对照组[(10 233.0±4 434.0)像素/μm2](图1、图2,表1)。这提示二甲双胍可增强肿瘤血液灌注。

图2二甲双胍组增加4T1肿瘤内部的Lectin灌注区域及浸润的CD8阳性T细胞数量
Fig.2 Metformin administration increased lectin-perfused area and the infiltrated CD8+T cells inside 4T1 cancer
白色箭头:伴随血流灌注进入肿瘤内部的CD8阳性T细胞;绿色荧光:CD8抗体染色;红色信号:预先经心脏灌注的Lectin;蓝色:Dapi核染色。标尺:100 μm。
表1各组4T1肿瘤内部CD8阳性T细胞浸润数量及被Lectin灌注的信号面积
Tab.1 Number of CD8+T cells infiltrated in the 4T1 cancer and lectin-perfused tumor area in each group


参数对照组二甲双胍干预组tPCD8+ T cells(n/mm2)67.9±22.9120.8±26.94.50.001Lectin+信号(μm2)10233.0±4434.018357.0±5865.03.50.003
2.3CD8阳性T细胞通过血流进入肿瘤内部二甲双胍干预组的4T1肿瘤中,观察显示有3个CD8阳性T细胞与红色Lectin信号共定位;其中有1个细胞的一侧已经突出Lectin信号的边界以外,提示该细胞可能正在从灌注血管内向肿瘤实质内发生迁移(图2)。这提示外周血中的CD8阳性T细胞可通过血流灌注进入肿瘤内部并最终进入肿瘤实质,进而发挥杀伤作用。
2.4肿瘤灌注面积与CD8阳性T细胞浸润数量呈线性相关对CD8阳性T细胞浸润数量及Lectin灌注面积进行Spearman Correlation分析。两组的CD8阳性T细胞浸润数量与Lectin灌注面积均呈线性相关(图3)。二甲双胍干预组的相关系数R为0.884,P=0.007;非干预组的相关系数R为0.928,P<0.001(图3)。
3 讨 论
二甲双胍是临床治疗2型糖尿病的传统药物,其良好的耐受性及低毒性一度使其成为首选治疗[1]。随着研究的不断深入,科学家们在临床前实验研究中逐渐发现,二甲双胍具有显著抑制肿瘤生长的作用。此外,基于人群的数据研究证实:服用二甲双胍的糖尿病患者多个系统的肿瘤发生率低于未服用组患者[2]。

图34T1肿瘤内部的CD8阳性T细胞浸润数量与Lectin灌注面积呈线性相关
Fig.3 The number of CD8+T cells infiltrated in the 4T1 cancer was linearly correlated with lectin-perfused area
A:对照组;B:二甲双胍干预组。SpearmanR为相关系数。
但是,有关二甲双胍发挥抗肿瘤的具体作用仍不十分清楚。本研究通过构建原位小鼠乳腺癌模型并用二甲双胍持续干预2周,发现可增加肿瘤的灌注水平及肿瘤内CD8阳性T细胞的浸润水平。大量研究数据已证实,肿瘤内CD8阳性T细胞的浸润数量与患者的预后密切相关[3]。因此,本研究结果对目前仍不十分清楚的二甲双胍抗肿瘤机制是一个重要补充。
本课题组前期研究中已发现:小剂量二甲双胍[<100 mg/(kg·d)]仅仅产生轻微的抗肿瘤作用。由于CD8阳性细胞的主要作用在于直接杀伤肿瘤细胞,因此,本研究不适合用小剂量进行干预观察,而所使用的剂量[250 mg/(kg·d)]是根据物种药物剂量换算公式(根据体表面积)换算所得。该剂量与临床剂量相匹配,从而能更好用于阐明二甲双胍的抗肿瘤机制,并使研究结果更具外推性。
CD8阳性T细胞是机体对抗肿瘤进展的一种重要因素[4]。CD8阳性T细胞主要通过接触性杀伤对肿瘤发挥作用,因此,肿瘤组织内的CD8阳性T细胞的浸润数量对于机体抗肿瘤作用至关重要。近来有研究证实:二甲双胍可通过增加肿瘤内的CD8阳性T细胞的浸润数量而发挥抗肿瘤作用[5-6]。本研究再次证实上述结果,并且进一步通过相关性分析的结果显示,增加的CD8阳性T细胞的浸润数量与增加的肿瘤灌注之间存在密切相关性。事实上,在机体处于免疫激活状态时,比如在肿瘤发生发展中,大量T细胞在胸腺中成熟后进入血液,并随血流进入病灶从而发挥免疫作用[7]。因此,在二甲双胍干预下产生的肿瘤灌注的改善可使更多的外周CD8阳性T细胞浸润到肿瘤内部。
本研究发现的二甲双胍增加肿瘤血流灌注可能具有更重要的意义。目前比较认可的观点是肿瘤在早期生长时就出现缺氧[8-9]。缺氧可以通过抑制肿瘤免疫、介导放化疗抵抗的机制以进一步促进肿瘤进展[10]。因此,二甲双胍通过增加肿瘤灌注带来的治疗意义不应该仅仅被局限于增加CD8阳性T细胞浸润。
本课题组之前的研究发现,二甲双胍具有抑制肿瘤异常血管生成的作用[11]。而对于二甲双胍是否对肿瘤血管的功能和结构状态产生影响则未进行深入报道。本研究的结果至少说明二甲双胍具有增强肿瘤血管功能状态的作用。据报道,血管功能与血管的成熟度密切相关,即与血管内皮层被血管平滑肌细胞包被的程度有关[12-13]。而且课题组新近发表的文章已经证实,二甲双胍具有改善肿瘤血管成熟度的作用[14],这也提示是血管功能得到改善的原因。
综上所述,本研究结果提示,二甲双胍介导的增强CD8阳性T细胞肿瘤浸润的作用与其产生的改善肿瘤灌注的作用密切相关。

