SIRT1/eNOS/NO通路在人参皂苷Rb1抗内皮细胞复制性衰老中的作用*
周 彬, 余舒杰, 刘定辉, 吴 琳, 王 敏, 柯世业, 刘 勇, 郝宝顺, 朱洁明, 钱孝贤, 2△
(中山大学 1附属第三医院心血管内科, 2中西医结合研究所, 广东 广州 510630)
21世纪全球逐步进入老龄化社会,随着年龄增长,很多心血管疾病的发生率急剧上升[1-2],而与增龄相关的血管内皮细胞衰老被认为是动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)发生的起始环节,成为了心血管疾病不良预后的重要因素[3]。因此,探讨衰老机制,寻找延缓衰老的干预方法对于年龄相关的心血管疾病的防治具有十分重要的意义。
沉默信息调节因子2同源蛋白1(silent mating type information regulation 2 homolog 1,SIRT1)是一种高度保守的依赖于烟酰胺腺嘌呤二核苷酸的去乙酰化酶,与调控生物体衰老和寿命密切相关,被称为“抗衰老酶”。近年来,SIRT1/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)/一氧化氮(nitric oxide,NO)通路活性下调被认为是参与内皮细胞衰老的重要因素[4]。
人参皂苷Rb1(ginsenoside Rb1,Rb1)是人参中含量最多的成分,有很强的抗氧化活性,在清除自由基、调节机体免疫力、改善认知及延缓衰老等方面发挥重要作用[5]。本研究拟建立符合机体自然衰老生理情况的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)复制性衰老模型,观察人参皂苷Rb1延缓内皮细胞衰老的作用,并从SIRT1/eNOS/NO通路探讨人参皂苷Rb1延缓内皮细胞衰老的机制。
材 料 和 方 法
1 材料
1.1细胞 采用原代培养的HUVECs。
1.2药物和试剂 人参皂苷Rb1购自成都普菲德生物技术有限公司,分子式为C54H92O23,分子量为1 109.31,为白色粉末状结晶,高效液相色谱鉴定纯度≥98%;M199购自HyClone;胎牛血清(fetal bovine serum,FBS)和I型胶原酶购自GIBCO;TRIzol试剂和转染试剂购自Invitrogen;逆转录试剂盒和荧光定量试剂盒购自TaKaRa;引物由Life Technologies设计并合成;预染蛋白Marker购自Thermo Fisher Scientific;兔抗SIRT1、纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1, PAI-1)和GAPDH多克隆抗体购自Proteintech Group;鼠抗eNOS单克隆抗体购自Abcam;辣根酶标记羊抗兔IgG和羊抗小鼠IgG购自武汉博士德生物工程有限公司;SIRT1 siRNA (siSIRT1)、荧光标记的siRNA及相应的阴性序列由百奥迈科生物技术有限公司设计并合成。
2 方法
2.1细胞分离培养及细胞“年龄”的计算 取健康无菌新生儿脐带,在无菌条件下用PBS 冲洗3 遍,然后用0.1%Ⅰ型胶原酶消化15 min,收集胶原酶细胞混合液,1 200 r/min离心5 min,弃上清,加完全培养基混匀种于培养瓶里培养。当细胞生长密度达90%以上时用0.05%胰酶消化细胞,按1∶3传代培养。细胞“年龄”用累积细胞群体倍增水平(cumulative population-doubling level,CPDL)表示,计算公式为:PD(population doublings)=(log10F-log10I)/0.301 (F表示细胞达到传代水平时的细胞数;I表示上一次种入的细胞数),每次传代计算得到的PD与之前PD总和相加即为CPDL。CPDL能比较客观地反映细胞的“年龄”,在实验中,比代数的重复性更好。
2.2细胞鉴定 取CPDL为2和30的细胞,由中山大学附属第一医院检验科采用流式细胞术进行细胞鉴定。
2.3细胞衰老模型建立及分组
2.3.1建立HUVECs复制性衰老模型 对不同CPDL时期的HUVECs进行细胞形态、衰老相关β-半乳糖苷酶(senescence-associated β-galactosidase, SA-β-Gal)染色以及PAI-1的蛋白表达的观察,当上述衰老相关指标出现并且比较稳定时,该CPDL时期的细胞即作为本实验的衰老模型。
2.3.2探讨Rb1抗内皮细胞复制性衰老的最佳浓度 将CPDL为16的细胞分为对照组、20 μmol/L Rb1组、40 μmol/L Rb1组、80 μmol/L Rb1组和100 μmol/L Rb1组,将不同浓度的药物加入细胞培养液中培养48 h,通过观察SA-β-Gal染色阳性率选择Rb1的最佳浓度。
2.3.3探讨人参皂苷Rb1是否通过SIRT1/eNOS/NO通路抗内皮衰老 将细胞分为对照(control)组、阴性对照(negative control, NC)组、siSIRT1组、Rb1组和siSIRT1+Rb1组,其中,siSIRT1组在内皮细胞生长至30%~50%时进行siSIRT1转染,转染6 h换液继续培养48 h; siSIRT1+Rb1组在转染6 h后加入80 μmol/L人参皂苷Rb1再继续培养48 h。提取细胞总RNA,检测SIRT1、eNOS和PAI-1的mRNA表达。
2.4RNA干扰实验 按说明书操作,制备转染siSIRT1的HUVECs。RNA干扰序列是由百奥迈科生物技术有限公司设计合成。siSIRT1的正义链序列为5’-GGUCAAGGGAUGGUAUUUATT-3’, 反义链序列为5’-UAAAUACCAUCCCUUGACCTT-3’; siRNA阴性对照正义链序列为5’-UUCUCCGAACGUGUCACGUTT-3’, 反义链序列为5’-ACGUGACACGUUCGGAGAATT-3’。
2.5Real-time PCR检测SIRT1、PAI-1及eNOS的mRNA表达 取已干预并培养好的细胞用TRIzol提取RNA,测定并计算RNA的纯度和浓度;在逆转录酶的作用下合成cDNA。Real-time PCR按照TaKaRa SYBR®PremixExTaqTMII (Tli RNaseH Plus)说明书操作。引物序列见表1。
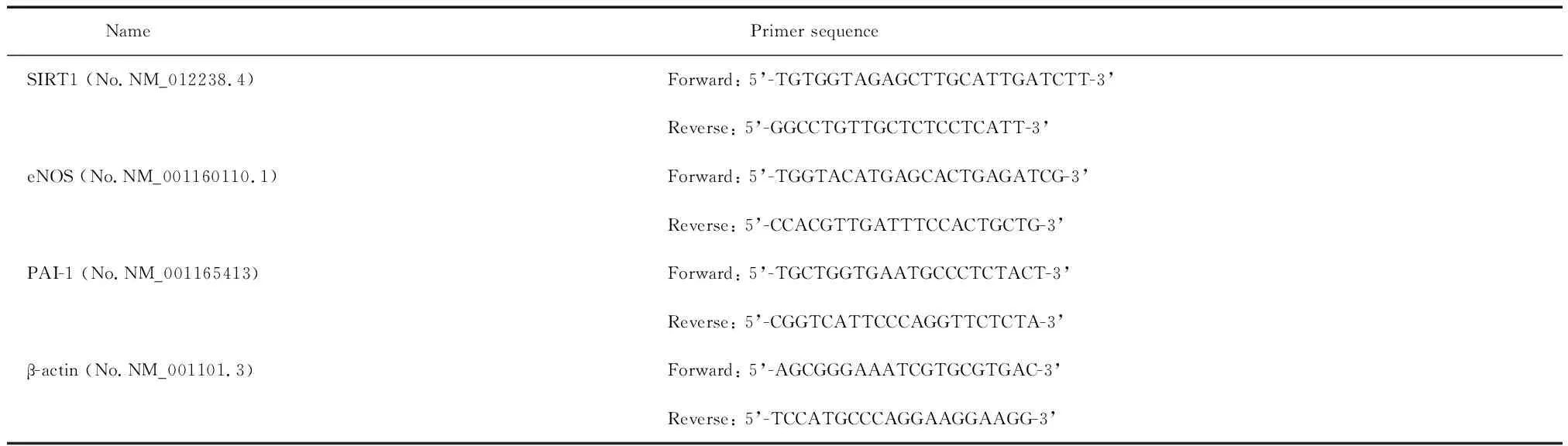
表1 Real-time PCR引物序列
2.6Western blot实验 取已干预和培养好的细胞,采用总蛋白提取试剂盒提取细胞总蛋白,用BCA法对提取的蛋白进行浓度测定。取30 μg总蛋白进行SDS-PAGE分离,然后转移到PVDF膜上。用5%脱脂奶粉室温封闭1 h后,加入相应I抗(SIRT1 1∶2 000, PAI-1 1∶10 000,eNOS 1∶1 000, GAPDH 1∶1 000),4 ℃摇床过夜孵育洗膜;然后用Ⅱ抗室温孵育1 h,在暗室中用增强化学发光检测试剂显色,拍片晾干,计算机扫描,采用Quantity One 软件分析蛋白条带。
2.7细胞培养上清液NO含量检测 采用硝酸还原酶法,严格按试剂盒说明书操作。
3 统计学方法
采用SPSS 20.0软件进行分析,计量资料以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析及SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 HUVECs的鉴定
流式细胞术检测CPDL为2和30的内皮细胞CD31抗原阳性率均在99%以上,符合内皮细胞特性,见图1。
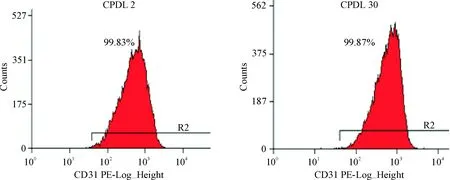
Figure 1.Detection of CD31 expression on the surface of HUVECs by flow cytometry.
图1流式细胞术检测内皮细胞表面CD31的表达
2 HUVECs复制性衰老模型的建立
随着CPDL的增加,细胞呈现生长缓慢、边界模糊、胞体增大、细胞形态由短梭形变为长梭形为长出长“触角”及贴壁细胞减少等改变。CPDL为16时显微镜下可见部分细胞形态发生改变,CPDL为30时可见整个视野下细胞形态均发生变化,见图2。
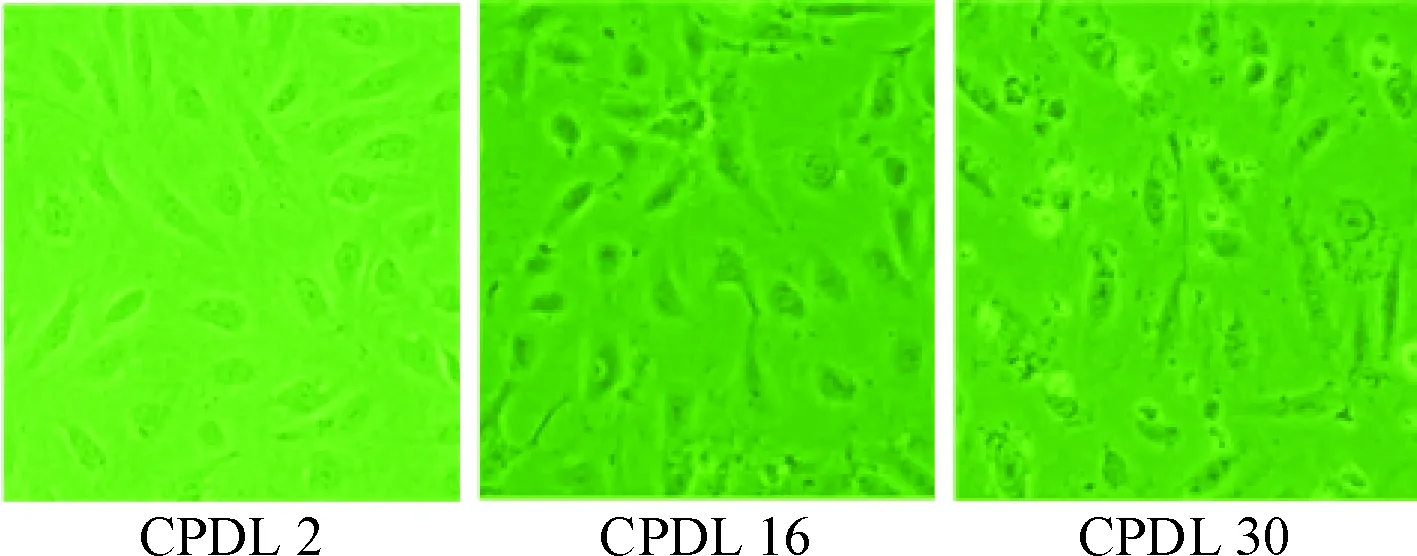
Figure 2.The morphological changes of HUVECs at different CPDL (×200).
图2显微镜下不同CPDL的HUVECs形态
我们以每次传代细胞的时间为横坐标,以相应传代细胞时点计算所得CPDL为纵坐标绘制HUVECs的增长曲线,从中可以看出,当CPDL>25时,细胞增殖速度明显减慢,见图3。
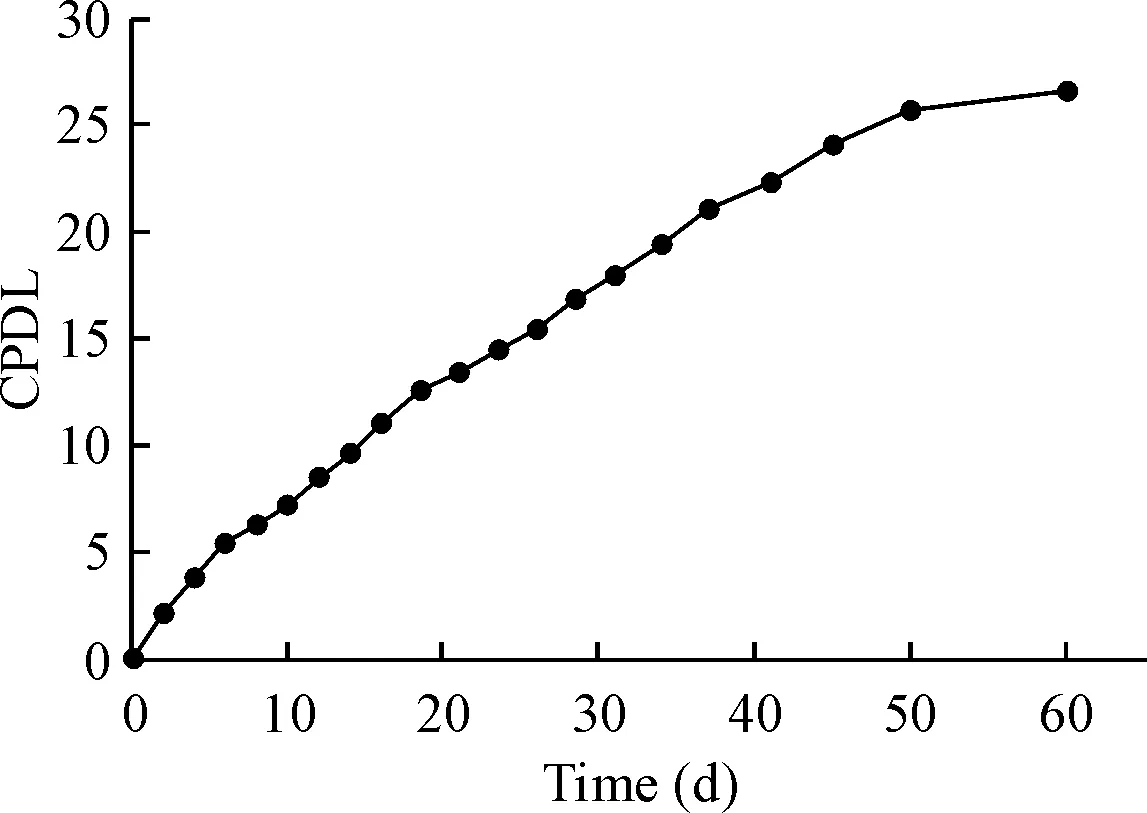
Figure 3.The growth curve (CPDL) of HUVECs.
图3HUVECs的CPDL增长曲线
随着CPDL的增加,SA-β-Gal阳性细胞及PAI-1蛋白表达均增多,CPDL为2时几乎没有SA-β-Gal阳性细胞,PAI-1蛋白表达较弱; CPDL为16时SA-β-Gal阳性细胞增多,PAI蛋白表达增强;而到了CPDL为30时,几乎所有的细胞均被蓝染,PAI蛋白表达也明显增强(P<0.05),见图4、5。本实验中观察到CPDL≥16以后细胞衰老的相关指标更加稳定,当CPDL>25时细胞增殖几乎进入停滞平台期,CPDL在16~25之间的HUVECs可作为复制性衰老模型进行研究,为节约时间及经济成本,本实验选用CPDL为16的HUVECs进行后续的实验研究。
3 人参皂苷Rb1对复制性衰老HUVECs的影响
不同浓度(20、40、80和100 μmol/L)的人参皂苷Rb1分别加入CPDL为16的HUVECs中,培养48 h后,观察SA-β-Gal染色情况。结果显示,人参皂苷Rb1 作用于复制性衰老HUVECs,与对照组(0 μmol/L)相比,SA-β-Gal 染色阳性细胞数明显降低(P<0.05),以80 μmol/L Rb1 组效果最佳,见图6。因此,我们选择了此浓度用于后续的研究。
4 RNA干扰SIRT1对人参皂苷Rb1抗HUVECs复制性衰老的影响
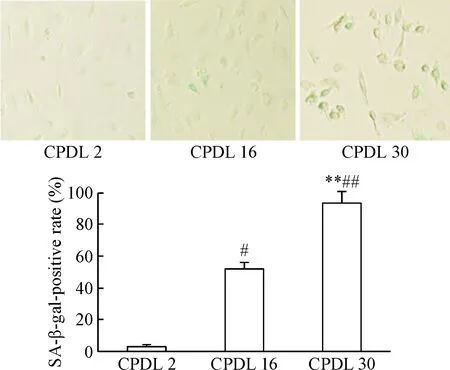
Figure 4.The numbers of SA-β-gal positive staining cells in the HUVECs at different CPDL (×200). Mean±SD.n=3.#P<0.05,##P<0.01vsCPDL 2 group;**P<0.01vsCPDL 16 group.
图4不同CPDL内皮细胞SA-β-gal染色阳性细胞
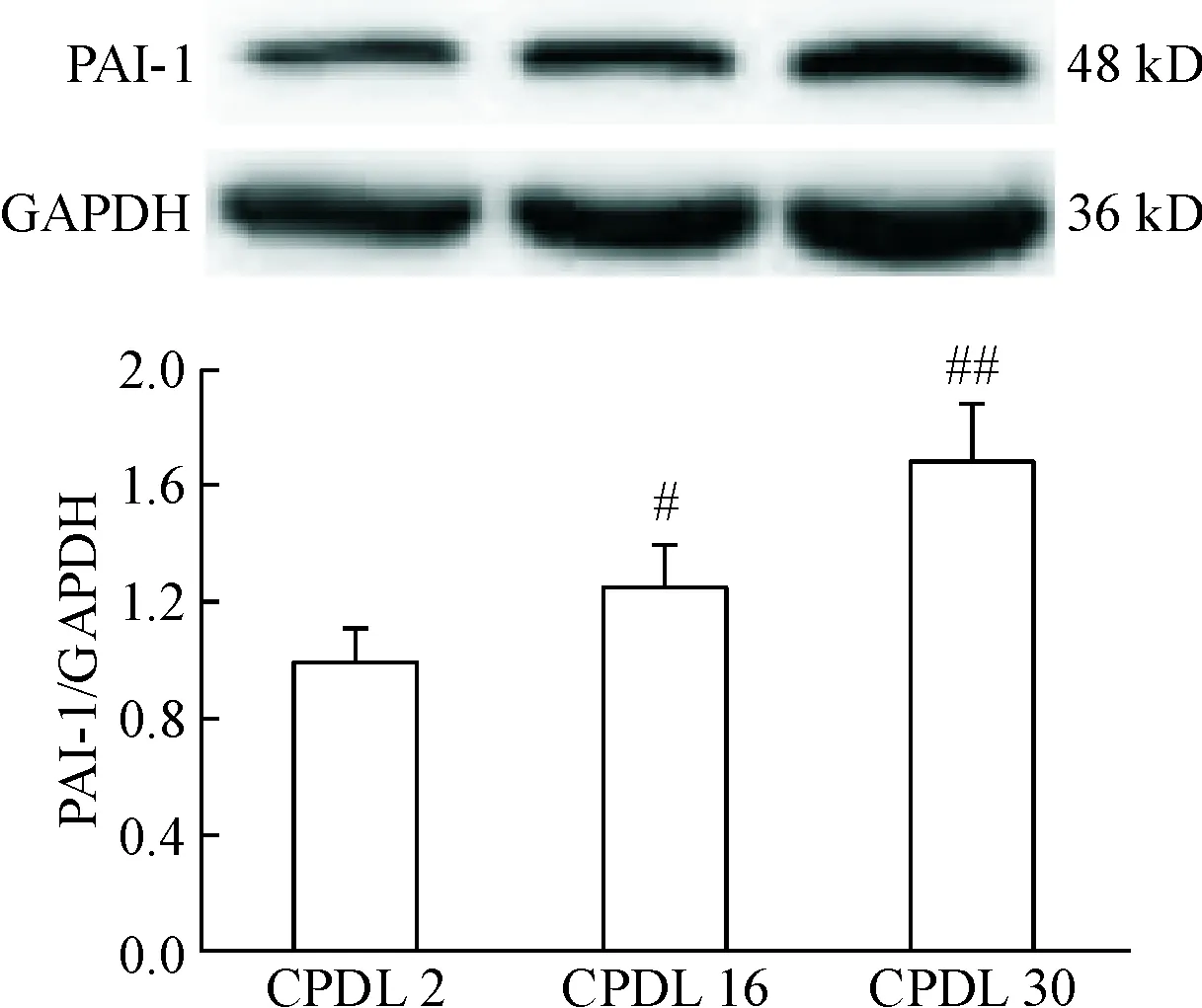
Figure 5.The protein expression of PAI-1 in the HUVECs at different CPDL. Mean±SD.n=3.#P<0.05,##P<0.01vsCPDL 2 group.
图5不同CPDL的内皮细胞PAI蛋白的表达
4.1人参皂苷Rb1和下调SIRT1表达对SIRT1、eNOS和PAI-1 mRNA表达的影响 与对照组相比,沉默SIRT1后SIRT1和eNOS的mRNA水平显著下降,衰老相关蛋白PAI-1的mRNA水平显著上升(P<0.05);与对照组相比,经人参皂苷Rb1干预后,SIRT1及eNOS的mRNA水平均明显升高,而PAI-1的mRNA水平明显下降(P<0.05); siSIRT1+Rb1组的SIRT1、eNOS及PAI-1的mRNA水平与siSIRT1组相比差异无统计学显著性,见图7。
4.2人参皂苷Rb1和沉默SIRT1对SIRT1、eNOS和PAI-1 蛋白表达的影响 在检测mRNA的基础上,我们对沉默SIRT1后SIRT1、eNOS和PAI-1等蛋白表达情况也进行了检测。与对照组相比,沉默SIRT1后SIRT1和eNOS的蛋白表达水平明显下降,PAI-1的蛋白表达明显增加(P<0.05);与对照组相比,经人参皂苷Rb1干预后,SIRT1和eNOS的蛋白表达水平均明显升高,而PAI-1 的蛋白表达水平明显下降(P<0.05); siSIRT1+Rb1组的SIRT1、eNOS 及PAI-1蛋白表达水平与siSIRT1组相比,差异无统计学显著性,见图8。
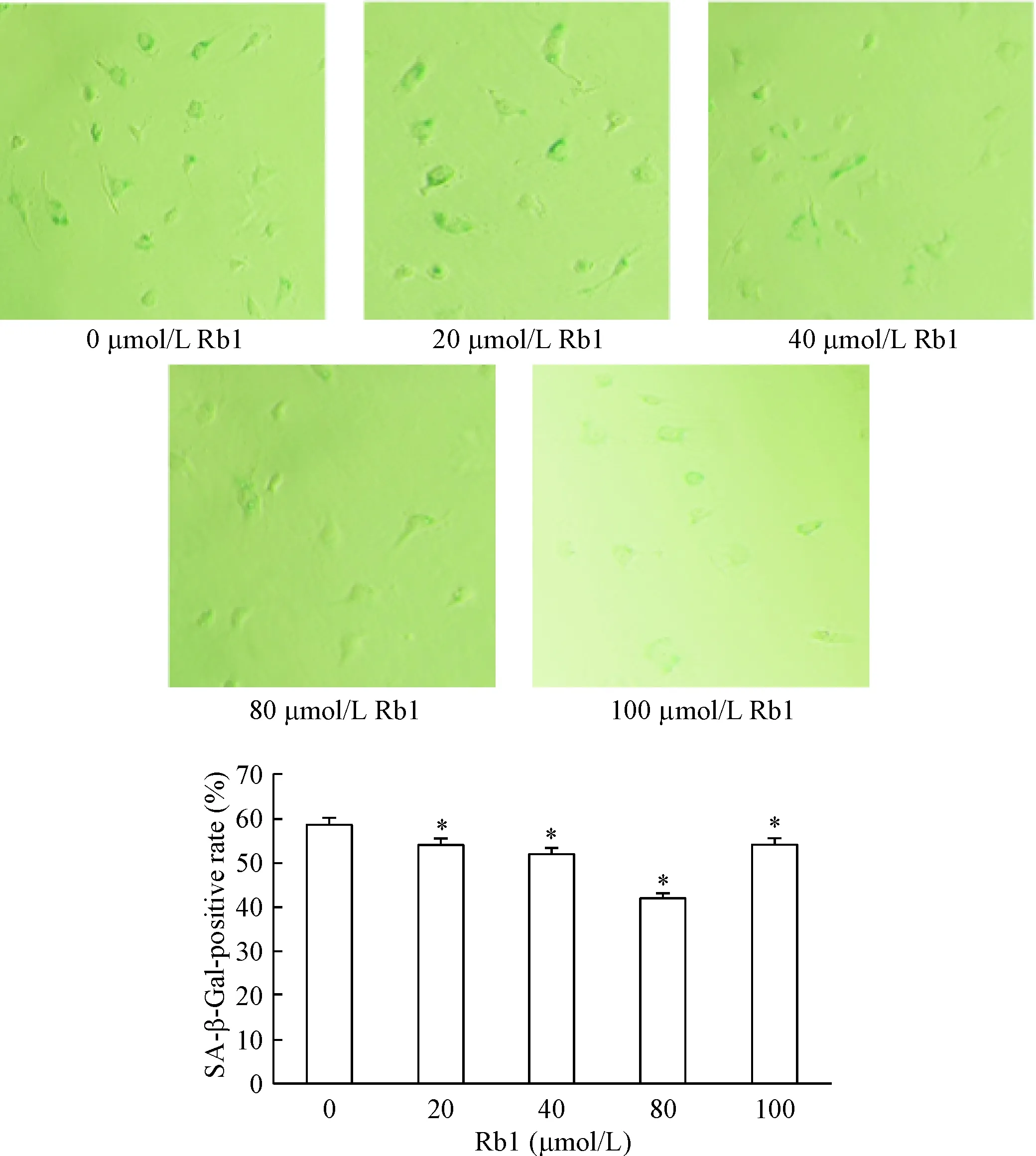
Figure 6.The effect of Rb1 at different concentrations on cellular SA-β-Gal staining (×200). Senescent cells were identified as blue-stained cells by SA-β-Gal staining. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图6不同浓度人参皂苷Rb1对细胞SA-β-gal染色的影响
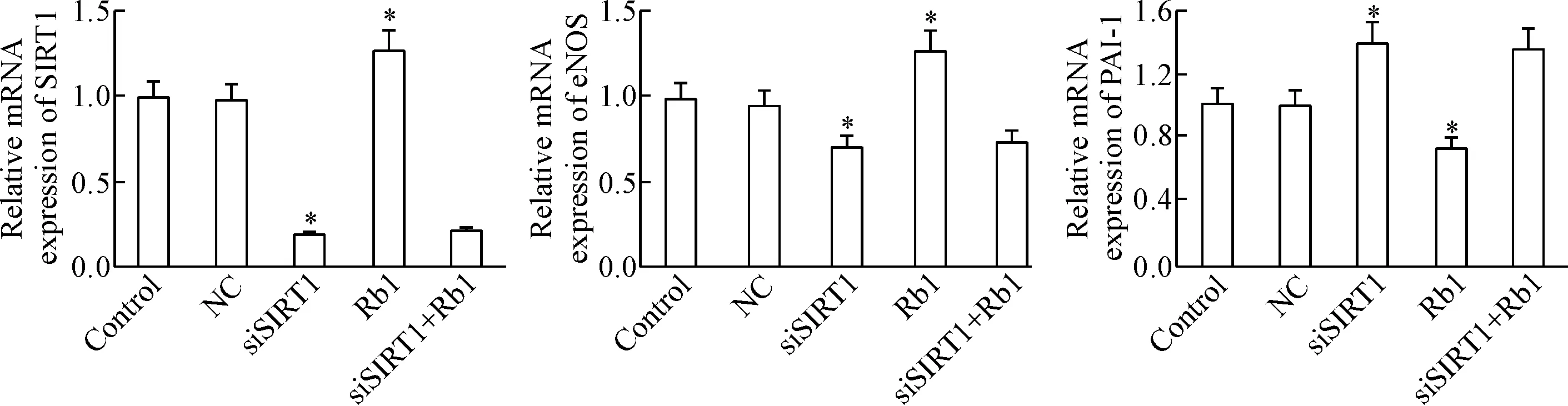
Figure 7.The effect of Rb1 and down-regulation ofSIRT1 expression on the mRNA expression of SIRT1, eNOS and PAI-1. Mean±SD.n=3.*P<0.05vscontrol group.
图7人参皂苷Rb1和下调SIRT1的表达对衰老细胞SIRT1、eNOS及PAI-1mRNA表达的影响
4.3人参皂苷Rb1和沉默SIRT1对NO含量的影响 eNOS蛋白和活性的变化直接证据是影响NO的产生,因此我们收集细胞上清液对NO的浓度也同时进行了检测。与对照组相比,siSIRT1组 NO的浓度明显降低(P<0.05),Rb1组NO的浓度明显升高(P<0.05);而siSIRT1+Rb1组NO的浓度与SIRT1 siRNA组相对无明显变化,见图9。
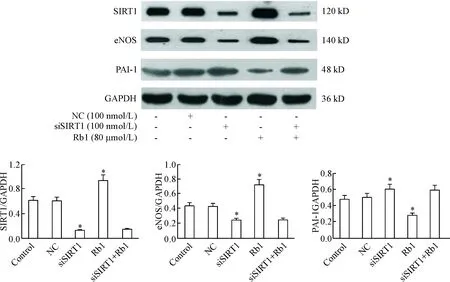
Figure 8.The effect of Rb1 and down-regulation ofSIRT1 expression on the protein expression of SIRT1, eNOS and PAI-1. Mean±SD.n=3.*P<0.05vscontrol group.
图8人参皂苷Rb1和下调SIRT1的表达对衰老细胞SIRT1、eNOS及PAI-1蛋白表达的影响
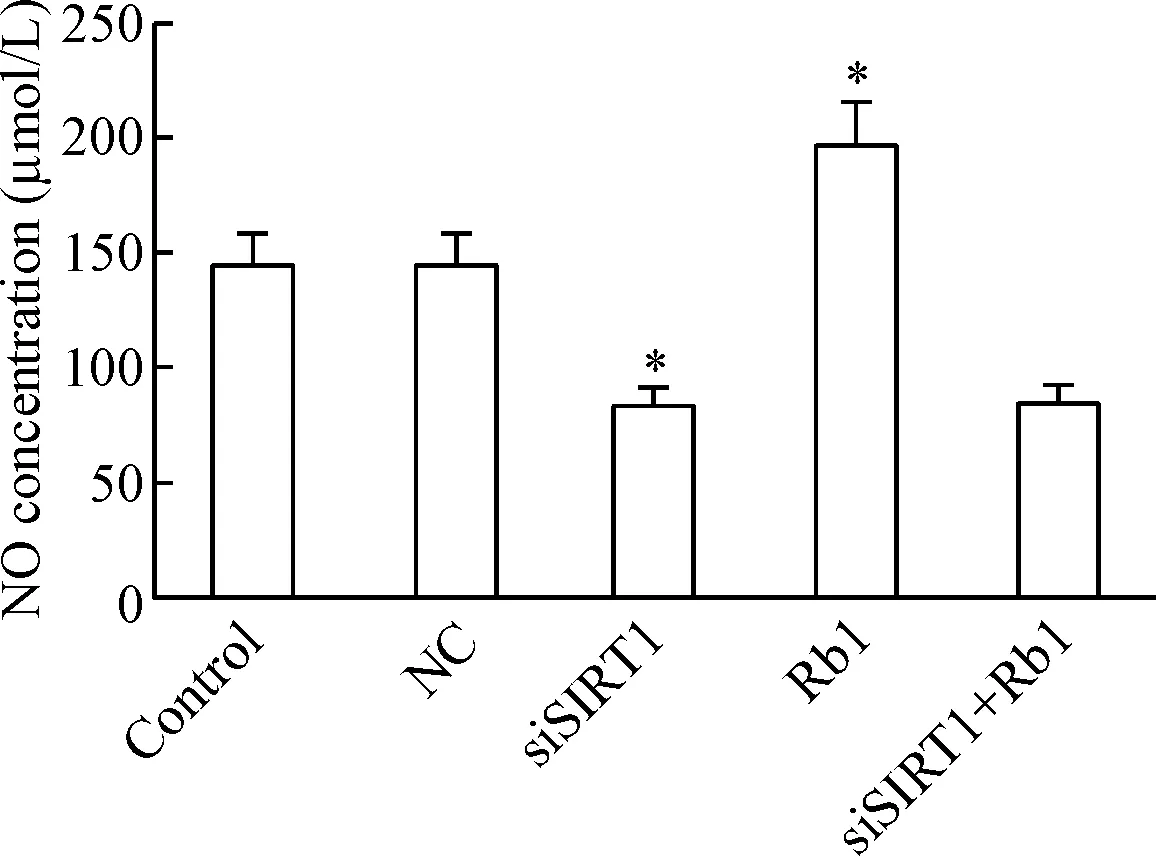
Figure 9.The effects of Rb1 and down-regulation ofSIRT1 expression on NO concentration in the cell culture supernatant. Mean±SD.n=3.*P<0.05vscontrol group.
图9人参皂苷Rb1和下调SIRT1的表达对衰老细胞上清液NO含量的影响
讨 论
本课题研究发现,80 μmol/L人参皂苷Rb1能明显上调SIRT1表达,促进eNOS的合成,增加NO的含量,延缓内皮细胞复制性衰老。
衰老的内皮细胞与年龄相关性血管疾病如动脉粥样硬化等密切相关[6-10]。细胞衰老模型分为复制性衰老模型和早熟性衰老模型,复制性衰老模型由于更符合人体自然衰老的生理过程,目前得到越来越多的研究和应用。本实验中观察到,CPDL≥16以后细胞衰老出现的相关指标更加稳定。镜下观察内皮细胞体积变大,边界模糊,形态扁平,其衰老染色阳性率超过50%,同时PAI-1的表达也明显增多,衰老表型和分子变化符合细胞衰老模型的特点。
衰老是一个极为复杂的过程,受多种因素调控。目前关于衰老的理论主要有自由基学说、DNA损伤、端粒学说和炎症学说等。Sirtuins家族的发现为衰老机制的深入研究提供了新的方向。SIRT1作为与酵母Sir2同源性最高的组蛋白去乙酰化酶,参与了细胞内多种生理功能的调节,包括代谢调节、自噬作用和炎性反应等[11],在细胞衰老和神经退行性疾病中表现出很强的保护作用,成为目前研究的热点。
近年来,研究发现,SIRT1在血管内皮功能及神经系统中的作用主要是通过调节eNOS/NO系统而实现的。SIRT1/eNOS被认为是治疗增龄相关性疾病及抗衰老的潜在靶点[4]。有研究表明,在衰老的小鼠主动脉内皮细胞中,SIRT1表达以及磷酸化的eNOS明显减少,而乙酰化的eNOS明显增多,NO生成减少[12]。Xia等[13]在采用SIRT1激动剂白藜芦醇观察衰老的研究中发现,SIRT1还可以促进eNOS启动子激活而调控eNOS的合成。
人参是我国传统的中医药材,具有广泛的药理活性,在我国已有上千年的应用历史,素有“百草药王”之美称。现代医学认为,人参能补五脏,有很强的抗疲劳、延缓衰老、提高机体代谢与免疫的功能,久服可延年益寿。已有研究发现,人参皂苷Rb1 对血管内皮及神经细胞具有保护作用[14-16]。我们课题组既往研究也发现人参皂苷Rb1 可能通过改善氧化应激发挥延缓H2O2诱导的人脐静脉内皮细胞早熟性衰老的作用[17]。本实验在我们既往研究基础上,建立内皮细胞复制性衰老模型,进一步探讨人参皂苷Rb1抗内皮细胞复制性衰老的机制。结果显示,人参皂苷Rb1干预后,SIRT1和eNOS表达及NO的生成均明显增加,而SA-β-Gal染色阳性细胞数目和PAI-1表达明显减少;我们进一步沉默SIRT1后发现,衰老细胞eNOS的mRNA和蛋白表达明显减少,NO生成减少,PAI-1表达明显增加;然而,在沉默SIRT1基础上加用人参皂苷Rb1干预,上述指标并未见明显变化。这说明,人参皂苷Rb1可以上调SIRT1表达,促进eNOS的合成,增加NO的含量,从而延缓内皮细胞复制性衰老。若对SIRT1进行RNA干扰,则eNOS 表达下降,NO的合成减少,同时人参皂苷Rb1不能发挥抗内皮细胞衰老的作用,这些数据显示了SIRT1/eNOS/NO在人参皂苷Rb1抗内皮细胞复制性衰老中具有重要地位。
本研究结果表明人参皂苷Rb1可通过调控SIRT1/eNOS/NO信号通路延缓复制性内皮细胞衰老。本课题探讨了人参皂苷Rb1延缓复制性内皮细胞衰老的可能机制,但仍需在体内及临床研究中进一步论证,最终用于ASCVD的防治。

