干扰TGF-βⅡ型受体表达对NB4细胞增殖、分化及凋亡的影响*
陈美玲, 张淑遐, 郭雅斐, 陈莹莹, 吴 勇
(福建省血液病研究所, 福建省血液病学重点实验室, 福建医科大学附属协和医院, 福建 福州 350004)
转化生长因子β1(transforming growth factor-β1,TGF-β1)是最强的血细胞增殖抑制因子,能够有效抑制造血细胞增殖,诱导造血细胞凋亡[1-3],其与造血细胞表面相应的特异性受体结合,参与调控目的基因的转录过程而发挥生物学作用[4-6]。TGF-β受体主要有TβRI、TβRII和TβRIII 3三种亚型。已知三氧化二砷(arsenic trioxide,ATO)可诱导人急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)NB4细胞凋亡,但TβRII在全反式维甲酸(all-transretinoic acid,ATRA)诱导的NB4细胞分化及ATO诱导的NB4细胞凋亡中的作用不甚清楚。本文以急性早幼粒细胞白血病细胞系NB4为研究对象,采用RNA干扰(RNA interference,RNAi)技术,下调NB4细胞内源性TβRII水平,研究干扰TβRII表达对细胞生长、分化及凋亡的影响。
材 料 和 方 法
1 材料
NB4细胞由福建省血液病研究所保存。ATRA和ATO(Sigma);TGF-β1 (PeproTech);DMSO(上海生物试剂厂);胎牛血清( 灏洋天津生物公司);DMEM、Opti-MEM和RPMI-1640培养基(GIBCO);Lipofectamine 2000、TRIzol试剂和PCR引物(Invitrogen);qPCR试剂盒(Roche);逆转录试剂盒(Thermo);Western blot抗体(eBioscience);蛋白提取液(PIERCE);CCK-8试剂盒(同仁化学研究所);流式细胞术凋亡检测试剂盒(凯基生物公司);Western blot定影/显影粉(世纪奥博商贸公司)。
2 方法
2.1稳定表达TβRII-shRNA NB4 细胞株的建立 构建4种靶向TβRII序列(表1)的RNAi 慢病毒载体后,采用Western blot 法外源筛选有效RNAi 载体,选择有效LV-TGFBR2-RNAi (9759-1)包装慢病毒颗粒,由上海吉凯生物有限公司完成。采用慢病毒LV-TGFBR2-RNAi (9759-1)转染NB4细胞,获得稳定表达TβRII-shRNA NB4 细胞株。RT-qPCR鉴定TβRII的mRNA 在TβRII-shRNA NB4细胞中的表达情况。TβRII的上游引物序列为5’-CACCGCACGTTCAGAAGTC-3’,下游引物序列为5’-CACAGATGGAGGTGATGCTG-3’;β-actin的上游引物序列为5’- AGTGTGACGTGGACATCCGCAA-3’,下游引物序列为5’-ATCCACATCTGCTGGAAGGTGGAC-3’。qPCR体系(20 μL)如下:2× Taq PCR Mix 10 μL,目的基因上、下游引物为 1 μL,去离子水8 μL,cDNA 1 μL。每组取3个平行孔。采用7500 Real-Time PCR System,扩增的具体循环参数: 50 ℃ 2 min, 94 ℃ 10 min; 94 ℃ 15 s, 55 ℃ 30 s, 72 ℃ 40 s, 共40个循环。同时扩增β-actin作为内参照。利用2-ΔΔCt分析数据并进行数据处理,Western blot鉴定TβRII蛋白在TβRII-shRNA NB4 细胞中的表达情况。

表1 TβRII-shRNA靶序列
2.2CCK-8法观察TGF-β1对TβRII-shRNA NB4 细胞活力的变化 收集对数生长期的TβRII-shRNA NB4细胞,以亲代NB4细胞作为对照组,实验组加入不同终浓度(0、1、2、4、8和10 μg/L)的TGF-β1, 用含10%胎牛血清的RPMI-1640培养基,将细胞密度调整为4×107/L,随后将其种于96孔板,将每孔的总体积定为200 μL,每组设复孔3个。放置37 ℃、5% CO2培养箱中进行培养 24、48、72和96 h,随后每孔加CCK-8溶液20 μL,37 ℃孵育120 min,在酶标仪上振荡10 min,以空白组为零点进行校正测得每孔的吸光度(A)值(波长490 nm/630 nm),并将其与时间分别作为纵、横坐标绘制生长曲线,再计算TGF-β1对各组细胞的IC50。
2.3流式细胞术检测CD11b表达水平观察ATRA对TβRII-shRNA NB4细胞分化的影响 在TβRII-shRNA NB4细胞和亲代NB4细胞培养体系中分别加入不同终浓度(0、0.01、0.02、0.04、0.08和0.1 μmol/L)的ATRA,对照组于上述2种细胞加入等体积的DMSO。收集对数生长期的2种细胞,用含10%胎牛血清的RPMI-1640培养基调整细胞密度为2×107/L,分别接种于6孔板,按需加入RPMI-1640稀释的ATRA,使终体积为5 mL,培养96 h。收集上述各组细胞,1 000 r/min离心5 min后弃上清,PBS洗涤1遍,加200 μL PBS重悬细胞,加5 μL PE标记的CD11b抗体,室温下避光孵育20 min后,加1 mL PBS 1 000 r/min离心5 min后吸弃上清,加200 μL PBS重悬,上流式细胞仪(B&D)检测。实验重复3次。
2.4瑞氏-吉姆萨染色法检测ATRA对TβRII-shRNA NB4细胞分化的影响 以加入DMSO的NB4细胞和TβRII-shRNA NB4细胞为对照组,加入终浓度为0.02 μmol/L ATRA的上述细胞为实验组。收集对数生长期的2种细胞,用含10%胎牛血清的RPMI-1640培养基调整细胞密度为2×107/L,分别接种于96孔板中,加入RPMI-1640稀释的ATRA,使终体积为200 μL。培养96 h后取细胞进行涂片,待载玻片干后,滴加瑞氏-吉姆萨染液覆盖细胞30 s,滴加等量蒸馏水,混匀1 min,水冲洗数秒,待玻片干后,在显微镜下观察细胞形态。
2.5RT-qPCR 检测ATO 诱导NB4 细胞凋亡对TβRII mRNA表达的影响 实验组为加入不同浓度(2、4和8 μmol/L)ATO的TβRII-shRNA NB4细胞和亲代NB4细胞,对照组为加入等体积DMSO的上述2种细胞。收集活力好、处于对数生长期的上述细胞,用含10% 胎牛血清的 RPMI-1640培养基,将细胞密度调整为5×108/L,随后将其种于6孔板,依次加入稀释好的ATO溶液,每孔总体积为5 mL。培养1 d后收集并离心获得细胞沉淀,加入预冷PBS 1 mL,轻摇使细胞呈悬浮态,于4 ℃ 离心机,1 000 r/min离心5 min,吸弃上清后,重复洗涤1次,提取总RNA,RT-qPCR 检测TβRII mRNA表达水平,方法同上。
2.6Annexin V-FITC/PI双标记流式细胞术检测ATO对TβRII-shRNA NB4细胞凋亡的影响 实验组为加入不同浓度(2、4和8 μmol/L)ATO的TβRII-shRNA NB4细胞和亲代NB4细胞,对照组为加入等体积DMSO的上述2种细胞。收集活力好、处于对数生长期的上述细胞,用含10% 胎牛血清的RPMI-1640培养基,将细胞密度调整为 5×108/L,随后将其种于6孔板,依次加入稀释好的ATO溶液,每孔总体积为5 mL。培养1 d后收集并离心获得细胞沉淀,加入预冷PBS 1 mL,轻摇使细胞呈悬浮态,于4 ℃、1 000 r/min离心5 min,吸弃上清后,重复洗涤1次,再使细胞悬浮于100 μL结合缓冲液中,各加入5 μL PI及Annexin V-FITC混匀后避光条件下,室温反应15~20 min,加入400 μL结合缓冲液,于60 min内上流式细胞仪检测。
2.7AO/EB染色法检测ATO对TβRII-shRNA NB4细胞凋亡的影响 实验组为加入8 μmol/L ATO的TβRII-shRNA NB4 细胞和亲代NB4细胞,以加入DMSO的上述2种细胞为对照组。收集活力好,生长对数期的上述细胞,用含10%胎牛血清的RPMI-1640培养基,将细胞密度调整为 5×108/L,随后将其种于6孔板,加入稀释好的ATO溶液,每孔总体积为5 mL。培养24 h后,收集上述各组细胞,PBS洗涤后使其再次悬浮于PBS中,细胞浓度同上,取AO/EB荧光染色混合液4 μL,加入100 μL细胞悬液中,吹打混匀滴到载玻片上,加上盖玻片后,立刻观察荧光成像并进行拍照记录。AO和EB均可以进入细胞核,前者能通过胞膜完整的细胞嵌入胞核DNA,后者则只能通过受损细胞嵌入胞核DNA,二者荧光分别为绿色、橘红色。镜下计数200个细胞,计算凋亡细胞所占比例。
3 统计学处理
以GraphPad Prism 5.0作为分析软件,数据用均数±标准差(mean±SD)表示,各组间均数比较采用t检验或单因素方差分析。以P<0.05表示差异有统计学意义。
结 果
1 TβRII-shRNA NB4细胞株TβRII的mRNA 和蛋白水平下降
RT-qPCR检测显示,TβRII-shRNA NB4细胞TβRII的mRNA表达水平较NB4细胞显著降低(P<0.01),见图1A;Western blot检测结果显示,TβRII-shRNA NB4细胞的TβRII蛋白水平显著下降(P<0.01),见图1B。
2 TGF-β1对TβRII-shRNA NB4细胞活力的影响
CCK-8实验结果显示,TGF-β1对NB4细胞及TβRII-shRNA NB4 细胞活力抑制作用呈时间及剂量依赖性,但对TβRII-shRNA NB4细胞的活力抑制作用弱于NB4细胞(P<0.05),见图2。
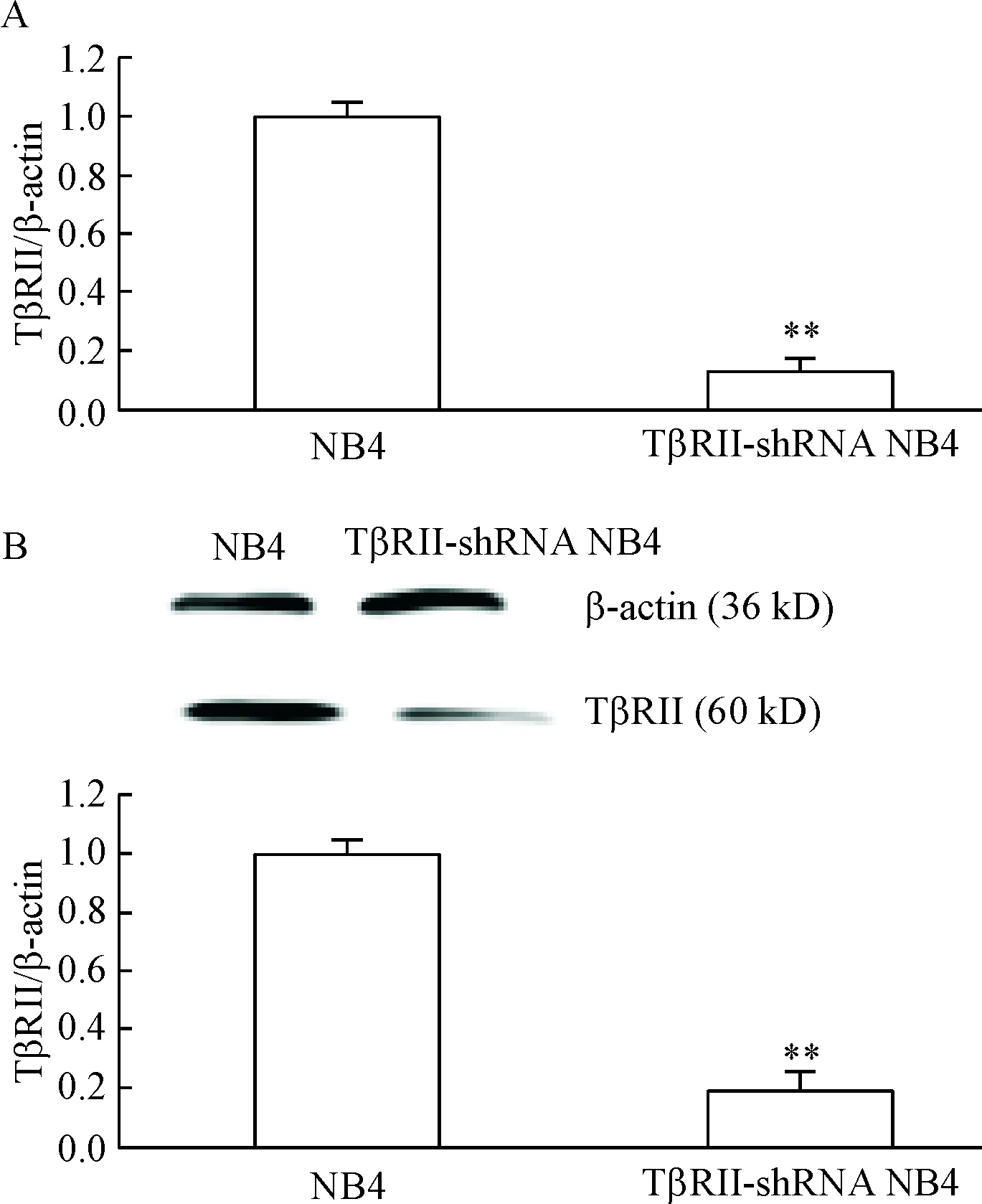
Figure 1.The expression of TβRII in NB4 cells and TβRII-shRNA NB4 cells. A: the relative mRNA expression of TβRII detected by RT-qPCR; B: the protein expression of TβRII detected by Western blot. Mean±SD.n=3.**P<0.01vsNB4 group.
图1TβRII在NB4细胞和TβRII-shRNANB4细胞中的表达
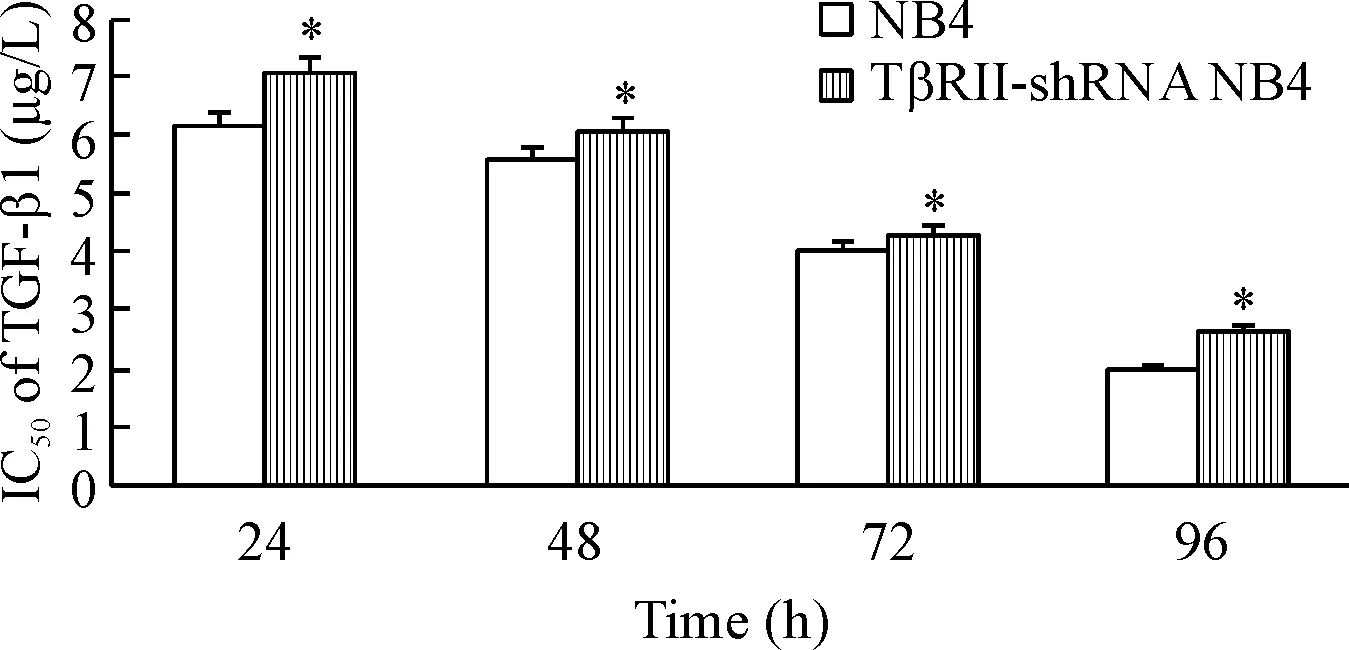
Figure 2.The viability of TβRII-shRNA NB4 cells and NB4 parental cells after TGF-β1 treatment was detected by CCK-8 assay. Mean±SD.n=3.*P<0.05vsNB4 group.
图2CCK-8法检测TGF-β1处理后TβRII-shRNANB4细胞的活力
3 ATRA对TβRII-shRNA NB4细胞分化的影响
流式细胞术检测细胞表面分化抗原CD11b的表达情况,结果显示经不同浓度的ATRA孵育96 h后,NB4细胞及TβRII-shRNA NB4细胞表面的CD11b抗原表达量随着ATRA浓度的增加而增高,呈剂量依赖性;但TβRII-shRNA NB4细胞的CD11b表达量低于同样浓度ATRA处理的NB4细胞(P<0.05),见图3。
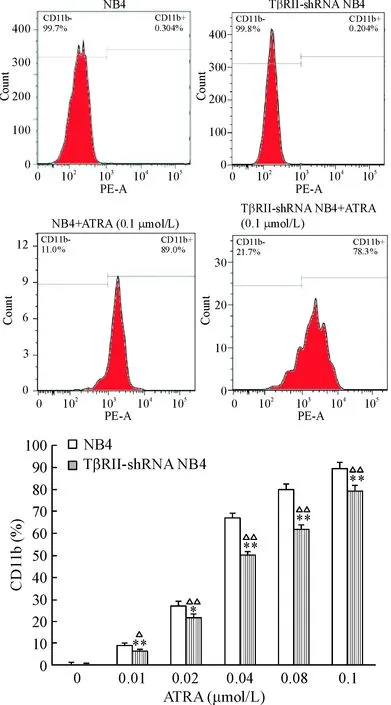
Figure 3.The expression of CD11b on TβRII-shRNA NB4 cells and NB4 parental cells treated with ATRA for 96 h was detected by flow cytometry. Mean±SD.n=3.*P<0.05,**P<0.01vsNB4 group;△P<0.05,△△P<0.01vs0 μmol/L.
图3检测CD11b水平评价ATRA对TβRII-shRNANB4细胞分化的影响
瑞氏-吉姆萨染色法检测细胞分化情况,结果发现NB4细胞及TβRII-shRNA NB4细胞染色质细致疏松,核仁明显。0.02 μmol/L ATRA作用于NB4细胞及TβRII-shRNA NB4细胞96 h后,2组细胞的核仁消失,细胞核分叶,出现分化征象,但是TβRII-shRNA NB4细胞的分化程度低于同样浓度ATRA处理的NB4细胞,见图4。
4 TβRII-shRNA 阻止ATO诱导NB4细胞凋亡
RT-qPCR检测显示,NB4细胞经ATO处理后TβRIImRNA的水平上调, 但TβRII-shRNA 干扰ATO引起NB4细胞TβRIImRNA的表达水平上调(P<0.01),见图5。
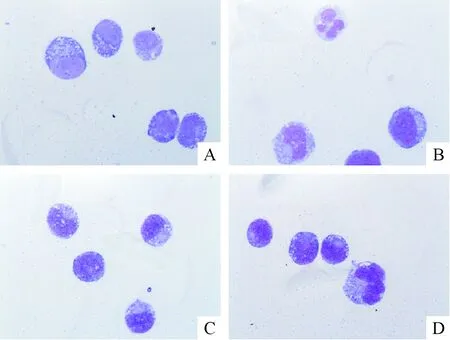
Figure 4.The morphological changes of TβRII-shRNA NB4 cells and NB4 parental cells treated with ATRA for 96 h were observed under optical microscope (Wright-Giemsa staining, ×1 000). A and C: NB4 and TβRII-sh-RNA NB4 control; B and D: NB4 and TβRII-shRNA NB4 cells treated with 0.02 μmol/L ATRA for 96 h.
图4瑞氏-吉姆萨染色法检测ATRA对TβRII-shRNANB4细胞分化的影响
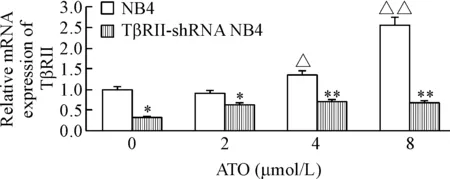
Figure 5.The relative expression of TβRII mRNA in NB4 cells and TβRII-shRNA NB4 cells induced by ATO was detected by RT-qPCR. Mean±SD.n=3.△P<0.05,△△P<0.01vs0 μmol/L;*P<0.05,**P<0.01vsNB4 group.
图5TβRII在ATO诱导的NB4和TβRII-shRNANB4细胞中的mRNA表达水平
双荧光标记流式细胞术检测细胞凋亡,发现2 μmol/L的ATO处理24 h可诱导NB4细胞及TβRII-shRNA NB4细胞发生凋亡,并且随着ATO浓度的增加,凋亡率也随之增高,但是TβRII-shRNA NB4细胞的凋亡率明显低于NB4细胞(P<0.01),见图6。
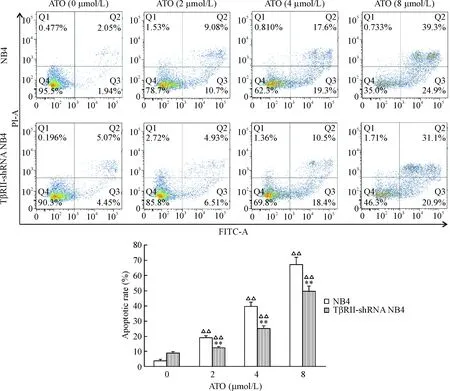
Figure 6.The apoptosis of TβRII-shRNA NB4 cells and NB4 parental cells treated with ATO for 24 h was detected by flow cytometry with Annexin V-FITC/PI double staining. Mean±SD.n=3.**P<0.01vsNB4 group;△△P<0.01vs0 μmol/L.
图6AnnexinV-FITC/PI双染流式细胞术检测TβRII-shRNA是否抑制ATO诱导的NB4细胞凋亡
AO/EB染色法在荧光显微镜下观察发现细胞核呈现不同颜色及形态,其中可见绿色核染色质及橘红色核染色质,分别呈现为结构正常的活细胞和死亡细胞(非凋亡);同时还可以见到圆柱状及固缩状的绿色核染色质和橘红色核染色质,分别代表早期凋亡细胞和晚期凋亡细胞或凋亡小体。计数结果显示NB4细胞组及TβRII-shRNA NB4细胞组凋亡率分别是(61.50±2.29)%和(45.00±2.78)%(P<0.01),见图7。
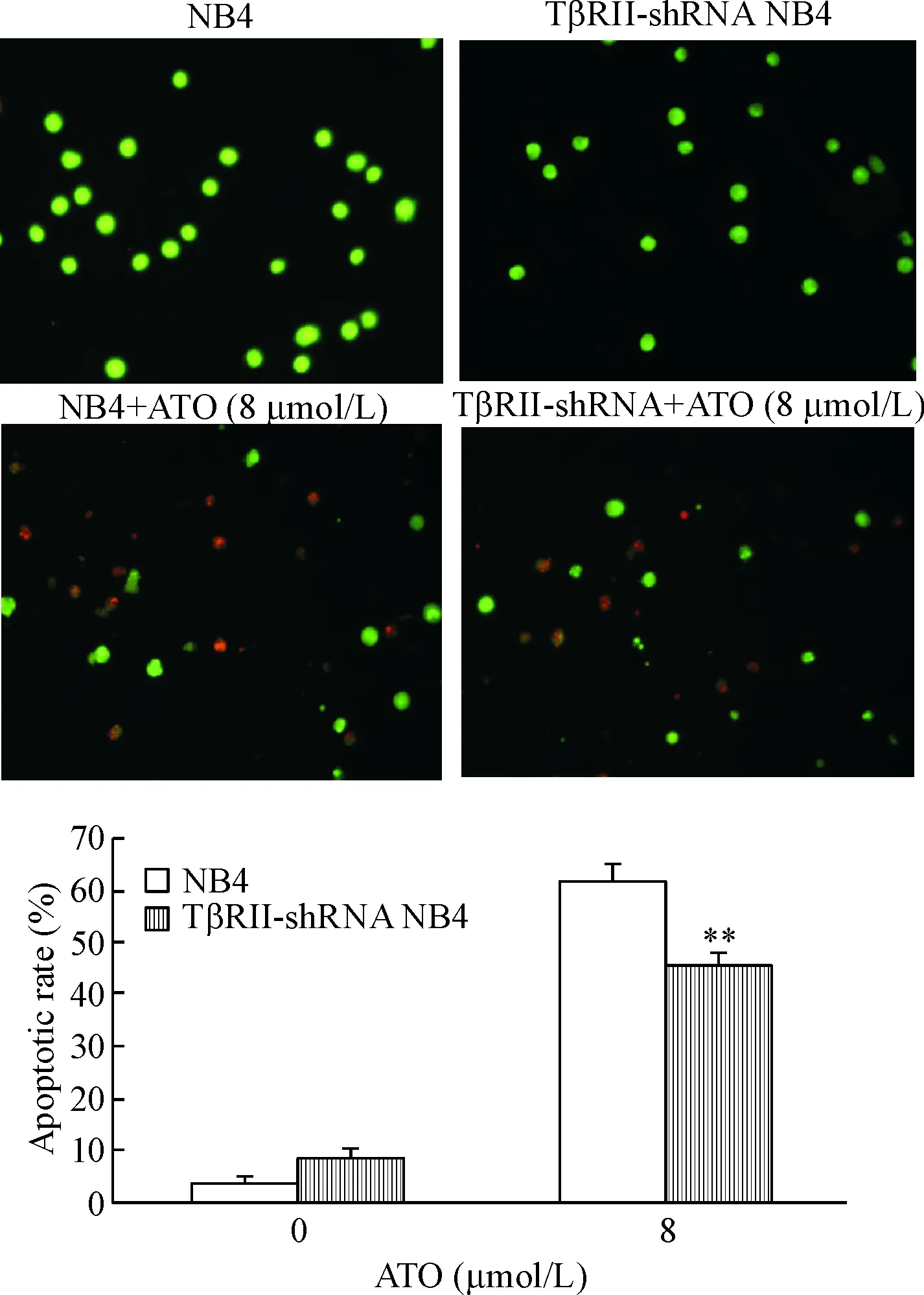
Figure 7.The apoptosis of TβRII-shRNA NB4 cells and NB4 parental cells treated with 8 μmol/L ATO was detected by AO/EB staining. Mean±SD.n=3.**P<0.01vsNB4 group.
图7AO/EB染色法检测TβRII-shRNA是否抑制ATO诱导的NB4细胞凋亡
讨 论
在正常造血中,TGF-β的作用主要表现为抑制细胞生长,诱导细胞分化和凋亡。异常造血中,相应抑制成分的非正常表达及其诱导的转录激活的异常,相应靶基因破坏及缺失、通路组分突变均会破坏TGF-β/Smads信号通路,使造血细胞出现分化、凋亡受阻及过度增殖。某些白血病的发生就与该通路密切相关,如PML-RARα和AML1/ETO可以明显阻断该通路的信号转导,促使该通路组成部分发生失活突变[7-10]。TGF-β结合TβRII是该信号通路的起点,TβR Ⅱ及其下游的Smad 信号分子突变或缺失在造血系统肿瘤的发生中起着重要的作用。已有研究发现,急性髓性白血病细胞中的Smad4基因显性负性突变,包括MH1位点的错义突变和MH2位点的移码突变,都可以中断该信号通路,使信号转导受阻[11]。Imman等[12]指出EB病毒相关的B细胞淋巴瘤及伯基特淋巴瘤相应细胞系中TβRII表达减少,能够抵抗TGF-β的生长抑制作用。Rooke等[13]检测了慢性粒细胞白血病患者不同时期TβRII水平,发现TβRII的表达在任何疾病期均明显低于正常人。本课题组前期研究也发现急性白血病细胞株HL60和K562细胞TβRII表达缺失,而NB4细胞表达内源性TβRII[14],但TβRII对NB4细胞生物学行为的影响不甚清楚,本实验以NB4细胞为研究对象,采用RNAi技术,下调NB4细胞内源性TβRII水平,进一步研究TβRII在细胞增殖中的作用,发现TβRII-shRNA NB4细胞的活力高于NB4细胞,可见TβRII介导的TGF-β信号通路在NB4细胞生长中发挥负调控作用。
NB4细胞是APL细胞株,其TGF-β/Smads 信号转导的破坏情况比较特殊。PML-RARα既在细胞质也在细胞核内存在[10]。研究表明PML-RARα抑制TGF-β信号转导的途径有2种:(1)通过直接阻断cPML与Smad 2/3的相互作用,来抑制TGF-β信号转导;(2)通过阻止nPML与Smad 3/4激活TGF-β目的基因的相互协作[4]。在APL细胞中PML-RARα呈过表达,TGF-β诱导的细胞分化因此受阻,而ATRA治疗后PML-RARα表达降低,细胞重新对TGF-β敏感,因此,PML-RARα的过表达可导致细胞对TGF-β信号的抵抗,阻断TGF-β信号转导通路。Zhong等[15]发现ATRA诱导NB4细胞分化的过程中,TGF-β1、TβRI、TβRII、Smad2、Smad3、Smad4和Smad7的mRNA表达有较显著的恢复,提示ATRA介导NB4细胞分化与激活TGF-β1信号传导途径有关。本研究发现TβRII-shRNA NB4细胞的分化程度低于NB4细胞,进一步证实TβRII介导的TGF-β信号通路在NB4细胞分化过程中发挥调控作用。
Chowdhury等[16]研究证实,组蛋白脱乙酰酶抑制剂可以促进TβRII表达,激活TGF-β1相关的信号转导通路,阻断细胞周期,进而诱导凋亡。但是TβRII在ATO诱导的NB4细胞凋亡中的作用不甚清楚。本研究发现,经ATO作用后,NB4细胞TβRII mRNA表达上调,但是TβRII-shRNA NB4细胞TβRII mRNA表达下调, TβRII-shRNA NB4细胞和亲代NB4细胞均出现凋亡,但TβRII-shRNA NB4细胞的凋亡水平显著低于NB4细胞,可见含有TβRII基因的NB4细胞对ATO促进凋亡的作用更加敏感。
综上所述,本研究表明下调TβRII可以促进NB4细胞生长,部分拮抗ATRA诱导的细胞分化及ATO诱导的细胞凋亡。

