新型蝶式股动脉穿刺压迫装置在618例经股动脉行介入治疗患者中的应用效果
王颖 王兵 崔文军 安乾 司江涛 吴斐 李阳
随着新型影像设备、新器械及新技术的不断发展,腔内介入治疗已成为血管外科诸多疾病的首选治疗方案。股动脉由于管径较粗,位置表浅,背侧有股骨头支撑便于压迫止血,较少变异,且周围无重要器官、组织,因此是血管腔内介入治疗最常用的穿刺部位。据美国心血管及介入放射学协会统计,超过85%的血管穿刺为股动脉穿刺,股动脉穿刺后最常见的并发症是穿刺部位的血肿形成,发生率为2.1%~8.9%[1-2]。影响这一并发症的原因较多,除了与患者的年龄、基础疾病、凝血功能、动脉硬化程度及穿刺的准确性等有关外,介入治疗术后穿刺口的压迫也至关重要,不当的压迫会增加血肿形成的几率。目前临床上有诸多的股动脉穿刺压迫、缝合、封堵等装置,传统的徒手按压联合绷带“8”字包扎,虽然效果确切,但费时费力,且术后患者多有皮肤过敏、破溃等并发症[3-4];缝合器因局部缝合穿刺动脉,存在靶血管狭窄或闭塞的风险,且影响再次穿刺操作;封堵器则存在栓塞装置进入血管内,导致动脉栓塞的风险[5-6]。我科自2015年1月起使用一种新型蝶式股动脉压迫装置进行介入治疗术后穿刺口的压迫,截至2017年6月,共完成在618例患者中的临床应用,取得较好临床效果,报告如下。
资料与方法
一、一般资料
选取2015年1月至2017年6月我院血管外科经股动脉穿刺介入治疗的患者618例,其中男406例,女 212例,平均年龄(60.9±8.2)岁,合并糖尿病326例,合并高血压533例,合并冠心病254例。其中206例使用5F动脉鞘管,342例使用6F动脉鞘管,56例使用8F动脉鞘管,14例使用10F动脉鞘管。562例为单侧股动脉穿刺,56例为双侧股动脉穿刺。术中均标准肝素化,术后均未行鱼精蛋白中和。5F、6F、10F动脉鞘管术后均即刻拔除,56例8F动脉鞘管中44例术后即刻拔除,12例术后12~24 h拔除,拔除后均使用新型蝶式股动脉压迫装置加压固定。
二、新型蝶式股动脉压迫装置组成
此装置包括腹带和2个压板,第一压板设有4个凸起,第二压板设有4个凹槽,第一压板下设有一个半圆来压迫出血点。第一压板压迫出血点用固定带固定,用第二压板压住第一压板使用压迫带加压固定。腹带采用一次性腹带,在腹带两侧臀上部及两侧腰部各加两条粘扣,在臀部后左右大腿根处各加两条带。两条带上都设有粘扣,其中一条采用弹力材料制成,为压迫止血带,另一条则为固定带用来同时完成两侧股动脉穿刺后的压迫止血。股动脉压迫止血器采用叠加式压板,以适合不同肥胖程度的患者,股动脉压迫止血器底座采用椭圆形,中心点采用半圆球状,以便找准血管出血点,使出血点达到最大的压力,底座与第一压板之间用圆柱连接,第一压板为双锤头形,中间底部设有4个凸起来增加压板与压迫带之间的摩擦力从而达到稳定固定点的作用,双锤头上方各设有2个圆柱凸起。第二压板基本与第一压板相似,不同之处为在第二压板锤头下方各设2个凹槽用来连接第一压板,模型图见图1。
三、新型蝶式股动脉压迫装置使用方法
在患者手术前,先将腹带平铺在手术床上,患者平躺在腹带上,患者臀部位于腹带中心位置。介入手术完成后,先将两腿部固定带固定,然后固定腹部固定带。固定好后,取出压迫装置,找准压迫点按压,将第一根固定带穿过第一压板加压固定后,将固定带固定于臀部后方的粘扣处,然后快速拔出动脉鞘管,将第二压板扣在第一压板上,然后将压迫止血带穿过第二压板,加压固定于臀部后方的粘扣处。压迫15~20 min后,将压迫装置取下。用医用纱布叠加压在出血点处,然后将固定带加压与纱布块之上,固定与臀部后方的粘扣处。将压迫带重叠压迫与固定带上加压固定于臀部后方的粘扣处(图2),双侧股动脉穿刺,两侧压迫相同(图3)。
四、术后护理及观察
术后所有患者均需卧床,穿刺侧肢体制动4~6h后可翻身,避免患肢屈髋。每隔2 h由护士观察穿刺点有无出血及血肿形成,并密切观察下肢有无肿胀及末梢血运情况。如发现出血及时通知医生,予以按压30 min后再次使用该压迫装置压迫止血,24~48 h后行床旁彩超检查,排除假性动脉瘤或动静脉瘘后去除绷带,继续卧床观察4~6 d,如血肿无变化,患者可下床,但3~5 d内避免剧烈活动;如确诊为假性动脉瘤,则依据情况予以继续压迫,局部注射凝血酶或者手术治疗等处理。
结 果
5F/6F动脉鞘管拔除后平均制动时间(12.0±4.6)h,8F/10F动脉鞘管拔除后平均制动时间(22.1±8.4)h。所有患者均未出现急性下肢动静脉血栓事件,无心脑血管意外及死亡事件。618例中有效613例,有效率99.2%。术后共出现5例血肿病例,1例(8F)为术后由手术室送回病房途中发生出血,予以压迫30 min后再次使用该压迫装置压迫止血,48 h后去除绷带,行床旁彩超检查,诊断为假性动脉瘤,瘘口较大,予以手术缝合;2例为返回病房后2~8 h内发生,均压迫30 min后再次使用该压迫装置压迫止血,48 h后行彩超检查,1例(5F)假性动脉瘤闭合,另1例(6F)出血口缩小,彩超引导下于瘤体内注射凝血酶1支,再次压迫20 min后,复查彩超瘤体内完全血栓化;另外2例(6F)在去除绷带后出现血肿,压迫30 min后再次使用该压迫止血带,压迫48 h后去除绷带,未见假性动脉瘤及活动性出血,7~10 d后血肿逐渐吸收。
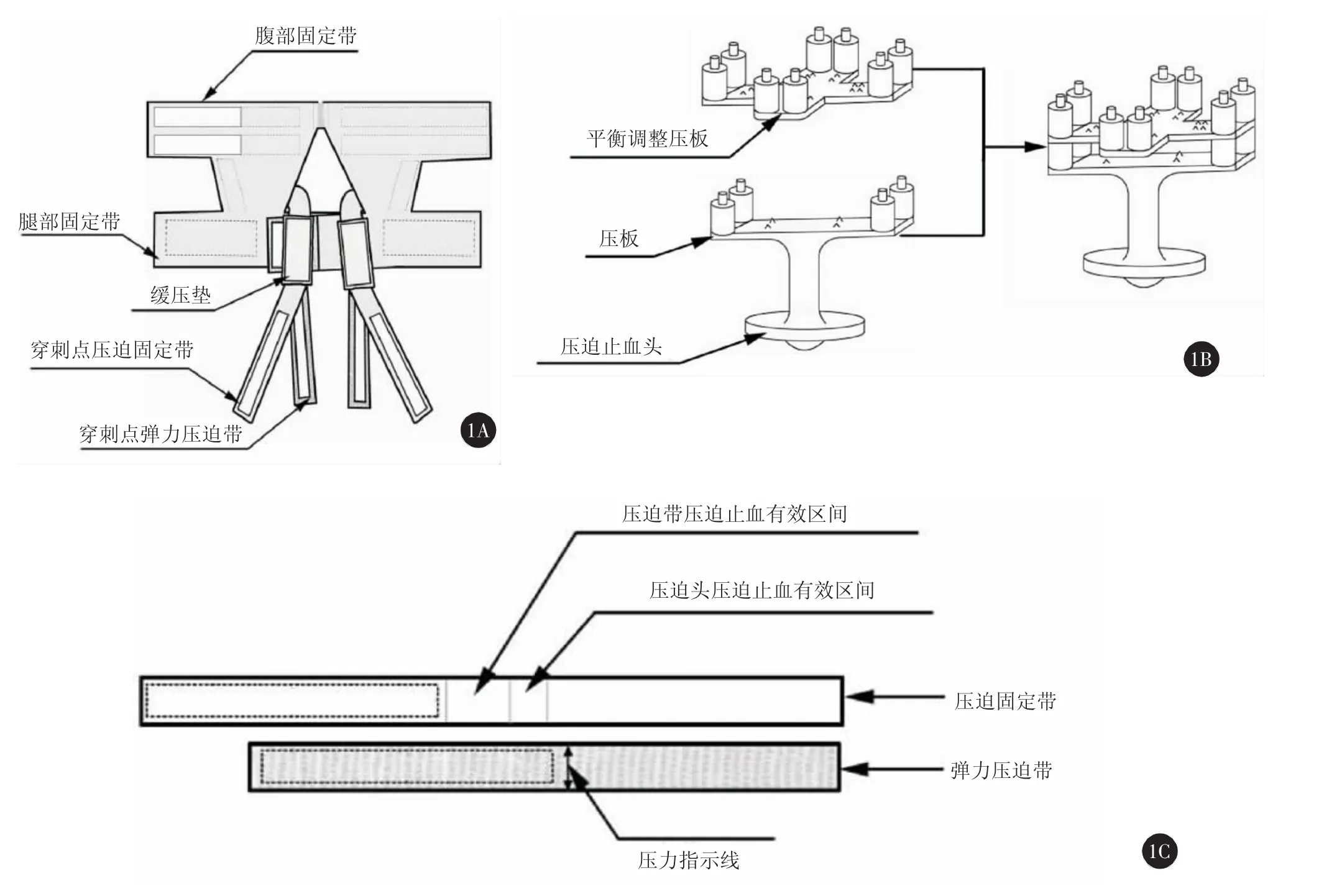
图1 新型蝶式股动脉压迫装置模型图

图2 单侧股动脉穿刺压迫带固定方法(2A为前方、2B为后方)
讨 论
股动脉穿刺是常用的血管介入穿刺部位,穿刺点常选择在腹股沟韧带中点下方的2~3 cm处,顺行穿刺可行同侧下肢介入治疗,逆行穿刺可进行除同侧下肢外其他脏器、组织的介入治疗,如颈动脉、锁骨下动脉、肾动脉、髂动脉及对侧下肢动脉等。但股动脉穿刺后不良反应也逐渐增多,包括穿刺部位的血肿、动脉夹层、假性动脉瘤、动静脉瘘及下肢深静脉血栓形成、腹膜后血肿等,延长了患者的住院时间,增加了患者的治疗费用。因介入操作术中及术后均需使用抗凝或抗血小板聚集药物,如导致腹膜后血肿等活动性出血,往往难以控制,或被迫使用止血药物,必将影响手术效果,如导致支架内血栓形成,严重时可导致死亡。

图3 双侧股动脉穿刺压迫带固定方法(3A为前方、3B为后方)
在上述所有并发症中最为常见的是穿刺部位血肿形成,影响股动脉穿刺术后血肿形成的因素较多。有研究报道,患者术前基础疾病与该并发症发生率有关,若患者具备高龄、动脉粥样硬化、应用抗栓药物等情况,其发生风险较高[7]。本研究患者均为高龄,其中586例(94.8%)术中全身肝素化,且术后继续低分子肝素抗凝或联合阿司匹林进行抗血小板聚集治疗,增加了术后血肿的风险。Hoffer等[8]认为肝素类药物的使用显著增加了穿刺部位血肿形成的发生率。本研究中5例出现血肿,其中4例在围手术期使用肝素及低分子肝素,因此考虑血肿形成与患者高龄及使用抗栓药物有关。
本研究中分别使用5F、6F、8F及10F动脉鞘管,其中5F、6F动脉鞘组中共有56例同时穿刺双侧股总动脉,李红霞等[7]研究认为,股动脉穿刺鞘的管径大小与穿刺部位的血肿发生率相关,管径越粗,其血肿发生率越高,本研究中5例出现血肿的患者,使用5F鞘1例,6F鞘3例,8F鞘1例,与李的研究并不完全相符,考虑原因为该新型压迫装置在我科室内为国内首次使用,具体性能及操作早期尚不完全熟悉,故早期应用多在5F、6F鞘组中,因存在学习曲线问题,故在上述两组中出现血肿症状较多,但总体发生率低于1%(0.81%),学习曲线为5~10例,之后我们逐渐应用于8F、10F动脉鞘穿刺口的压迫,60例患者中仅有1例出现血肿,不良事件发生率为1.6%。该压迫装置应用于5F、6F穿刺鞘,止血效果明显优于传统“8”字绷带压迫法[3],但8F及以上的穿刺鞘使用该装置的临床例数较少,尚需进一步扩大样本量,明确其有效性及安全性。
目前临床上使用的血管缝合器,单把仅适用于8F动脉鞘以下直径,大于8F鞘的穿刺口需使用至少两把缝合器缝合,大大增加了成本,且存在缝合处动脉狭窄、闭塞的风险,且缝合处会影响二次穿刺等[5],而血管封堵器仅适用于7F鞘穿刺口,使用范围较局限,且存在栓塞装置脱入动脉,导致动脉栓塞的风险[6]。另外,不论是缝合器或者闭合器均不适用于穿刺部位存在重度钙化的病况。该种新型蝶式股动脉穿刺压迫装置可单人操作,度过学习曲线后操作简便,减轻医生长时间压迫体力消耗,大大降低血肿等并发症发生率,且无异物植入,避免了动脉狭窄及栓塞风险,对靶血管管腔直径及局部钙化情况无特殊要求。本研究中618例患者,未出现一例穿刺部位狭窄及栓塞病例。如局部无血肿形成,可短期内再次穿刺相同部位,尤其适用于需同一部位反复穿刺介入放化疗的肿瘤患者。
当然,该装置为新型压迫装置,使用过程中存在一定的学习曲线,建议早期可应用于6F以下穿刺鞘管,熟练后可安全应用于8~10F穿刺鞘,大于10F穿刺鞘组无临床应用经验,不予以推荐。

