羟基红花黄素A对脑卒中相关性肺炎大鼠肺组织的保护作用及机制
王涛,刘宏祥,齐姣,史小盼,王珍,刘一,闫丽静
(河北大学附属医院,河北保定071000)
脑卒中作为常见的心脑血管疾病,不仅能够引起脑组织损伤,还会导致远隔重要脏器损伤,其中尤以合并肺部感染最为常见。据报道,脑卒中后肺炎的发生率高达20%,是与脑卒中死亡有关的重要危险因素,严重威胁患者生命健康[1]。脑卒中可引起炎症反应失调,导致肺组织内炎性细胞募集,使肺组织内炎症介质过度分泌,最终引起肺组织损伤。因此,改善脑卒中后诱发肺部炎症的关键在于控制肺组织炎症反应。然而,目前尚缺乏具有明确疗效的靶向药物。羟基红花黄色素A(HSYA)具有较强的抗炎作用[2,3],然而,其对脑卒中相关性肺炎(SAP)的作用尚不清楚。2016年8月~2017年5月,本研究采用HSYA对SAP大鼠进行治疗,探究其对大鼠肺组织损伤的改善作用,并初步探讨其作用机制,以期为该病的治疗提供新思路。
1 材料与方法
1.1 动物、试剂及仪器 50只SPF级健康成年雄性SD大鼠购自北京生命科学研究所,体质量280~320 g,8~10周龄,合格证号:YXK(京)2015-0002。HSYA纯品购自成都康邦生物科技有限公司,纯度为89.5%。Janus激酶(JAK2)特异性抑制剂N-苄基-3,4-二羟基亚苄基氰基乙酰胺(AG490)购自美国Sigma-Aldrich公司;正常山羊血清、封闭液购自美国Gibco公司;p-JAK2、磷酸化的信号传导与转录激活因子3(p-STAT3)、核转录因子κB(NF-κB) p65抗体购自美国Sigma-Aldrich公司;肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-18酶联免疫吸附(ELISA)试剂盒、核提取试剂盒、蛋白提取试剂盒购自美国Rche公司。低温调整离心机购自德国Eppendorf公司;电子天平购自德国Sartorius公司;倒置显微镜、荧光显微镜及成像系统购自日本Olympus公司。
1.2 SAP模型制备 将SD大鼠随机选取10只作为假手术组,其余大鼠制备SAP模型。根据参考文献[4],采用四动脉阻断法制备急性全脑缺血再灌注致脑-肺综合征大鼠模型。用戊巴比妥钠麻醉大鼠,将其仰卧固定于固定板上,沿腹正中线切1 cm切口,暴露颈总动脉并分离。用棉线环颈总动脉成1 cm线环后,缝合切口。将大鼠转移至立体定位仪,俯卧固定,于枕骨下沿背正中切1 cm切口,暴露第1颈椎横突翼小孔后,将注射器针头捣入小孔,旋转针体至有鲜血溢出,即说明椎动脉损毁,维持2~3 min后,止血。椎动脉永久阻断后缝合切口。假手术组仅暴露第1颈椎和颈总动脉,不阻断血管。术后即刻腹腔注射青霉素8万U,1次/d,持续3 d。模型废弃标准:大鼠四肢上举,翻正反射、痛觉反应消失,瞳孔散大,眼球灰白色,在灌注期内意识未恢复;在缺血期死亡或昏睡,在整个实验过程中出现抽搐。造模48 h内观察大鼠进食减少、饮水增多、毛色灰暗、背部弓起、耳缘静脉突起加粗,并伴有眼球变浊暗淡等症状,同时肺部听诊可闻及杂音,且呼吸急促,则判定为造模成功。将大鼠仰卧固定,重新打开颈部切口,以动脉夹夹闭双侧颈总动脉阻断30 min后松开动脉夹,再灌注3 h。
1.3 HSYA治疗方法及标本采集 将造模成功的SAP模型大鼠随机分为4组各10只:SAP组、AG490组、低剂量HSYA组(L-HSYA组)和高剂量HSYA组(H-HSYA组)。根据参考文献[5,6]对大鼠进行药物治疗。AG490组经尾静脉注射AG490 5 mg/kg,L-HSYA组和H-HSYA组分别经尾静脉注射低剂量(8 kg/mg)、高剂量(16 kg/mg)HSYA,假手术组、SAP组经尾静脉注射等剂量生理盐水,均1次/d,连续给药7 d。末次给药后6 h,各组经腹腔注射过量戊巴比妥钠麻醉,迅速于左肺进行支气管肺泡灌洗;切除右肺上叶组织,将其洗涤后固定于4%多聚甲醛中,进行组织病理学检查;取右肺中叶以测算肺组织湿/干重量比(W/D);切除右肺下叶组织,于-80 ℃冻存备检。
1.4 肺组织病理学观察 将切除的右肺上叶组织固定于4%多聚甲醛中24 h,石蜡包埋,制备5 μm厚切片。脱蜡后,将连续切片用HE染色后,于显微镜下进行组织病理学检查,以400倍视野收集图像。根据参考文献[7],采用半定量评分系统评估肺组织病理学严重程度,包括肺泡充血、出血,白细胞浸润,肺间质水肿,肺泡壁厚度等,每项评分0~4分,共20分。分值越高表示肺组织病理变化越严重。
1.5 肺组织W/D值测算 将切除的右肺中叶进行测量,记录W值;之后将右肺中叶置于110 ℃烤箱烘干,24 h后测量,记录D值。
1.6 肺组织中髓过氧化物酶(MPO)活性检测 右肺下叶组织解冻后用50 mmol/L Tris-HCL 1 mL匀浆,与钠缓冲液混匀后离心。收集沉淀重悬于磷酸钾缓冲液中,根据说明书,采用MPO检测试剂盒检测MPO活性。在37 ℃反应体系中1 g肺组织分解1 μmol过氧化氢记作1个活力单位(U/g)。
1.7 支气管肺泡灌洗液(BALF)中炎性细胞因子检测 大鼠麻醉后,以血管夹夹闭右肺门后,于左肺用冷PCS进行支气管肺泡灌洗,共灌洗5次,收集BALF,于4 ℃ 3 000 r/min离心15 min,收集上清液。采用TNF-α、IL-1β、IL-18 ELISA试剂盒,根据说明书检测BALF中各炎性细胞因子水平。
1.8 肺组织核提取物中NF-κB结合活性检测 采用核提取试剂盒,根据说明书从肺组织中提取核蛋白。使用TransAM NF-κB试剂盒测量 p65 DNA结合活性。
1.9 肺组织核提取物中NF-κB p65蛋白表达检测 采用Western blotting法。使用RIPA裂解缓冲液,根据说明书从肺组织中提取总蛋白。使用BCA蛋白测定试剂盒测定蛋白质浓度。用SDS-PAGE分离等量蛋白质,并转移至聚偏二氟乙烯膜上。4 ℃下将膜与p-JAK2(1∶1 000)、p-STAT3(1∶1 000)、NF-κB p65(1∶500)的一抗和β-actin(1∶5 000)孵育过夜。洗涤后与辣根过氧化物酶缀合的二抗一起温育。使用化学发光试剂显影后,用Quantity One软件分析蛋白相对表达量。
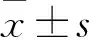
2 结果
2.1 各组肺组织病理变化比较 SAP组可观察到微小肺血管和肺泡隔膜毛细血管的扩张,肺胞腔变窄、肺泡壁增厚,部分肺泡受损,肺泡隔变宽,肺胞及肺间质组织中可见明显的白细胞浸润,并伴有充血、出血和肺间质水肿。与SAP组比较,AG490组、L-HSYA组及H-HSYA组肺组织病理变化均改善。假手术组、SAP组、AG490组、L-HSYA组及H-HSYA组肺损伤评分分别为(2.62±0.76)、(15.33±2.26)、(4.34±1.15)、(9.68±2.13)、(5.01±1.36)分。与假手术组比较,SAP组肺损伤评分高(P<0.05);与SAP组比较,AG490组、L-HSYA组及H-HSYA组肺损伤评分低(P均<0.05);与AG490组、H-HSYA组比较,L-HSYA组肺损伤评分高(P均<0.05);AG490组与H-HSYA组肺损伤评分比较差异无统计学意义(P>0.05)。
2.2 各组大鼠W/D值比较 假手术组、SAP组、AG490组、L-HSYA组及H-HSYA组W/D值分别为4.13±1.10、8.92±1.87、5.65±0.98、7.08±1.24、6.10±1.17。与假手术组比较,SAP组肺组织W/D值高(P<0.05);与SAP组比较,AG490组、L-HSYA组和H-HSYA组肺组织W/D值低(P均<0.05);与AG490组、H-HSYA组比较,L-HSYA组肺组织W/D值高(P均<0.05);AG490组与H-HSYA组肺组织W/D值比较差异无统计学意义(P>0.05)。
2.3 各组MPO活性、炎症因子水平比较 见表1。
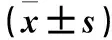
表1 大鼠BALF中炎症因子水平比较
注:与假手术组比较,*P<0.05;与SAP组比较,#P<0.05;与AG490组比较,&P<0.05;与L-HSYA组比较,△P<0.05。
2.4 各组肺组织核提取物中NF-κB活性比较 见表2。
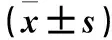
表2 各组肺组织核提取物中NF-κB活性比较
注:与假手术组比较,*P<0.05;与SAP组比较,#P<0.05;与AG490组比较,&P<0.05;与L-HSYA组比较,△P<0.05。
2.5 各组肺组织中p-JAK2、p-STAT3蛋白表达比较 见表3。
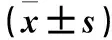
表3 各组肺组织中p-JAK2、p-STAT3蛋白表达比较
注:与假手术组比较,*P<0.05;与SAP组比较,#P<0.05;与AG490组比较,&P<0.05;与L-HSYA组比较,△P<0.05。
3 讨论
HSYA是从传统中药红花中提取的黄色色素的主要活性化学成分,属于一种新型的查耳酮糖苷。HSYA具有显著的心脑血管保护作用,且与其抗氧化损伤和抗炎作用有关[8,9]。本研究发现,HSYA治疗能够改善SAP大鼠肺组织病理学损伤和肺水肿,提示HSYA能够减轻SAP大鼠肺组织炎症反应。然而,HSYA对肺组织炎症性损伤改善的作用机制尚不清楚。
本研究采用改良四动脉阻断法制备全脑缺血再灌注致脑-肺综合征模型,发现全脑缺血再灌注损伤大鼠肺组织表现出明显的病理学改变,包括白细胞浸润、肺间质水肿、肺泡充血、肺泡腔变窄、肺泡壁增厚等;大鼠肺W/D值升高,说明发生严重肺水肿。该模型大鼠出现严重肺组织炎症损伤和明确的肺组织病理改变。因此,改善脑卒中后诱发的肺损伤关键在于控制肺组织炎症反应。
肺泡巨噬细胞是肺组织中最丰富的先天性免疫细胞,通过产生过量的TNF-α、IL-1β、IL-18等促炎性细胞因子,引起炎症反应[10]。动物研究发现,IL-18和IL-1β中合抗体的应用能够减轻急性肺损伤动物模型中的肺损伤[11]。另外,研究发现,IL-1β、TNF-α等细胞因子表达上调能够进一步促进嗜中性粒细胞的浸润至损伤肺组织中,加重肺组织炎症反应,形成恶性循环[12]。中性粒细胞浸润是与肺炎症性损伤有关的关键因素[13]。MPO是中性粒细胞浸润的标志物。研究证实,中性粒细胞的消除能够显著降低动物模型中的肺损伤严重程度[14]。本研究发现,大鼠肺BALF中TNF-α、IL-1β和IL-18水平升高,且肺组织MPO活性增加,进一步证实SAP大鼠肺组织炎性损伤。研究表明,HSYA能够抑制缺氧诱导的TNF-α等炎性细胞因子的表达,从而发挥抗炎作用[15]。本研究发现,经HSYA治疗后,肺BALF中炎症细胞因子水平均显著降低,且MPO活性降低,提示HSYA可能通过减少肺组织中炎症细胞因子分泌,抑制肺组织中性粒细胞浸润,从而减轻肺组织炎症反应,缓解肺组织损伤。
NF-κB是能特异性结合免疫球蛋白κ轻链基因10 bp碱基序列,并促进κ基因表达的核蛋白。NF-κB是促炎性转录因子,在炎症反应过程中引发炎症级联反应。细胞内外多种刺激信号能够激活NF-κB,使活化的NF-κB从细胞质中快速转移至细胞核中,与诱导型基因启动序列中的特定κB位点结合,进而诱导编码炎性细胞因子、趋化因子、黏附分子等基因的表达,从而引起细胞和组织损伤,参与多种疾病的病理生理过程。研究表明,NF-κB的高表达能够通过诱导炎性细胞因子TNF-α的表达而参与炎症性肺损伤的发生[16]。本研究发现,SAP组肺组织中NF-κB活性增加,且NF-κB蛋白表达水平升高,提示NF-κB的活化与SAP大鼠肺组织炎症损伤有关。研究发现,HSYA能够通过抑制NF-κB活化减轻炎症反应[17]。本研究发现,HSYA能明显降低NF-κB活性及蛋白表达水平。提示,HSYA可能通过抑制NF-κB活化,抑制炎性细胞因子表达,从而改善肺组织损伤。
JAK/STAT信号通路是一种具有干扰素样作用的细胞内信号途径。JAK家族包括四个激酶成员,JAK1、JAK2、JAK3和Tyk2。AG490是特异的JAK酪氨酸磷酸化抑制剂,能够有效阻断下游信号转导,并抑制STAT的激活[18]。STAT是JAK的下游底物,是细胞质中的一种转录因子,能够与靶基因调节区的特定DNA序列结合。JAK/STAT信号通路能够通过介导细胞内TNF-α、IL-1β、IL-18等多种细胞因子信号转导,细胞因子直接负责将刺激信号转移至细胞核,并促进基因转录,从而参与调节多种病理生理过程(免疫应答、细胞增殖分化、细胞凋亡、炎症和癌症等)。已有研究证实,JAK/STAT信号通路激活在肺组织损伤中发挥重要作用[19]。本研究发现,SAP大鼠肺组织中p-JAK2、p-STAT3蛋白表达升高,提示JAK2/STAT3信号通路的激活参与肺炎症性损伤。而HSYA能够抑制JAK2/STAT3信号通路活化。过往研究证实,JAK/STAT信号通路激活能够促进NF-κB活化,从而诱导或增强炎症反应[5]。本研究发现,JAK2/STAT3特异性抑制剂AG490能够抑制NF-κB活化和p65的核易位,与过往研究一致。经HSYA治疗后,SAP大鼠肺组织NF-κB的活化被抑制,与AG490作用效果一致。结合过往研究推测,HSYA通过抑制JAK2/STAT3信号通路激活,进一步抑制NF-κB活化,参与调控肺组织炎症反应。
肺组织中JAK/STAT信号通路能够被多种因素激活,包括炎症、缺血、缺氧等。研究发现,炎症因子通过使STAT3磷酸化,扩大炎症反应,进一步促进炎性细胞释放促炎细胞因子,加重肺损伤[20]。徐志红等[21]发现,SAP大鼠肺组织内p-JAK2、p-STAT3表达上调与IL-1β、TNF-α水平上调一致,证实JAK2/STAT3信号通路的激活能够促进炎性细胞因子释放,从而进一步加重肺损伤。结合过往研究推测,HSYA能够抑制肺组织中JAK2/STAT3信号通路激活,减少炎症细胞因子分泌,同时抑制NF-κB活化及核易位,从而进一步抑制炎症细胞因子相关基因的表达,最终抑制肺组织中炎性细胞浸润,缓解肺组织损伤。
综上所述,HSYA对SAP大鼠的炎症性肺损伤具有改善作用,这可能与其抑制肺组织中JAK2/STAT3信号通路激活有关。然而,本研究中HSYA仅能部分缓解肺组织损伤及炎症反应,而非完全逆转SAP大鼠的肺损伤,这可能与药物剂量有关,也有可能是由于SAP中的肺组织损伤不仅与炎症有关,还与其他因素有关。后续研究还需深入探讨,以期为疾病治疗提供更充分的依据。

