转染CXCR4的MSCs对放射性肺损伤组织中细胞因子的影响
张春阳,祝 艳,冯华松
目前针对放射性肺损伤(RILI),仍缺少有效的治疗手段。研究发现,间充质干细胞(MSCs)具有减轻放射性肺损伤、肺纤维化的作用[1],且目前已开展临床试验研究探索[2],但具体的作用机制仍不完全清楚。研究发现,通过提高MSCs上CXCR4基因的表达后,可增强其向受损伤组织部位的归巢,提升治疗效果[3]。前期研究中[4],笔者已证实通过慢病毒转染,使来源于脐带的MSCs过表达CXCR4基因后,MSCs的趋化、迁移能力提高。目前国内尚无关于病毒转染CXCR4的MSCs对RILI中细胞因子影响的报道。本研究通过观察慢病毒转染CXCR4的MSCs对参与放射性肺损伤的10 kDa干扰素γ诱导蛋白(IP-10)、转化生长因子 β1(TGF-β1)、血小板源生长因子 (PDGF)、肿瘤坏死因子 -α(TNF-α)和基质金属蛋白酶(MMPs)-2的影响,探讨转染CXCR4的MSCs治疗RILI可能的机制,为MSCs在临床中的应用提供新的理论基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源与准备 新生儿脐带来源于医院妇产科,经医院伦理委员会批准,与产妇及家属签署知情同意书后,无菌条件下留取剖宫产的足月健康新生儿脐带,经组织块法贴壁培养[5],实验采用第3代细胞。MSCs已进行多向分化和免疫表型鉴定[5]。通过慢病毒转染第3代MSCs,治疗组细胞采用携带 CXCR4和 EGFP的慢病毒载体(LV-CXCR4-EGFP),对照组细胞采用仅携带EGFP的慢病毒载体(LV-EGFP)进行转染,具体方法见参考文献[4]。
1.1.2 主要试剂及设备 CXCR4基因设定来源于人类,GENE ID为 7852,Genebank编号为 NM_001008540。CXCR4慢病毒载体,由上海吉凯基因化学技术有限公司协助构建,载体为GV287,分子量为 10.4 kb,元件顺序为:Ubi-MCS-3FLAG-SV40-EGFP,克隆位点为AgeI/AgeI。C57雌性小鼠,购自军事医学科学院,动物合格证号:SCXK-(军)2012-0004。DMEM/F12培养基、青霉素、链霉素(Hyclone公司,美国),胰蛋白酶(Trypsin)(Invitrogen 公司,美国),胎牛血清(FBS)(Gibco 公司,美国),羟脯胺酸(HYP)、丙二醛(MDA)ELISA试剂盒(华美生物有限公司),PDGF、TGF-β1 ELISA 试剂盒(Abcam 公司,美国),TNF-α ELISA试剂盒(Abcam公司,美国)。荧光倒置显微 镜 (Olympus 公司,CKX-41,日本),酶标仪(Thermo 公司,美国)。
1.2 实验方法
1.2.1 构建放射性肺损伤小鼠模型 将24只雌性出生后2个月左右的C57小鼠,随机分为4组:正常组、照射组、对照组和治疗组,每组各6只。照射组、对照组和治疗组小鼠腹腔注射5%水合氯醛(每只0.006 ml/g)麻醉后,呈俯卧位固定鼠板上。调整直线加速器照射野,设定照射参数(13 Gy,6 MV,3.68 Gy/min),窗宽 20 cm×2.5 cm,源距 1 m,给予全肺一次性X线照射。照射之后,将小鼠放置动物房继续饲养。
1.2.2 各组干预措施 对照组和治疗组于放射线照射后第1 d,分别自小鼠尾静脉注射LV-EGFP和LV-CXCR4-EGFP转染后的MSCs,每只细胞数量5×105/0.2 ml。正常组和照射组,分别经尾静脉注射约0.2 ml的0.9%生理盐水。
1.3 荧光显微镜观察 放射线照射后的第7 d,处死小鼠后留取肺组织检测。取小鼠右肺下叶肺组织标本,进行冰冻切片,厚度5 μm;用含DAPI的甘油封片剂封片,荧光倒置显微镜下观察EGFP标记的MSCs在肺组织的分布情况。
1.4 病理组织学观察 左肺下叶标本进行石蜡包埋、切片,厚5 μm,行HE染色,光镜下观察病理组织学的变化。
1.5 ELISA检测 取小鼠右肺上叶标本,组织匀浆后,采用相应的ELISA试剂盒检测HYP、MDA、IP-10、TGF-β1、PDGF、TNF-α 和 MMP-2 的含量。
1.6 统计学方法 应用SPSS16.0统计软件分析数据,实验数据以±s表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 MSCs在肺组织中分布 荧光显微镜观察发现,对照组和治疗组肺组织内有绿色荧光表达的细胞,且治疗组表达绿色荧光的细胞数量多于对照组;而照射组肺组织内未见明显的绿色荧光表达(图1)。

图1 荧光显微镜检测小鼠肺组织内EGFP标记的MSCs分布
2.2 病理组织学观察 HE染色可见,正常组肺组织肺泡壁完整,肺间质无增厚,无明显的炎性细胞渗出、浸润,结构组织清晰(图2a);照射组肺组织可见肺泡间隔增厚,伴有大量炎性细胞浸润,部分肺泡腔逐渐变小,部分萎陷,肺泡正常结构破坏(图2b);治疗组和对照组肺组织内,亦可见局部肺泡间隔增厚,炎性细胞浸润,但肺泡间隔增厚程度明显较照射组减轻,肺泡组织结构破坏也较照射组明显减轻(图 2c、d)。

图2 小鼠肺组织病理组织学HE染色
2.3 ELISA检测结果 与正常组比较,照射组肺组 织 内 HYP、MDA、IP-10、TGF-β1、PDGF、TNF-α 和MMP-2表达明显升高(P<0.01),而治疗组和对照组较照射组明显下降(P<0.01)。与对照组比较,除TNF外,治疗组其他指标下降的更加明显(P<0.01)。见表1。
3 讨论
本研究发现,治疗组肺组织内EGFP标记的MSCs数量比对照组增多,提示转染CXCR4后MSCs归巢能力提高,与前期体外研究的结果相符合[4]。同时,组织病理学结果和反映组织氧化应激损伤的MDA和纤维化程度的HYP含量检测发现,转染CXCR4的MSCs较对照组MSCs,更明显地减轻放射线导致的氧化应激反应,并减少HYP的升高,提示其具有更好的减轻RILI作用。
RILI发生、发展过程中,涉及多种细胞因子和靶细胞相互作用,有促进和修复作用的细胞因子是影响 RILI发展趋势的主要因素[6]。IP-10、TGF-β1、PDGF、TNF-α和MMPs被认为具有参与损伤、介导炎症反应、促进纤维化形成的作用[6]。IP-10是属于CXC趋化因子家族的促炎细胞因子,在免疫系统不同的细胞系中起到诱导趋化性作用[7],被认为参与介导RILI免疫反应[6]。TGF-β1是致纤维化细胞因子,被认为是放射性肺损伤重要的标志物之一[8],给予输注MSCs后,可降低RILI小鼠体内TGF-β1的水平[9]。PDGF具有趋化炎症细胞、成纤维细胞的作用,使肺内成纤维细胞分裂和增殖增加,促进纤维化的形成[10]。TNF-α是促炎性反应的细胞因子[10],在RILI的发生和维持过程中具有重要作用。MSCs通过拮抗TNF-α阻断纤维化信号通路[11]。研究发现[12],肺纤维化早期阶段,MMPs的水平升高,降解细胞外基质的作用增强,从而损伤肺组织。本研究发现,上述细胞因子在放射线照射后小鼠肺组织内表达均明显升高,与文献报道相一致。而在给予MSCs后,其表达水平均显著下降,其中转染CXCR4的MSCs相对于对照组,其抑制作用更加明显,提示转染CXCR4的MSCs具有更好的抑制放射线照射致细胞因子异常表达作用,从而减轻RILI。这有可能与提升MSCs趋化归巢能力后,使进入局部损伤组织的MSCs增多有关,但不能排除局部由于过表达CXCR4后,影响了RILI组织内其他的信号通路机制导致有关,还需要进一步研究明确。
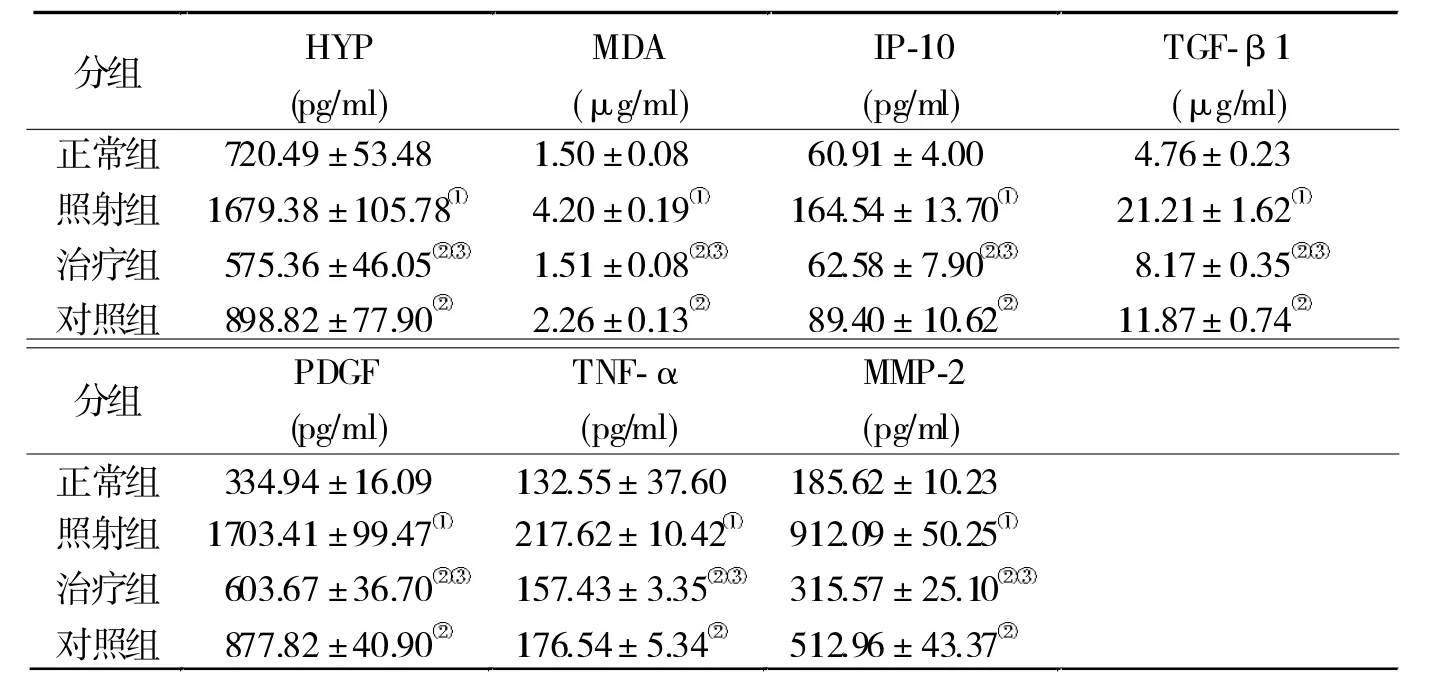
表1 各组ELISA检测结果比较(n=6)
综上所述,通过输注转染CXCR4的MSCs可更好地减轻RILI,更有效地抑制参与RILI细胞因子的异常升高,为今后利用基因修饰的MSCs治疗RILI提供有力的理论依据。

