miR-298调控Notch1对骨肉瘤细胞增殖和侵袭的影响
谢天楚,李旭军,李 涛
骨肉瘤是儿童和青年人最常见的原发性恶性骨肿瘤,根据其组织学特征,通常将骨肉瘤分为成骨细胞、成软骨细胞和成纤维细胞骨肉瘤[1]。骨肉瘤具有高度侵袭、转移性。目前以甲氨蝶呤、多柔比星、顺铂为基础的新辅助化疗结合手术治疗是治疗骨肉瘤的主要方式,但其复发及转移率仍较高,5年生存率<50%[2],并且骨肉瘤的发病机制到目前为止并不清楚,因此迫切需要阐明骨肉瘤的发病机制,找到更佳的治疗方法。微小RNA(miRNAs)是一类参与基因转录后水平调控的非编码RNA,一般长度为20~24 nt,通过上调或下调多种重要靶基因的表达,在胚胎发育和肿瘤形成等过程中发挥重要作用[3],如miR-298可抑制乳腺癌、胃癌、胰腺癌细胞的增殖、转移,通过特定的靶基因促进癌细胞的凋亡[4-6]。研究表明骨肉瘤的发生与miRNA在细胞内表达失调相关,多种miRNA的表达异常对骨肉瘤细胞的恶性生物学行为产生重要影响[7-8],但目前miR-298在骨肉瘤的发生、发展中的作用尚不清楚。Notch信号通路在细胞增殖、分化中起重要作用,其调控异常通常会导致癌症的发生、发展[9]。在Notch信号调节通路中,miR-124可下调Notch1表达抑制胃癌细胞的增殖与凋亡[10],也有研究表明通过下调Notch1的表达可抑制骨肉瘤细胞的分化、增殖和凋亡等,抑制骨肉瘤的发生、发展[11],而miR-298与Notch1在骨肉瘤中的相互作用报道较少。因此本研究通过测定miR-298在骨肉瘤细胞株中的表达水平,进一步研究miR-298对骨肉瘤细胞株生物学行为的影响,并对其可能的机制进行探讨,为阐明骨肉瘤的发病机制提供新的理论基础。
1 材料与方法
1.1细胞株和主要试剂 人骨肉瘤细胞株143B、MG63、U2OS、正常人正常成骨细胞株hFOB1.19均购自于中国科学院上海细胞研究所,HEK293人胚胎肾细胞系购自美国ATCC公司。RPMI 1640细胞培养基、胎牛血清及青霉素-链霉素(Invitrogen公司,美国),全蛋白提取试剂盒、BCA蛋白浓度检测试剂盒、高灵敏ECL化学放光试剂盒(上海碧云天生物技术有限公司),Lipo-2000转染试剂盒(Invitrogen,美国),Transwell小室(Chemicon公司,日本),Matrigel基质胶(美国B&D公司),兔抗人一抗Notch1(Santa cruz,美国)、兔抗人一抗GAPDH(Santa cruz,美国)以及山羊抗兔二抗IgG(Santa cruz,美国);其他试剂均由上海国药试剂分析纯配制。
1.2细胞培养基转染 人源性miR-298拟物序列设计参考miRBase数据库。将143B、MG63、U2OS、hFOB1.19在补充有10%胎牛血清的RPMI-1640培养基中培养,条件:温度37℃,5% CO2。每2天更换1次培养基。转染24 h前,将细胞以70%~80%的密度接种于生长培养基中。根据培养手册,使用Lipofectamine RNAiMax将miR-298 mimics转染至143B细胞,获得稳定转染细胞作为miR-298过表达组,将Control mimics转染至143B细胞中作为miR-298对照组。同时将Notch1 siRNA及Control siRNA分别转染至143B细胞作为Notch1 siRNA组和Notch1对照组。
1.3定量聚合酶链反应(PCR) 将细胞收集后加入含有500 μl的lysis buffer的EP管中裂解,Trozel裂解液抽提组织总RNA,逆转录,PCR扩增目的基因,使用U6作为内参。根据按照Takara公司实时定量PCR试剂盒说明书进行PCR反应。获得数据以RQ=2-ΔΔCT计算mRNA表达量。实验重复3次。本研究中使用的引物如下:miR-298上游引物:5′-ACACTCAGCTGGGAGCAGAAGCAGGGAG-3′,下游引物:5′- GGTGTCGTGGAGTCG-3′;U6内参上游引物:5′-TCCGATCGTGAAGCGTTC-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;Notch1上游引物:5′-ATGAGTTCCAGTGCGAGTGC,下游引物:5′-TAAGTGTTGGGTCCGTCCAG-3′;GAPDH上游引物:5′-GGCGGCACCACCATGTACCCT-3′,下游引物:5′-AGGGGCCGGACTCGTCATACT-3′。
1.4双荧光素酶活性测定 将miR-298 mimics转染到143B细胞中。分组如下:miR-298 mimics+Notch1 3′UTR Wt、miR-298 NC+Notch1 3′UTR Wt、miR-298 mimics+Notch1 3′UTR Mut、miR-298 NC+Notch1 3′UTR Mut。根据siPORTneoFX的使用方法,在转染后48 h制备裂解物。然后根据制造商提供的说明书,使用双荧光素酶测定系统进行荧光素酶分析。实验重复3次。
1.5蛋白免疫印迹试验 提取对数转染后的生长期的143B细胞,提取蛋白后,用BCA蛋白质测定试剂盒定量测定细胞蛋白浓度。通过SDS-PAGE分离后,将蛋白转移至PVDF膜中,5%脱脂乳封闭30 min,Notch1一抗(1∶1000)4℃孵育过夜后,用含有TBST溶液洗膜3次,每次10 min,在室温下孵育二抗(1∶5000),封闭1 h。使用ECL显影液检测目标蛋白的表达水平,GAPDH作蛋白内参对照。实验重复3次。
1.6甲基噻唑基四唑(MTT)增殖实验 将转染后处于对数期的143B细胞使用胰蛋白酶消化后,制成单细胞悬浮液并以1×103细胞/孔的密度接种到96孔板中。在细胞培养7 d后,加入20 μl MTT测定液,每孔充分混合均匀,并在37℃下孵育4~6 h。然后使用无菌吸管吸出上清液,每孔加入150 μl二甲基亚砜,在室温下搅拌10 min保证晶体充分溶解。然后在48 h进行MTT测定波长为490 nm时的吸光度,计算骨肉瘤细胞的增殖情况。实验重复3次。
1.7划痕迁移实验 将转染后的143B细胞接种于含10%胎牛血清的RPMI 1640培养基的6孔板中,用1 ml枪头垂直于孔板制造细胞划痕,吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片;加入无血清培养基,培养24 h后,用倒置显微镜拍摄细胞迁移的图像。通过愈合情况,分析各组细胞的迁移能力变化。实验重复3次。
1.8细胞侵袭能力检测 将基质胶在4℃条件下过夜融化,并与3倍体积的无血清培养基混合均匀后加入24孔transwell小室(每孔50 μl)。复温30 min后,将250 ml 10%FBS、DMEM加入下室中,并且将总数为1×105个转染后的143B细胞种植在上室中,并在培养箱中再培养24 h。利用棉签轻微地清洁膜上表面的细胞,穿透聚碳酸酯膜的细胞用甲醇固定并用0.1%结晶紫染色。随机选择5个视野,在倒置显微镜下计数迁移到下侧的细胞数。实验重复3次。
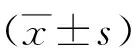
2 结果
2.1不同细胞株中Notch1及Notch1表达水平 miR-298在不同的骨肉瘤细胞中均呈现低表达状态。143B、MG63、U2OS细胞株中miR-298表达水平低于hFOB1.19,且143B细胞株低于MG63、U2OS细胞株(P<0.05)。143B细胞株中miR-298的表达水平相对最低,因此后续实验选取骨肉瘤细胞株143B作为研究对象。Notch1在不同的骨肉瘤细胞株中均呈现高表达状态。143B、MG63、U2OS细胞株中miR-298表达水平高于hFOB1.19,且143B细胞株高于MG63、U2OS细胞株(P<0.05)。见表1。
2.2miR-298和Notch1在骨肉瘤143B细胞株细胞株中的调控关系 与miR-298对照组相比,miR-298过表达组野生型载体Notch1 3'-UTR Wt转染的143B细胞中,Notch1的荧光素酶活性显著降低(P<0.05);2组野生突变型载体Notch1 3'-UTR Wt转染的143B细胞中Notch1荧光素酶活性比较差异无统计学意义(P>0.05)。见表2。通过蛋白免疫印迹实验我们可以发现,过表达miR-298后,Notch1蛋白表达含量降低。见图1。
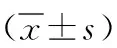
表1 不同细胞株miR-298及Notch1表达水平
注:hFOB1.19为正常成骨细胞株,143B、MG63、U2OS为骨肉瘤细胞株;与hFOB1.19细胞株比较,aP<0.05;与143B细胞株比较,cP<0.05
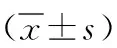
表2 miR-298过表达对骨肉瘤143B细胞株Notch1 3'-UTR基因Notch1表达的影响
注:与miR-298对照组比较,aP<0.05

图12组骨肉瘤143B细胞株中Notch1表达情况
2.3过表达miR-298对骨肉瘤143B细胞株增殖、迁移、侵袭的影响 过表达miR-298后,骨肉瘤细胞增殖数目、侵袭细胞数及划痕实验伤口愈合率均低于miR-298对照组(P<0.05,P<0.01)。见表3。
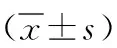
表3 过表达miR-298对骨肉瘤143B细胞株增殖、迁移、侵袭的影响
注:与miR-298对照组比较,aP<0.05,bP<0.01
2.4抑制Notch1表达对骨肉瘤143B细胞株增殖、迁移、侵袭的影响 抑制Notch1表达后,骨肉瘤细胞增殖数目和侵袭细胞数均较Notch1对照组减少,划痕实验伤口愈合率低于Notch1对照组(P<0.05,P<0.01)。见表4。
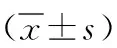
表4 抑制Notch1表达对骨肉瘤143B细胞株增殖、迁移、侵袭的影响
注:与Notch1对照组比较,aP<0.05,bP<0.01
3 讨论
骨肉瘤是起源于间叶组织的恶性肿瘤,占原发恶性骨肿瘤的20%,是最常见于青少年的一种原发恶性骨肿瘤[12-15],70%~80%的患者发病年龄为10~25岁,每年发病率为(1~3)/100万[16]。研究表明骨肉瘤的发生与先天性染色体异常、p53及Rb抑癌基因失活、生长因子的表达异常有关[17],但目前其发病机制仍不清楚。近年来越来越多的研究表明,miRNA在恶性肿瘤的发生、发展过程中发挥着重要作用。成熟的miRNA经典的作用机制是通过其5'到3'端的2~8位碱基序列与靶基因mRNA 3'UTR结合,形成RNA诱导或沉默复合体,从而抑制靶基因的翻译或使靶基因mRNA降解活化转录因子家族,发挥其对恶性肿瘤细胞生物学行为的调控作用[18]。Liu等[19]研究发现,miR-214可通过促进PENT基因的表达,从而抑制骨肉瘤的增殖及转移Pu等[20]研究表明,miR-34a-5p在耐药骨肉瘤细胞中可同时对CD117基因及MEF2通路进行调控,从而影响DNA的生成,抑制骨肉瘤细胞的增殖,促进凋亡,增强其对化疗药物的敏感性。但目前尚未找到影响骨肉瘤发生、发展并起决定性作用的miRNA,因此,寻找骨肉瘤中特异性表达的miRNA及其具体调控通路,在转录水平进行外源干预性调控,可能是治疗骨肉瘤的新突破口。
miR-298位于人染色体20q13.32上。近年有研究发现,miR-298在多种恶性肿瘤中均呈低表达状态,并且与恶性肿瘤的侵袭转移、预后密切相关[5]。有研究发现,过表达miR-298可以下调EZH2的表达,抑制上皮性卵巢癌细胞株的增殖、侵袭、转移[21],同时在多柔比星耐药乳腺癌细胞中,过表达miR-298可以下调P-gp蛋白的表达,增加多柔比星在细胞核中的积聚,增强细胞毒性[22],但miR-298在骨肉瘤的发生、发展中作用目前未见报道。本研究结果显示,miR-298在不同的骨肉瘤细胞中均呈现低表达状态,进一步使用miR-298过表达后,骨肉瘤143B细胞的增殖、侵袭、转移受到明显抑制,可见miR-298在骨肉瘤细胞中扮演着抑癌基因的角色。
Notch信号通路是由4个跨膜缺口蛋白组成的高度保守的信号传导途径,参与细胞周期、细胞凋亡及增殖的调控[23]。Notch信号通路主要由Notch配体和靶基因组成,当Notch受体受配体刺激后,可发生蛋白裂解并进入核内的Notch胞内域(NICD)与转录因子CBF1/Suppressor of Hairless/LAG-1/RBP-Jk结合,启动转录调节靶基因的表达[24]。Notch1是Notch受体蛋白中重要的多功能跨膜受体蛋白,已证实notch1调控多种恶性肿瘤的生物学行为,激活Notch1信号通路可通过调节COX-2促进胃癌细胞的侵袭和集落形成能力[25],相反,将重组有Notch1基因片段的质粒转染至甲状腺癌DRO和FTC236细胞中,其增殖明显受抑制[26],但miR-298能否通过调控Notch1信号通路影响骨肉瘤细胞的生物学行为尚不清楚。本实验研究中,我们发现,Notch1在不同的骨肉瘤细胞中均呈现高表达状态,进一步抑制Notch1的表达,骨肉瘤143B细胞的增殖、侵袭、转移能力减弱,并且通过TargetScan数据库对miR-298进行检索,预测其靶基因,发现miR-298和Notch1间有部分相同的结合序列,推测Notch1可能是miR-298的靶基因,荧光光素酶基因报告显示miR-298 mimics与野生型载体Notch1 3'-UTR Wt共转染后,Notch1的荧光素酶活性显著降低,蛋白免疫印迹实验表明过表达miR-298后,Notch1蛋白表达水平降低,提示Notch1是miR-298的靶基因,miR-298可靶向负向调控Notch1表达水平,抑制骨肉瘤细胞的增殖、侵袭及转移。但其上游及下游是否存在特异性的调控通路,以后的研究将会进一步探讨。
综上所述,miR-298可靶向下调Notch1基因的表达,抑制骨肉瘤细胞的增殖、侵袭及转移,可为骨肉瘤的诊断和治疗开辟新的治疗靶点。

