牛传染性鼻气管炎可视化LAMP检测方法的建立和应用
董世娟,冯蒙,于瑞嵩,谢春芳,陈冰清,李震
上海市农业科学院畜牧兽医研究所 上海市农业遗传育种重点实验室,上海 201106
牛传染性鼻气管炎(IBR)是由牛传染性鼻气管炎病毒(IBRV),又名牛疱疹病毒Ⅰ型(BHV-1),引起的以高热、呼吸困难和上呼吸道炎症为主的接触性传染病[1],在世界范围内流行,被世界卫生组织定为 B类传染病。IBRV可侵袭多种组织和器官,引起严重的呼吸道疾病和生殖道疾病,导致动物产奶量降低、全身性感染及流产等,是奶牛场的一个主要的病原,给奶牛场造成了巨大的经济损失[2-3]。牛感染IBRV(包括减毒疫苗株)[4]后,易发生潜伏感染而长期带毒,由此造成群体感染,使得病原清除和防控都极其困难。目前只有欧洲启动了IBR的根除计划[5],一些国家已经成功根除该病[6-7]。我国部分地区牛场的IBRV抗体阳性率为28%–93%[8],说明IBRV在我国牛群中已普遍存在。准确、快速、特异地检测出 IBRV是有效诊断和预防IBR的关键。目前,普遍应用PCR、ELISA、免疫组化、病毒分离及中和试验等方法检测IBRV[9-11],这些方法存在操作繁杂、敏感性不高、费时费力、需要专业仪器等缺陷,使得这些方法均很难在基层牛场应用,因此迫切需要建立一种敏感、特异和简便的IBRV检测方法。
环介导等温扩增(LAMP) 方法,是由Notomi等[12]于 2000年开发的一种新的核酸等温扩增方法,在等温条件下,可快速、高效、灵敏地扩增目的基因序列。由于其灵敏度高、特异性强、不需要复杂的仪器和专业人员,更适合在基层部门和现场应用。近年来,该方法已广泛应用于病原微生物检测、医疗卫生、食品安全检测等方面。为了能有效快速地检测 IBRV,本研究拟以 IBRV的gB基因为靶基因,选择高度保守区域设计3对特异性引物,建立检测IBRV的LAMP方法,为IBR的早期诊断及防控提供技术支撑。
1 材料与方法
1.1 毒株与样品
IBRV毒株由华中农业大学农业微生物国家重点实验室郭爱珍教授惠赠;水泡性口炎病毒(VSV)、伪狂犬病毒(PRV)、牛病毒性腹泻(BVDV)由本实验室保存。301份鼻腔拭子和92份血清样本分别采自上海市崇明岛的两个奶牛场。
1.2 试剂与仪器
甜菜碱(Betaine)、羟基萘酚蓝(HNB) 等购自Sigma公司。Bst 2.0 DNA 聚合酶购自NEB公司。电热恒温水浴锅为上海精宏实验设备有限公司产品。凝胶成像系统为上海天能科技有限公司产品。
1.3 引物设计与合成
基于NCBI数据库中发表的IBRV的gB基因序列(GenBank Accession No.DQ006857.1),分析比对后,选择其保守区域,利用在线软件 Primer Explorer V4设计IBRV的3对特异性LAMP引物和nested-PCR引物(表1),由生工生物工程(上海) 股份有限公司合成。
1.4 病毒DNA抽提
采用AxyPrep基因组DNA小量试剂盒提取IBRV及临床样本DNA,按照试剂盒说明书进行操作。
1.5 阳性质粒的制备
以IBRV细胞培养物提取的DNA为模板,P1、P2为引物,进行PCR扩增,在25 μL反应体系中依次加入:DNA 1.0 μL;引物 P1、P2 1.0 μL(10 μmol/L);Taq聚合酶 MiX 12.5 μL;ddH2O 9.5 μL。按如下程序进行扩增:94 ℃预变性4 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃ 1 0 min 。经 1%的琼脂糖凝胶电泳后,目的片段克隆至pMD18-T载体,转入DH5α感受态细菌中,摇菌后,提取质粒并纯化,将回收的质粒经XbaⅠ和Hind Ⅲ双酶切鉴定,送博尚生物公司进行测序。经测序验证的阳性质粒作为DNA标准品,利用核酸蛋白分析仪检测质粒的浓度及纯度,进行 10倍系列稀释,用于LAMP方法的敏感性实验。
1.6 LAMP反应及反应体系的优化
1.6.1 LAMP反应
利用3对特异性引物,以IBRV细胞培养物提取的DNA为模板进行LAMP扩增,设置阴性对照(以ddH2O为模板)。25 μL反应体系中依次加入:10×Isothermal Amplification Buffer(20 mmol/L Tris-HCl,10 mmol/L(NH4)2SO4,10 mmol/L KCl,2 mmol/L MgSO4,0.1% Tritonx -100,pH 8.8) 2.5 μL,混合引物(FIP/BIP: LF/LB: F3/B3按浓度比为40 μmol/L: 10 μmol/L: 5 μmol/L 的等量混合) 6 µL,10 mmol/L dNTPs 3.5 μL,100 mmol/L MgSO42.0 μL,4.0 mol/L 甜菜碱 1.0 μL,8 000 U/mL Bst 2.0 DNA 聚合酶 1.0 μL,3 mmol/L HNB 1.0 μL 和DNA 1.0 µL模板,DEPC水补至25 µL,充分涡旋、混匀,置于65 ℃水浴锅或金属浴中保温50 min后终止反应。
1.6.2 LAMP反应体系的优化
通过改变LAMP反应体系中 dNTPs、MgSO4以及混合引物的浓度从而优化反应体系,体系配比见表2,要求LAMP体系配置完成后,反应管溶液呈紫色,反应后阳性对照呈蓝色,阴性对照颜色不变,并且琼脂糖凝胶电泳条带清晰分明。
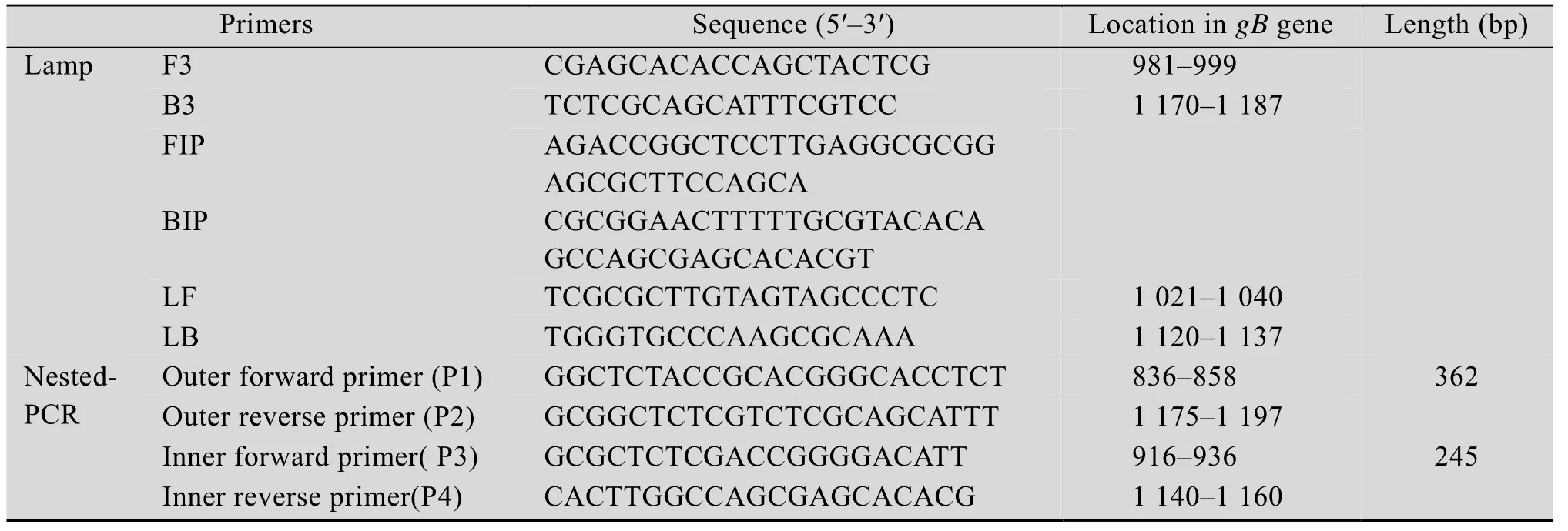
表1 LAMP引物序列表Table 1 Primers for LAMP

表2 LAMP反应体系的优化Table 2 Optimization of LAMP reaction system
1.7 结果的判定
在LAMP扩增结束后,肉眼直接观察阳性对照和阴性对照管的反应液颜色是否改变。另取扩增产物进行 2%琼脂糖凝胶电泳,80 V、55 min后,用紫外凝胶成像系统进行分析。
1.8 LAMP反应的敏感性试验
将已知拷贝数的质粒稀释至拷贝数为1×104、1×103、1×102、1×101、1×100和 1×10–1,分别作为模板,进行LAMP反应。反应结束后,通过肉眼直接判断结果。LAMP敏感性试验独立重复3次,3次结果完全一致认为可信,并与实验室建立的nested-PCR方法的敏感性进行对比。nested-PCR反应体系如下:2×TaqPlus Master Mix 12.5 μL、ddH2O 9.5 μL、IBRV上游引物和IBRV下游引物各1 μL、DNA模板 1 μL;第一轮PCR反应条件为:94 ℃ 4 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 1 0 min 。第二轮PCR反应条件为:94 ℃ 4 min ;94 ℃ 30 s,60 ℃ 30 s,72 ℃25 s,20个循环;72 ℃ 1 0 min 。
1.9 LAMP反应的特异性试验
分别用经过PCR或RT-PCR鉴定过的PRV、VSV 及BVDV作为LAMP反应的模板,IBRV细胞培养物作为阳性对照,DEPC水作为阴性对照,按照建立的体系和条件进行LAMP反应。
1.10 临床样本检测
应用建立的 IBRV-LAMP体系对采集到的上海市崇明岛奶牛场的301份奶牛鼻腔拭子和92份血清样本进行检测,通过可视化判断结果。重复试验 3次,3次结果完全一致认为可信。另外,应用nested-PCR对这些临床样本进行对比检测,运用EXCEL计数资料检验,分别配对分析LAMP和nested-PCR检测鼻拭子与血清样本中IBRV的结果。
2 结果与分析
2.1 LAMP基础反应
按照LAMP反应体系配制反应液,阴、阳对照管均呈紫色;反应后,阳性对照管呈天蓝色,阴性对照管颜色不变(图 1)。LAMP反应产物经2%琼脂糖凝胶电泳,阳性对照呈现LAMP反应特异的梯状条带,阴性对照只有小于100 bp的引物聚集物条带(图2)。
2.2 LAMP反应体系的确定
以IBRV的DNA为模板,按照表2中的优化体系进行LAMP扩增,结果显示表中2和3的配比产物在反应前颜色已变为蓝色,所以2和3的配比弃掉。其余配比扩增产物反应后颜色均变为蓝色,经琼脂糖凝胶电泳后均呈现梯形条带(图 3),但配比5的条带更清晰,选择配比5作为优化后的体系。体系中MgSO4的浓度调整为6 mmol/L,即100 mmol/L MgSO4加入的体积调整为1.5 μL,混合引物FIP/BIP: LF/LB: F3/B3按浓度比调整为40 μmol/L: 20 μmol/L: 5 μmol/L 的等量混合,其余组分不变。

图1 LAMP反应的可视化验证Fig.1 Visual identification of LAMP reaction.1:positive control; 2: negative control.

图2 LAMP反应产物凝胶电泳分析Fig.2 Gel electrophoresis analysis of LAMP products.1: negative control; 2: positive control; M: marker.

图3 LAMP反应体系的优化Fig.3 Optimization of LAMP reaction system.1,4–9: different reaction systems according to the table 2 were repeated three times.
2.3 LAMP与nested-PCR的敏感性比较
将已知拷贝数的阳性质粒,进行10倍系列稀释,拷贝数分别为 1×104、1×103、1×102、1×101、1×100、1×10–1,分别进行 LAMP、nested-PCR、PCR扩增。LAMP反应通过可视化可以检测到10 copies/μL的质粒,3次独立重复试验结果一致(图 4),凝胶电泳结果显示 nested-PCR方法可以检测到10 copies/μL的质粒(图5A),PCR检测到1×104copies/μL 的质粒(图 5B)。上述数据表明,LAMP反应与 nested-PCR反应敏感性相当,比PCR敏感1 000倍。

图4 LAMP反应敏感性Fig.4 Sensitivity of LAMP.1–6: the concentration of standard plasmid is 1×104,1×103,1×102,1×101,1×100,1×10–1 copies/μL.
2.4 LAMP反应特异性
分别以PRV、VSV及BVDV作为LAMP反应的模板,IBRV作为阳性对照,ddH2O作为阴性对照,按照建立的体系和条件进行LAMP扩增。凝胶电泳结果显示只有阳性对照出现LAMP特征性条带,其他病毒均未检测到LAMP反应特征性条带(图 6)。可视化结果显示,阳性对照管的反应液呈现天蓝色,其余病毒的反应液均呈紫色,与阴性对照一致(图7)。
2.5 LAMP方法临床应用
利用建立的 LAMP方法对来自上海市崇明岛地区两个奶牛场的301份鼻腔拭子和92份血清样本进行IBRV检测,部分阳性样品的凝胶电泳图见图8。同时应用nested-PCR进行对比检测,检测结果见表 3。两种方法的检测结果,以配对计数资料形式列出,如表4和表5所示。nested-PCR和LAMP对鼻拭子和血清样本的检测结果的符合率按以下公式计算:
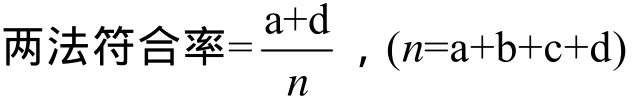
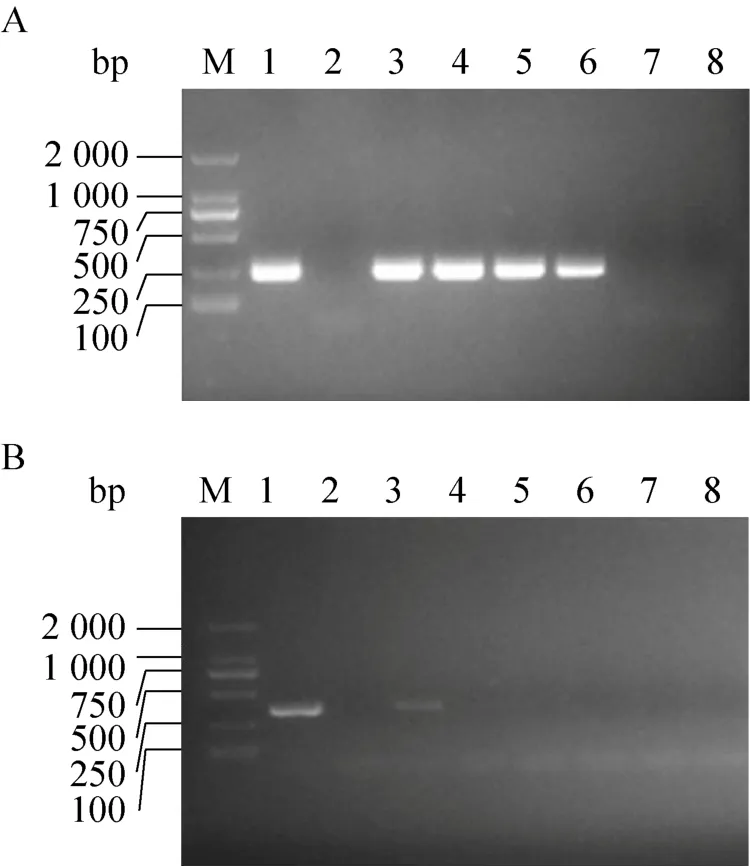
图5 Nested-PCR与PCR反应敏感性Fig.5 Sensitivity of nest-PCR and PCR.(A)Nested-PCR.(B) PCR.M: marker; 1: positive control; 2:negative control; 3–8: the concentration of standard plasmid is 1×104,1×103,1×102,1×101,1×100,1×10–1 copies/μL.
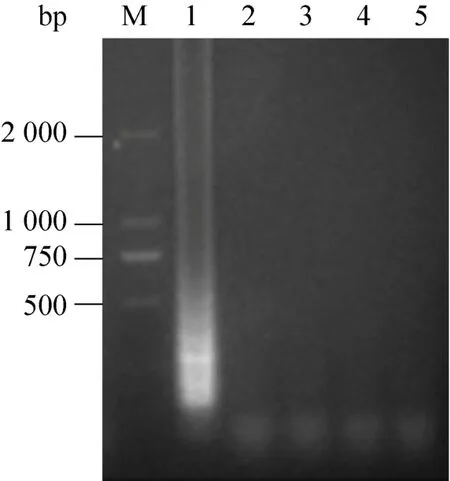
图6 LAMP反应特异性Fig.6 Specificity of LAMP.M: marker; 1: IBRV; 2:negative control; 3: PRV; 4: BVDV; 5: VSV.
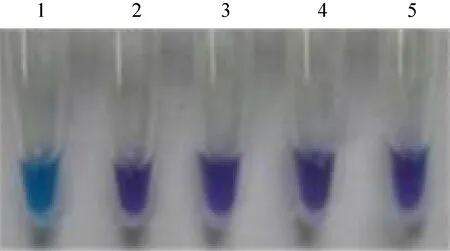
图7 LAMP反应特异性的可视化Fig.7 Visual detection of LAMP specificity.1:positive control; 2: negative control;3: PRV; 4: BVDV; 5: VSV.
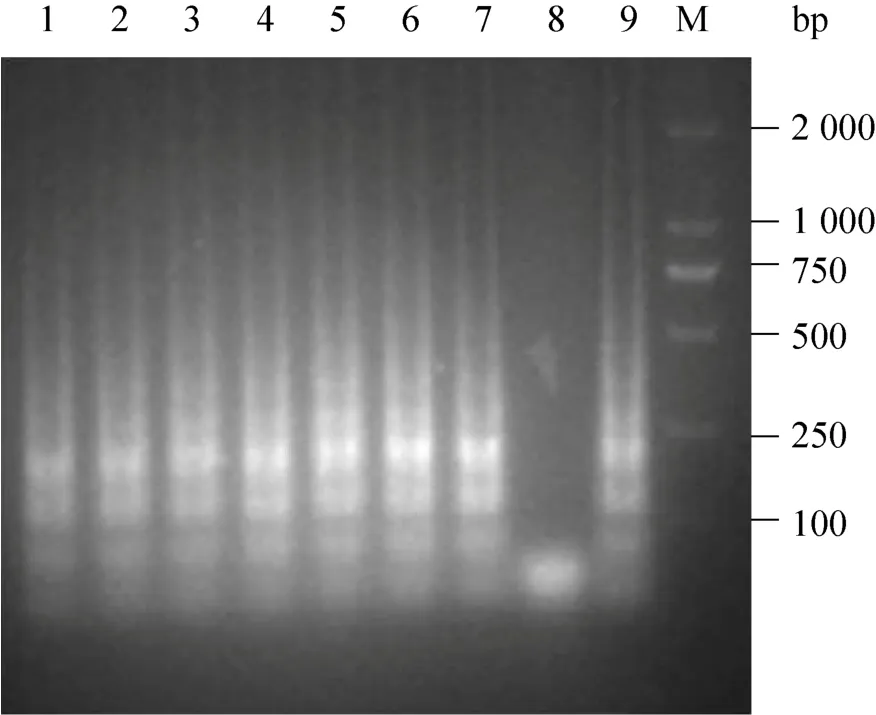
图8 部分阳性样品凝胶电泳分析Fig.8 Gel electrophoresis analysis of partial positive samples.1–7: positive samples,8: negative control,9:positive control,M: marker.
计算得到,两种方法检测鼻拭子的符合率为97.01%,符合率极高;而对血清样本检测,两种方法符合率为77.2%,低于对鼻拭子检测的符合率,两种方法检测所有样本的总符合率为92.4%。应用配对资料的卡方检验(McNemar检验) 比较nested-PCR和 LAMP对 IBRV的检出率是否存在差别,结果两种方法对鼻拭子和血清样本的检出率的P值均大于 0.05,说明这两种检测方法对于鼻拭子样本和血清样本的检出率差异不显著。
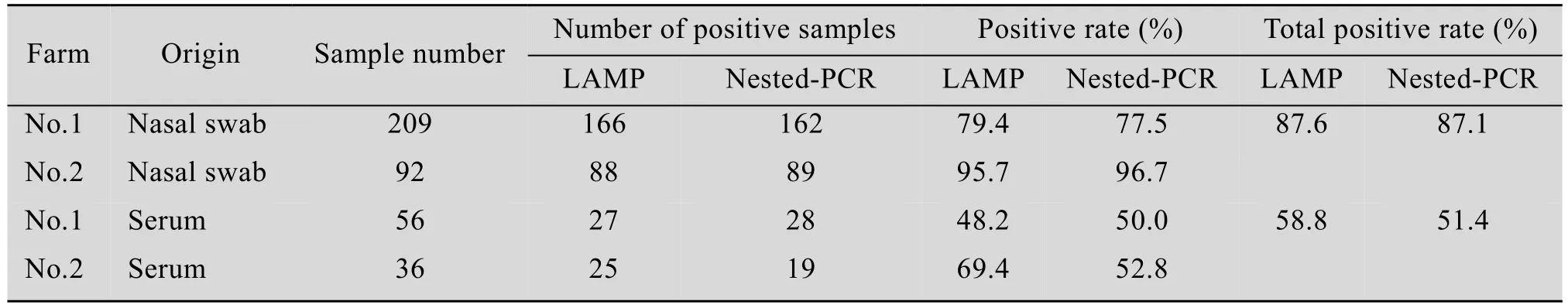
表3 应用LAMP及nested-PCR方法检测奶牛场IBRV的结果Table 3 IBRV detection results by LAMP and nested-PCR in farm

表4 LAMP、nested-PCR方法检测鼻拭子样本的结果对比Table 4 Comparison of results from nasal swabs by LAMP and nested-PCR
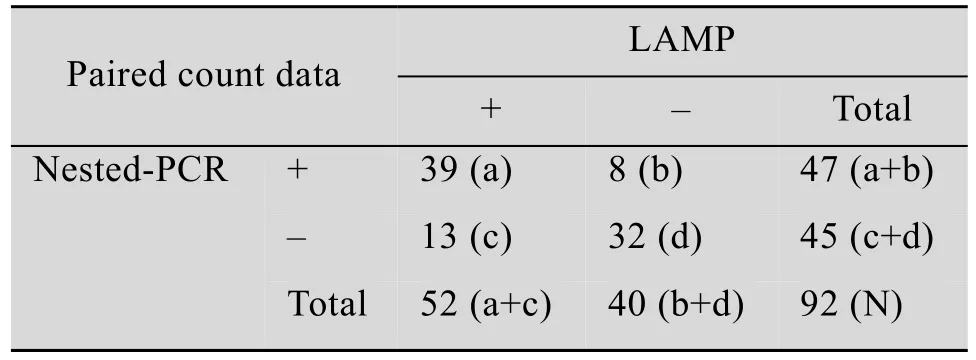
表5 LAMP、nested-PCR检测血清样本的结果对比Table 5 Comparison of results from serums by LAMP and nested-PCR
3 讨论
牛传染性鼻气管炎是牛常见的传染病之一,在全球范围内流行,具有高发病率和死亡率,每年给养牛业造成巨大的经济损失,引起越来越多的科学家和公共卫生部门的高度重视。由于IBRV感染牛后,病毒可在三叉神经节或腰荐神经节建立潜伏感染,目前还没有能完全清除该病毒的有效策略。因此,早期快速诊断在IBR防治中起着至关重要的作用。
由于基层部门和养殖场检测条件的限制,现有的检测方法如 PCR、ELISA、病毒分离及中和试验方法等很难在现场实施。LAMP检测技术是一种在恒温反应条件下进行的核酸扩增技术,在水浴锅内即可完成,反应结果可以进行可视化观察,且具有较高的灵敏性和特异性,已广泛应用在动物疫病的检测。本研究根据数据库中 IBRV gB基因的保守序列设计引物,优化反应体系,在碱土金属离子指示剂羟基萘酚蓝(HNB) 的作用下建立了IBRV的可视化LAMP检测方法。用该方法检测牛病毒性腹泻病毒、猪伪狂犬病毒、水泡性口炎病毒等病毒,均未检测到LAMP特异的梯状条带和反应液颜色的变化,表明该方法与上述病毒无交叉反应,特异性强。敏感性试验显示LAMP方法的敏感性与nested-PCR方法相当,较常规PCR提高1 000倍,可以检测到10 copies/μL,显著高于其他研究建立的 IBRV LAMP检测方法(分别为2.23×103copies/μL、1.68×104copies/μL)[13-14]的灵敏度。与Fan等[15]利用GeXP技术检测单一的IBRV基因的敏感性相当,高于检测6种牛病毒的多重GeXP-PCR方法的敏感性。本方法在反应体系中加入了HNB染料,由于反应副产物焦磷酸根离子和反应体系中的 Mg2+生成焦磷酸镁沉淀,不断消耗游离 Mg2+,反应前后的颜色显著改变,从而使IBRV 的检测可视化,也避免开盖加入染料造成产物污染。综合敏感性和特异性试验,本研究建立的LAMP方法是高度灵敏和特异的,且具有检测程序便捷、所需设备简单和肉眼能判断结果的优势,适合基层部门及牛场对IBRV的快速检测。
运用所建立的LAMP方法对来自上海市崇明岛地区两个奶牛场的301份鼻腔拭子和92份血清样本进行检测,两个奶牛场鼻腔拭子的阳性率分别为 79.4%、95.7%,血清病原阳性率分别为48.2%、69.4%,与nested-PCR的检出率相比没有显著差异,证明LAMP方法在基层养殖场可以代替nesed-PCR进行临床样本的检测。无论鼻拭子还是血清样本,1号奶牛场的阳性率均低于2号奶牛场,在现场采样过程中,发现1号奶牛场的饲养管理条件远好于2号奶牛场,说明饲养管理条件是控制IBR的一个关键环节,良好的饲养条件能明显减少IBR的流行。2号奶牛场棉拭子阳性率偏高,可能由于邻栏奶牛的采食不受限制,采集过程中会有交叉污染的现象,导致阳性率偏高。鼻腔拭子的检出率高于血清样本,分析原因是IBRV感染牛体后可通过鼻腔、泪液、流产胎儿以及阴道分泌物不定期向外界环境排毒,尤其在原发感染时,主要通过神经纤维向上呼吸道方向侵染,因此鼻腔拭子中IBRV的病毒载量高于血清,使得鼻腔拭子的检出率高于血清,证明鼻腔拭子样品更适用于IBRV的检测。鼻腔拭子样本IBRV的总阳性率为87.6%,血清样本IBRV的总阳性率为 58.8%,证明这两个奶牛场大部分牛都携带IBRV病原,IBRV防控形势严峻。
本实验室曾对这两个奶牛场采集血清样品进行IBRV抗体检测,共采集样品385份,抗体阳性率分别为41.2%和74.3%[16],和其他地区IBRV抗体阳性率在同一范围(40%–90%)[8,17]。本次检测到这两个场的棉拭子病原阳性率分别为79.4%、95.7%,均相应高于该场的抗体阳性率。这种现象可能与 IBRV侵染特性容易造成奶牛隐性感染有关,因此,还需在检测病原的同时,对全场进行血清抗体的检测,与病原检测结果进行比对,筛查潜伏感染的牛,及时进行排查和清除潜伏感染牛,提高IBRV的防控效率。

