聚赖氨酸修饰丝素蛋白膜对神经干细胞生长和分化的影响
赵晓阳,邓立志,邓宇斌,万勇,张黎明
1 中山大学附属第一医院 脊柱外科,广东 广州 510080
2 中山大学 材料科学与工程学院,广东 广州 510080
3 中山大学附属第七医院 骨科研究中心,广东 深圳 518107
神经干细胞(Neural stem cells,NSCs) 具有向神经元和胶质细胞分化的能力[1],在中枢系统损伤疾病(例如脊髓损伤、脑梗死等) 中移植NSCs可以与宿主损伤的组织整合,替代丢失的细胞,宿主神经元可以与移植神经干细胞分化的神经元形成突触连接,重建局部神经环路,在利用NSCs移植治疗大鼠脊髓损伤实验中,可观察到大鼠不同程度的运动功能恢复[2-3]。然而神经干细胞移植治疗面临一大障碍,即移植的 NSCs有限的神经元分化率与较低的存活率的问题[4]。
丝素蛋白(Silk)作为天然生物材料具有良好的生物相容性[5],其最终的降解产物是可被身体吸收的氨基酸和寡肽[6]。在许多研究中,将丝素蛋白作为生物材料支架能够促进嗅鞘细胞和干细胞生长和分化[7-9]。然而丝素蛋白大部分为惰性蛋白,细胞对其黏附能力不强,导致其作为搭载细胞的生物材料支架作用受限。
左旋聚赖氨酸(poly(l-lysine)) ,PLL) 不仅可以提供细胞的黏附位点,其本身还具有正电荷可以促进细胞的黏附、增殖和分化,已有实验表明将PLL与水凝胶相连可以促进神经细胞的黏附并提高细胞活力[10-11]。
综上所述,我们结合两种材料的优势,用聚赖氨酸修饰丝素蛋白膜,并以 NSCs作为种子细胞,观察其在聚赖氨酸修饰的丝素蛋白膜上的生长和和分化情况,寻找适合中枢神经组织工程的支架材料,为中枢神经损伤后的再生和修复提供实验基础和依据。
1 材料与方法
1.1 材料合成部分
1.1.1 原料与试剂
桑蚕茧(Bombyx morisilkworm Cocoon),购自南宁东桑西移丝绸有限公司;碳酸钠、乙酸乙酯、碳酸氢钠、无水硫酸镁、溴化钾、四氢呋喃均为分析纯,购自广州化学试剂厂;Nε-苄氧羰基-L-赖氨酸(Nε-Carbobenzoxy-L-lysine),二(三氯甲基)碳酸酯(三光气),二甲基亚砜(99.7%,Extra Dry,with molecular sieves,Water≤50 ppm),均购自萨恩化学技术(上海)有限公司;除四氢呋喃使用前经金属钠回流除水外,其余均直接使用。
1.1.2 测试方法
1H NMR测试:端基为N-Boc-苯胺的聚赖氨酸苄酯(B-Aniline-PLL) 溶于氘代三氟乙酸(CF3COOD) 和氘代氯仿(CDCl3) 混合溶剂(V(CF3COOD)∶V(CDCl3)=15∶85), 浓 度 为10 mg/mL。脱保护的带苯胺端基的聚赖氨酸(Aniline-PIL)、丝素蛋白(Silk) 和丝素蛋白-聚赖氨酸接枝物(Silk-PIL) 冻干样品溶于重水,样品浓度为10 mg/mL,利用400 M超导核磁共振谱仪Bruker AVANCE 400(Bruker Co.,Switzerland) 对样品结构进行1H NMR表征。
UV-vis测试:用紫外-可见双光束分光光度计(TU-1901,北京普析通用) 测量再生丝素蛋白水溶液与接枝聚赖氨酸丝素溶液的 UV-vis吸收光谱,扫描范围:300-600 nm。
GPC测试:利用凝胶渗透色谱仪 Waters Breeze GPC(Waters Co.,USA) 测量分子量以及分子量分布系数。实验条件:选用Waters ultrastyragel色谱柱和2417型示差检测器,流动相为色谱纯级DMF(含0.01 mol/L LiBr),柱温为50 ℃,流速为1 mL/min。
扫面电镜(SEM) 观察:用扫面电镜(OXFORD,Quanta400F) 检测制备的丝蛋白膜表面结构。
1.1.3 再生丝素原液的制备
按浴比1∶50将蚕茧加入0.02 mol/L的碳酸钠溶液中,煮沸30 min,用去离子水漂洗,上述步骤重复两遍,然后用温水漂洗两次,拧干扯松,鼓风干燥箱60 ℃干燥。按15%(W/V) 的比例将丝素蛋白溶于9.3 mol/L 的LiBr溶液,60 ℃溶解1 h,装入截留分子量为3 500 Da的纤维素透析袋,25 ℃透析3 d,每6 h换一次水,然后置于pH为9的硼酸缓冲液透析1 d,4 ℃保存。
1.1.4 带苯胺端基的聚赖氨酸(Aniline-PIL) 的合成
将5.0 g Nε-苄氧羰基-L-赖氨酸分散于50 mL经NaH除水处理的四氢呋喃,氩气保护下,加热至55 ℃,加入3.5 g 三光气,反应1 h,旋蒸除去溶剂,加入100 mL乙酸乙酯溶解,用饱和碳酸氢钠水溶液洗涤3次,分离出有机相,用无水硫酸镁干燥24 h,过滤后旋蒸除去乙酸乙酯,得到Nε-苄氧羰基赖氨酸-N-羧基环内酸酐(zLL-NCA)。
将1.6 g 单体Nε-苄氧羰基赖氨酸-N-羧基环内酸酐溶于30 mL DMF,加入73 mg 的引发剂N-Boc-苯胺,单体与引发剂的比例([M0]/[I0]) 为30,通氮气保护,25 ℃反应3 d,反应结束,装入截留分子量为3 500 Da的纤维素透析袋,去离子水中透析2 d除去DMF,得到端基为 N-Boc-苯胺的聚Nε-苄氧羰基赖氨酸(B-Aniline-PzLL)。冰浴下,按照100 mg/mL TFA的浓度将B-Aniline-PzLL溶于三氟乙酸,滴加1/3三氟乙酸体积的氢溴酸,滴加完毕后撤去冰浴,室温反应2 h,旋蒸除去三氟乙酸和氢溴酸,加适量去离子水溶解,用0.1 mol/L的氢氧化钠溶液中和多余的酸,透析3 d,冻干得到带苯胺端基的聚赖氨酸(Aniline-PIL) ,反应路线(图1A)。
1.1.5 聚赖氨酸修饰丝素蛋白的制备
将40 mg带苯胺端基的聚赖氨酸(Aniline-PIL),溶于2.5 mL纯水,加入1.25 mL对甲苯磺酸一水合物(0.10 mmol) 溶液,滴加1.25 mL的亚硝酸钠(0.05 mmol) 水溶液,反应10 min,上述溶液混合均在冰浴中进行,加入20 mL 经硼酸缓冲液透析处理的再生丝素蛋白水溶液,冰水浴中反应30 min,装入截留分子量为8 000 Da的纤维素透析袋,纯水中透析3 d除去盐和未反应的聚赖氨酸,每半天换一次水(图1B)。
1.1.6 聚赖氨酸修饰丝素蛋白膜的制备
取2 mL 1.1.5制备的聚赖氨酸修饰丝素蛋白水溶液加入24孔板,40 ℃鼓风干燥箱干燥12 h,加入80%的乙醇水溶液,放置20 min诱导丝素蛋白构象变化,去掉溶剂,自然干燥,得到稳定不水溶的聚赖氨酸修饰的丝素蛋白膜,用于后续细胞实验。
1.2 细胞实验部分
1.2.1 神经干细胞(NSCs) 的分离、培养和鉴定
实验中采取孕 16–18 d胚胎 SD大鼠脑组织(中山大学实验动物中心,广州,中国) 在 Hanks平衡盐溶液中机械切割和分离脑组织,并将细胞悬液以1 000 r/min离心5 min。弃上清,细胞沉淀稀释成单细胞悬液。将细胞接种于培养瓶(Corning) 中,用 DMEM/F12培养基(含有 2%B27(Gibco),1%青霉素/链霉素,1% L-谷氨酰胺(Gibco),20 ng/mL成纤维细胞生长因子-2(FGF-2)(Peprotech) 和 20 ng/mL表皮生长因子(EGF)(Peprotech)) 在37 ℃、5% CO2中培养。用Accutase酶(Millipore) 每周消化传代。这项研究中均使用第3代NSC进行实验,实验之前用免疫荧光进行神经干细胞鉴定。
1.2.2 CCK-8检测
第2代神经干细胞球用Accutase酶消化分解为单个细胞,并种植于预先用丝素蛋白膜(Silk)、聚赖氨酸修饰丝素蛋白膜(Silk-PIL) 和多聚赖氨酸(PLL) 包被好的24孔板(Corning) 中,每孔的细胞密度为1×105cells/mL,每孔总体积为1 mL,在37 ℃、5% CO2中培养。分别在1、3、5、7 d时加入10 μL CCK8试剂(Jangsu KeyGEN BioTECH Corp.,Ltd),37 ℃避光孵育3 h,之后将上清液吸入至 96孔板中在 450 nm波长下进行吸光度(OD) 值测定,使用空白对照孔调零,OD值相对于空白对照组越高表明细胞活力越好,反之则越差。实验重复3次。
1.2.3 NSCs诱导分化
第2代神经干细胞球用Accutase酶消化分解为单个细胞,并种植于预先用丝素蛋白膜(Silk)、多聚赖氨酸(PLL) 和聚赖氨酸修饰丝素蛋白膜(Silk-PIL) 包被好的24孔板(Corning,Acton,MA)中,每孔的细胞密度为1×105cells/mL,每孔总体积为1 mL,在37 ℃、5% CO2中培养。24 h之后,将原来培养基吸出,换分化培养基(无 EGF和FGF) 培养1周。
1.2.4 免疫荧光染色分析
诱导NSCs分化1周后,将24孔板中的细胞(n=3) 上清液吸去,用PBS洗3遍,每次5 min,之后加入4%多聚甲醛固定30 min,用PBS洗3遍,每次5 min。分别以0.3% Triton X-100透膜和10%山羊血清封闭30 min,去除血清,以适当浓度一抗孵育,4 ℃过夜。次日将标本复温,PBS洗3次,每次5 min,用荧光二抗于常温下避光孵育1 h。去除荧光二抗,PBS洗 2次,以 DAPI(Thermo Fisher) 染核15 min。PBS洗2次,将标本置于荧光显微镜下观察。所用一抗如下:神经干细胞标志物 Nestin(1∶200,CST)、SOX2(1∶200,CST)、新生神经元标志物 β3-tubulin(1∶200,CST)、成熟神经元标志物 MAP2(1∶200,CST)。所用二抗如下:FTIC标记羊抗兔或羊抗小鼠抗体(1∶200)。
1.2.5 Western blotting分析
神经干细胞分别在不同处理组上培养7 d后进行蛋白提取(n=3)。用RIPA(Santa Cruz) 进行裂解,提出的蛋白用 BCA(Beyotime) 法测其浓度,统一蛋白上样量为 20 μg,蛋白样品利用SDS-PAGE(10% Bis-Tris Gel) 进行电泳分离,并转移至PVDF膜,以5% BSA进行封闭,一抗4 ℃过夜,对应二抗37 ℃孵育1 h,最后以加强化学发光法显影(ECL system,Millipore)。所用一抗如下:Bax(1∶1 000,CST)、Bcl-2(1∶1 000,CST)、GAPDH(1∶1 000,CST)。各蛋白水平以GAPDH作为参照。
1.2.6 TUNEL分析
采用TUNEL染色法(Roche,Basel,Swiss)检测NSCs在不同处理组上培养7 d的细胞凋亡情况。先用 4%多聚甲醛在室温下固定 10 min,用PBS洗两次,每次 10 min,接着用 0.2% Triton X-100进行透膜30 min,用PBS洗2次,加TUNEL试剂避光37 ℃孵育1 h,之后用PBS再洗2次,加DAPI染核15 min。荧光显微镜下观察,凋亡细胞分布区域随机选取5个不重叠视野,计数阳性细胞数(显红色荧光)。
1.2.7 Real-time PCR分析
脑源性神经营养因子(Brain derived neurotrophic factor,BDNF) 是神经干细胞分泌的一种营养因子,对神经细胞的增殖、分化、存活有重要的影响。神经干细胞分别在不同处理组上培养 7 d后,用RT-PCR技术检测两组神经干细胞BDNF mRNA水平,具体操作见 RNA提取试剂盒(TaKaRa)、PrimeScript RT Reagent Kit和SYBR Green PCR Master Mix(TaKaRa) 说明书,引物序列见表2。
1.3 统计分析和制图
所有的统计数据用 SPSS 16.0和 GraphPad Prism 6进行统计分析和制图,结果用±s表示,组间比较采用单因素方差分析,两两比较采用Bonferroni检验。*P<0.05为显著,**P<0.01为极显著。

表1 引物序列Table 1 Primer sequence

图1 聚赖氨酸修饰丝素蛋白合成图Fig.1 Synthesis of Aniline-PIL modified silk.(A) Synthetic road map of Aniline-PIL.(B) Synthetic road map of Aniline-PIL modified silk.
2 结果与分析
2.1 聚赖氨酸修饰的丝素蛋白膜的合成
图 2A是丝素蛋白与经聚赖氨酸修饰的丝素蛋白水溶液的紫外-可见光谱图,两相比较,经聚赖氨酸修饰的丝素蛋白水溶液在352 nm发生强紫外吸收,393 nm处出现一个肩峰,这两处的紫外吸收由酪氨酸残基与苯胺基团偶联形成的偶氮苯结构造成[12],说明聚赖氨酸成功通过化学偶联的办法接枝到丝素蛋白骨架上。图2B是丝素蛋白和经聚赖氨酸修饰丝素蛋白的核磁共振谱图,与纯的丝素蛋白比较,经聚赖氨酸修饰的丝素蛋白在δ 3.00附近出现属于聚赖氨酸重复单元中残基上亚甲基的质子化学位移。与丝素蛋白和经聚赖氨酸修饰丝素蛋白溶液的紫外-可见光谱的数据一同说明,聚赖氨酸通过酪氨酸残基与苯胺的反应成功接枝到丝素蛋白上。扫描电镜观察显示,丝素蛋白膜呈纤维状三维立体结构,纤维分布均匀,孔隙大小为5-30 μm(图2C)。
2.2 神经干细胞的鉴定及增殖活性分析
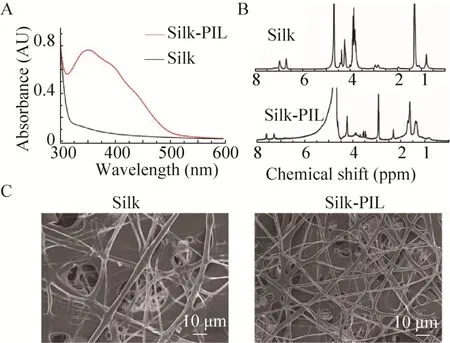
图2 丝素蛋白膜与经聚赖氨酸修饰的丝素蛋白膜的检测和观察Fig.2 UV-vis spectra and 1H NMR spectra of Silk and Silk-PIL.(A) UV-vis spectra of Silk and Silk-PIL.(B) 1H NMR spectra of Silk and Silk-PIL.(C) Observation of Silk and Silk-PIL by SEM.
所用细胞经免疫荧光检测均表现为Nestin和SOX2 阳性(图 3A),提示所用细胞为 NSCs。NSCs在不同处理组上生长7 d(图3B)。CCK-8法检测结果显示,第1天时Silk组(0.150±0.017),PLL组(0.163±0.036) 与 Silk-PIL 组(0.176±0.03) 的神经干细胞增殖能力无明显差异(P=0.582),但随着时间推移,第3天、第5天、第7天3组CCK-8检测结果显示,Silk+PIL 组(0.335±0.039、0.511±0.055、0.671±0.078)相 比 于 Silk 组(0.242±0.030、0.305±0.036、0.408±0.022),细胞增殖能力显著提高(P=0.032,P=0.006,P=0.005),而相比于 PLL组(0.319±0.031、0.435±0.074、0.615±0.063) 并无显著性差异(图3C)。
2.3 免疫荧光检测NSCs分化
在不同材料上诱导NSCs分化7 d后,用免疫荧光的方法检测 NSCs分化成神经元(包括新生神经元和成熟神经元) 和星型胶质细胞的面积(图 4A),实验结果表明,Silk-PIL组中新生神经元标志物 β3-tubulin阳性的细胞面积显著高于Silk组(P=0.034),对于成熟神经元标志物MAP2来说,Silk-PIL组中阳性细胞面积显著高于 Silk组(P=0.009),而相对于 PLL组,无论是新生神经元标志物 β3-tubulin还是成熟神经元标志物MAP2,两组之间并无显著性差异(P=0.541;P=0.347)。三组星形胶质细胞标志物 GFAP的阳性面积并无显著性差异(P=0.753)(图4B)。
2.4 Western blotting、TUNEL和 Real-time PCR分析
TUNEL检测结果表明,Silk组的凋亡细胞数量要明显多于 Silk-PIL和 PLL组(P=0.04)(图5A、D)。Bax为细胞内促凋亡蛋白,其表达量增高可导致细胞发生凋亡,Bcl-2为胞内抑制凋亡蛋白,其表达量增高可抑制细胞发生凋亡,Bax/Bcl-2的高低可反映细胞凋亡程度的高低[13]。在此实验中,NSCs分别在Silk、PLL和Silk-PIL上培养7 d后,Western blotting检测了Bax和Bcl-2的表达水平(图5A)。Silk组Bax/Bcl-2水平显著高于Silk-PIL组(P=0.024)(图5B、C),证明Silk组的 NSCs细胞凋亡程度较 Silk-PIL组高,Silk-PIL与PLL组之间Bax/Bcl-2水平无显著性差异。通过Real-time PCR发现Silk-PIL和PLL组NSCs中BDNF的mRNA表达量显著高于Silk组(P=0.03)(图 5E)。

图5 TUNEL检测凋亡细胞(A、D)、凋亡相关蛋白Bax和 Bcl-2的表达(B、C) 和神经营养因子 BDNF mRNA表达情况(E)Fig.5 TUNEL and Western blotting analysis of the levels of apoptotic cells(A,D) and Bax/Bcl-2 apoptosis-related protein(B,C).The levels of BDNF mRNA was detected by Q-PCR(D).Scale bar=100 μm.
3 讨论
正如许多研究所述,NSCs能够自我更新,可以分化为神经元和神经胶质细胞,这种性质可以使其补充中枢系统损伤后神经元和胶质细胞的缺失[14],从而形成有功能的神经回路,其次,在中枢神经系统损伤后,NSCs也能够分泌诸多营养因子(如BDNF、NT-3等),为神经和轴突再生提供良好的生存环境[15],综上,NSCs是中枢神经后移植修复的种子细胞。但如前文所述,NSCs也有其自身的缺点,如向神经元分化少、存活率低等,因此如何用适合的材料携带NSCs并促进NSCs在其上的存活和向神经元分化是亟待解决的问题。
研究表明,理想的组织工程材料应具备以下几个特性[16]:1) 具有良好的强度和理化性质;2)材料来源广泛且易加工成型,可塑性强;3) 具有良好的生物相容性,其自身及降解产物对细胞和机体无毒性,不会或较少引起炎症和免疫排斥反应;4) 生物降解速率与组织再生速率相匹配,最终可被充分吸收或安全排出体外;5) 良好的表面相容性,有足够的细胞吸附能力,支持细胞的黏附、生长、增殖、分化。
丝素蛋白是从蚕丝中提取的天然的高分子纤维蛋白,具有良好的理化特征和生物性能[17-18]。丝素被用作缝合线后,现在又被重新审视作为一种有广泛应用潜能的生物材料而焕发新生。
有研究者认为丝素蛋白具有以下优点:机械强度高、良好的生物相容性、生物降解性缓慢、制备方法多样易得、能够支持多种细胞的黏附、分化和生长[19-21]。已有研究实验将丝素蛋白作为成骨、韧带、肌腱、血管的组织工程支架,取得了良好的效果[22]。但丝素蛋白也有其自身的缺点,其主要成分为惰性蛋白,作为细胞载体与细胞黏附力较弱。
在此项研究中,我们用NSC作为种子细胞,并用聚赖氨酸修饰丝蛋白,增加丝蛋白中带正电荷的基团,增加其对细胞的粘附性,观察其对NSCs增殖和分化的影响。经CCK-8检测结果显示,NSCs在用聚赖氨酸修饰的丝蛋白膜上细胞活力增殖速度显著高于未经修饰的丝蛋白膜,Western blotting 检测也表明NSCs在聚赖氨酸修饰的丝蛋白膜上促凋亡蛋白Bax与抑凋亡蛋白Bcl-2比值显著低于单纯丝蛋白组,证明 NSCs在聚赖氨酸修饰的丝蛋白膜上细胞凋亡更少,存活率更高。免疫荧光检测NSCs分化结果表明,NSC在聚赖氨酸修饰的丝蛋白膜上分化的神经元数量显著多于其在单纯丝蛋白膜上的神经元数量,这表明聚赖氨酸修饰的丝蛋白膜能够促进 NSCs向神经元方向分化。不仅如此,RT-PCR结果提示,NSC在用聚赖氨酸修饰的丝蛋白膜上BDNF mRNA水平更高。BDNF作为一种神经营养因子可以促进神经生长,增加神经细胞的存活率,并且也有实验证明,BDNF能够促进神经干细胞向神经元方向分化,但向胶质细胞方向分化影响不大,这或许是导致 NSCs在聚赖氨酸修饰的丝蛋白膜上分化的神经元数量显著多于其在单纯丝蛋白膜上的神经元数量而胶质细胞数量却没有差异的原因之一[23-24]。同时,实验组 Silk-PIL在材料上的形态、数量、黏附性与PLL组无显著差异,说明多聚赖氨酸修饰的丝素蛋白能为 NSCs的黏附和生长分化提供良好的生长表面。
应用丝蛋白膜作为修复神经损伤材料也有其相对的局限性:比如丝蛋白的β折叠结晶易被破坏,降低了其力学性能[25];其次,体内实验表明将丝蛋白作为神经修复材料在体内降解速度较为缓慢[26-27],神经系统中并无丝蛋白成分,将其作为基质材料,在体内的效果需要进一步观察。尽管此研究表明用聚赖氨酸修饰的丝蛋白膜可以促进 NSCs增殖并促进其向神经元方向分化,但其中的机制还需进一步探究。如果进一步将其作为一种理想的细胞移植支架,尚需观察其移植体内的生物学效应,只有对此材料进行全面和综合的实验分析评价,才能为其在神经再生领域的应用提供可靠的实验依据。

