PKH26标记的人羊膜间充质干细胞在宫腔粘连大鼠中的迁移示踪
阳媛,毛艳华,王佳,孙聪聪,张应凤,陈芯培
重庆医科大学附属大学城医院 妇产科,重庆 401331
目前,宫腔粘连的治疗仍是妇产科疾病的重大难题之一。近年来,有研究表明间充质干细胞(Mesenchymal stem cell,MSC) 可成功修复受损的子宫内膜[1]。其中人羊膜间充质干细胞(Human amniotic mesenchymal stem cells,hAMSCs) 可从健康剖宫产妇废弃胎盘最内层的羊膜组织中分离培养获得,具有来源充足、无创伤性、无伦理学的问题、自我增殖能力强、低免疫原性和多向分化潜能等优势[2-6],成为更为理想的细胞移植的来源[7],为治疗宫腔粘连带来了新的思路。然而,hAMSCs移植人体内以后的去处以及其发挥的治疗作用尚不清楚。因此,提供一个简便有效的体内示踪方法,研究移植细胞在体内存活、迁移、分布等已成为干细胞移植研究领域的重要环节。大量研究表明 PKH26染料标记人脐带间充质干细胞及骨髓间充质干细胞等的示踪研究[8-10]。然而 PKH26标记的 hAMSCs在大鼠宫腔粘连子宫内膜的迁移示踪情况的报道较少。本研究采用PKH26对hAMSCs进行体外标记,观察其对细胞形态、增殖、活性、周期等生物学特征的影响,并通过尾静脉移植于宫腔粘连大鼠体内,观察其在大鼠子宫内膜组织中迁移情况,为 hAMSCs移植治疗宫腔粘连的研究提供一个有效的示踪方法,为下一步研究hAMSCs移植的作用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 羊膜来源
取自重庆医科大学附属第一医院产科,获得产妇同意且排除各种传染性疾病的正常足月剖宫产分娩的胎盘,于无菌条件下剥离羊膜组织。本实验经重庆医科大学伦理委员会(20141230) 批准,所有方法均按照有关规定执行。
1.1.2 实验动物
选取SPF级健康雌性SD大鼠15只,购自重庆医科大学实验动物中心。体质量220–250 g,每5只一笼,常规喂养。
1.2 方法
1.2.1 hAMSCs的分离、培养、鉴定
无菌条件下剥离羊膜组织,用PBS反复冲洗除去残留血液及绒毛膜并将其剪成约 1 mm×1 mm×1 mm组织碎块。加入 0.05%胰蛋白酶于37 ℃水浴锅中消化30 min,反复2次,离心弃上清液。然后加入0.1 mg/mLⅠ型胶原酶37 ℃消化1 h。200目细胞筛过滤,收集细胞滤液,离心、培养于含12%胎牛血清的DMEM/F12培养液中,在37 ℃、5% CO2的恒温培养箱中孵育。2–3 d更换培养基一次,待细胞长至 85%–90%融合时传代。取第3代细胞用流式细胞仪检测细胞膜免疫表型CD29、CD34、CD90、HLA-DR的表达,并做阴性对照检测;用免疫荧光检测hAMSCs间充质细胞标志物波形蛋白和上皮细胞标志物角蛋白的表达。
1.2.2 PKH26标记羊膜间充质干细胞
取第3代hAMSCs消化成单细胞悬液,用PBS清洗一遍,离心,小心弃上清液(剩余上层细胞体积不多于 25 μL)。按照 PKH26(Sigma公司) 试剂盒说明书加入1 mL稀释液C,轻轻吹打混匀制成细胞悬液。在染色前,配置好4×10–6mol/L染色工作液,快速将细胞悬液加入到染色液中充分混匀孵育1–5 min。加入2 mL的血清终止反应,孵育 1 min以结合多余染液。离心弃上清,用10 mL完全培养基重悬细胞,移至另一新的离心管中,反复清洗2遍。重悬至实验所需的细胞浓度。细胞涂片,荧光镜下观察细胞,计算荧光标记率。将细胞常规传代培养,观察单次标记后在体外检测到PKH26荧光的时间,每次传代前于荧光镜下观察显色情况。
1.2.3 细胞活性和增殖的检测
取第3代标记和未标记的hAMSCs,用CCK-8试剂盒检测其活性及增殖能力,计算存活率并绘制生长曲线。按照试剂盒说明书操作每孔加入100 μL(含细胞数约为1 000个) 细胞悬液接种于96孔板中。每次取5孔检测hAMSCs活性,重复3次;每天相同时间取3孔,共6 d检测细胞的增殖能力。用全自动酶标仪检测 450 nm处的吸光度,取均值。存活率=(标记组OD值–空白孔OD值)/(未标记组OD值–空白孔OD值);以培养时间为横坐标、相应的吸光度值为纵坐标,绘制生长曲线。
1.2.4 细胞周期和凋亡的检测
取第3代标记和未标记的hAMSCs,用流式细胞仪检测细胞周期和凋亡率。
1.2.5 建立大鼠宫腔粘连模型
参照蔡慧华等[11]的方法建模。选用15只SD大鼠,随机分为3组,每组5只。每日上午经阴道涂片检查,确认有动情周期。空白对照组不予处理;实验组建立宫腔粘连模型,腹腔注射5%、2 mL/只的水合氯醛麻醉。严格遵守无菌原则,于大鼠的下腹正中部纵行切开一长约 3–4 cm的切口,分离组织进入腹腔,暴露子宫。在距宫体交界处1 cm的左宫角横切开一微小切口,自该切口用自制的小刮勺向宫角远端搔刮左侧子宫腔4圈,搔刮长度约4 cm,停止搔刮。于宫腔内留置已备好的脂多糖棉线,同法处理右侧子宫角。生理盐水冲洗腹腔,缝合切口。留置约2 cm的棉线残端于腹部,2 d后轻拉尾丝,取出宫内棉线,建模后经尾静脉移植1 mL PKH26标记的hAMSCs(含2×106个);实验对照组按实验组方法建模,建模后经尾静脉注射等体积的PBS液。
1.2.6 荧光共聚焦显微镜下观察 hAMSCs在大鼠子宫内膜中的分布
hAMSCs移植后14 d,收集大鼠子宫组织行冰冻切片,荧光共聚焦显微镜下观察PKH26标记的hAMSCs在子宫中的分布情况。
1.3 统计学处理
采用SPSS19.0软件进行统计学分析,数据用x±s表示,检验水准α=0.05,P<0.05具有统计学意义。
2 结果与分析
2.1 hAMSCs形态观察、表面标志物特征及PKH26标记效果
hAMSCs贴壁生长,形态呈梭形或多角形,排列紧密,胞体拉伸,单层放射状或漩涡状生长,传代后细胞增殖迅速,约3–4 d可铺满全层(图1)。流式细胞仪检测 hAMSCs高表达 CD29、CD90(95%以上),几乎不表达 CD34、HLA-DR(图 2),类似于文献报道的间充质干细胞的表型表达[9]。免疫荧光染色显示hAMSCs表达波形蛋白,而不表达角蛋白(图3),说明提取的hAMSCs纯度较高。PKH26标记阳性率100%;CCK-8检测显示标记细胞的存活率高达99%。第3代hAMSCs首次PKH26染色后,经过4次传代,每代3–5 d,随着细胞的传代荧光强度逐渐减弱(图4)。
2.2 hAMSCs标记组与未标记组的细胞增殖能力的检测
CCK-8检测对两组细胞进行细胞增殖能力的检测,结果显示:第3–5天细胞增殖速度较快,为对数增长期;之后细胞生长进入平台期。两组差异无统计学意义(t=0.924 5)(图5)。
2.3 hAMSCs标记组与未标记组的细胞凋亡检测
对两组的各类细胞比例行独立样本t检验,差异无统计学意义(P=0.878 9),说明PKH26标记hAMSCs不影响细胞的凋亡(图6)。

图1 人羊膜间充质干细胞在显微镜下的形态Fig.1 Morphology of human amniotic mesenchymal stem cells under microscope.(A) The primary cells in the third day.(B) Cells after passage.

图2 人羊膜间充质干细胞免疫表型测定Fig.2 The immunophenotype of human amniotic mesenchymal stem cells.(A) CD29(99.60%,positive).(B) CD90(98.69%,positive).(C) CD34(0.45%,negative).(D) HLA-DR(1.04%,negative).
2.4 hAMSCs标记组与未标记组细胞的周期检测
两组的大部分细胞处于 DNA合成前期(G1期),少数细胞处于DNA复制期(S期)、DNA合成后期(G2) 和有丝分裂期(M期)。两组各期的细胞比例差异无统计学意义(P=0.980 3),说明PKH26标记hAMSCs不影响细胞的周期(图7)。
2.5 hAMSCs移植后在子宫中的分布情况
荧光共聚焦显微镜下可见 PKH26标记阳性的hAMSCs散在分布在大鼠子宫内膜中,呈红色荧光。对照组和实验对照组基本未见红色荧光(图 8)。

图3 人羊膜间充质干细胞波形蛋白(A)、角蛋白(B) 的表达情况Fig.3 Expression of vimentin(A) and keratin(B) in amniotic mesenchymal stem cells.

图4 PKH26标记的人羊膜间充质干细胞Fig.4 Human amniotic mesenchymal stem cells labeled by PKH26.(A) P3 generation cells stained for the first time by PKH26.(B-E) Fluorescence staining of 2,3,4 and 5 passages cells.

图5 人羊膜间充质干细胞 PKH26标记组和未标记组的细胞增殖检测Fig.5 Cell proliferation of human amniotic mesenchymal stem cells in PKH26 and unmarked groups.

图6 人羊膜间充质干细胞PKH26标记组和未标记组的细胞凋亡检测Fig.6 Cell apoptosis detection of human amniotic mesenchymal stem cells in PKH26 and unmarked groups.
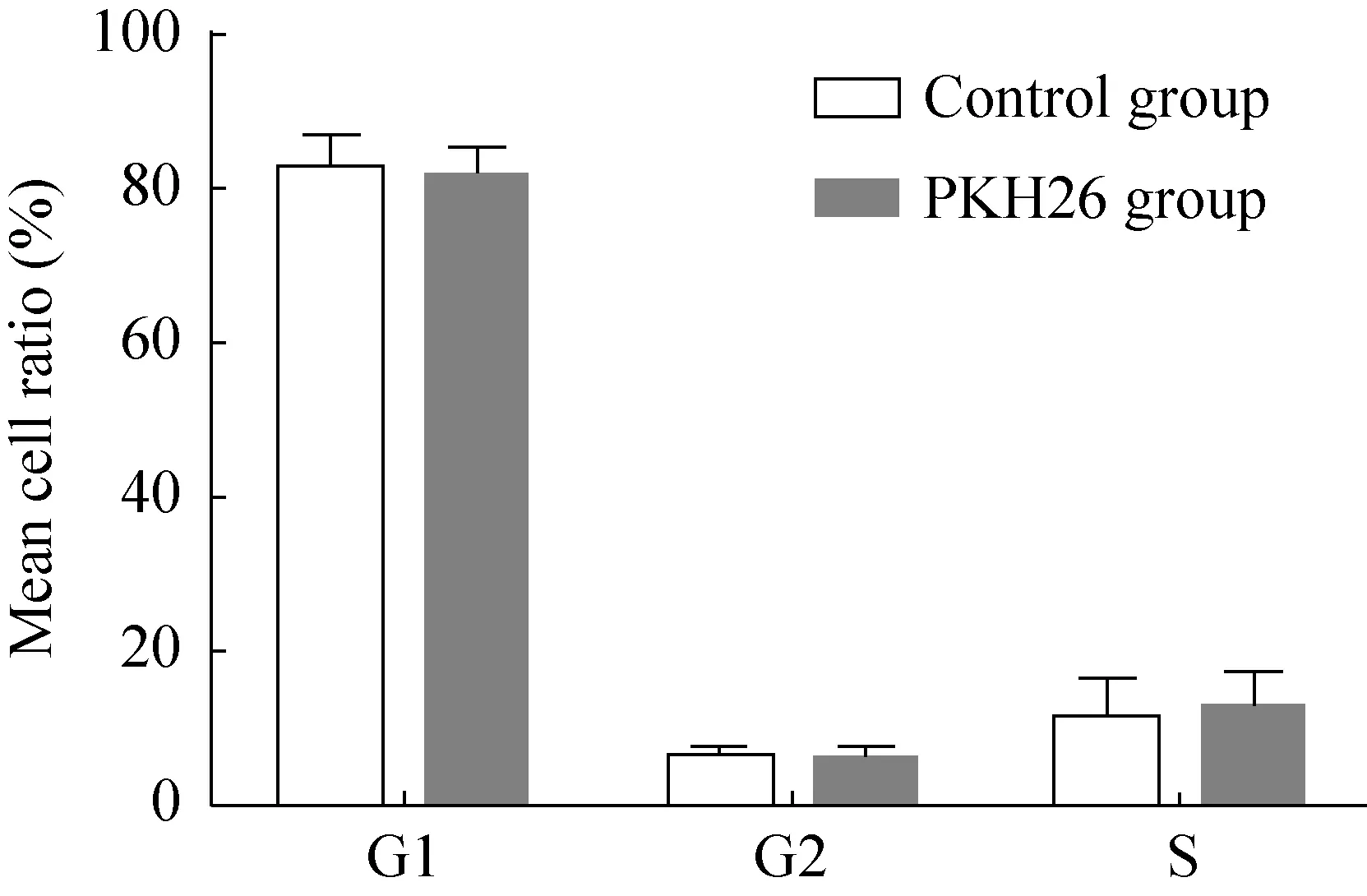
图7 人羊膜间充质干细胞PKH26标记组和未标记组的细胞周期检测Fig.7 Cell cycle detection of human amniotic mesenchymal stem cells in PKH26 and unmarked groups.

图8 荧光共聚焦显微镜下观察 PKH26标记的hAMSCs在大鼠子宫内膜的分布情况Fig.8 Distribution of PKH26 labeled hAMSCs in the endometrium of rats under the fluorescence confocal microscopy.(A,B) Experimental group.(C) Experimental control group.(D) Control group.
3 讨论
本课题组人员临床研究发现羊膜移植可有效改善宫腔粘连患者术后再粘连、月经等情况[12],但其中的作用机制尚不清楚。有学者认为宫腔粘连的形成可能与子宫内膜基层干细胞功能受损和数量减少甚至缺失有关[13],而子宫内膜的再生修复需要一定数量的子宫内膜干细胞[14]。目前已有研究证实羊膜中含有干细胞样细胞,且整张羊膜可产生高达4×108个hAMSCs[15]。羊膜间充质干细胞具有自我更新、较强的分化潜能,在体外可向胰岛样细胞(内胚层)[16]、成骨细胞、脂肪细胞(中胚层)[17]、神经细胞(外胚层)[18-19]等 3个胚层的不同类型细胞分化。多项研究也表明 hAMSCs是修复重建受损组织、器官功能的理想种子细胞[20]。因此,如何选用一种简便、有效的方法标记hAMSCs,了解其在体内迁移及修复子宫内膜的机制是亟待解决的问题。
PKH26是一种荧光染料,具有亲脂性,可与细胞膜的脂质双分子层发生不可逆的结合,产生红色荧光,标记物可随细胞分裂平均分配给子细胞。目前广泛用于多种细胞或其他含颗粒胞膜的标记[21-23],对细胞无明显毒副作用[24],不影响细胞原有的生物学特性[25],且可重复性好。既往实验表明,细胞移植后PKH26染料不会在已标记和未标记的细胞间传递,且不会从凋亡或死亡的细胞中释放出来,可精确区分移植细胞和宿主细胞[21]。PKH26能稳定存留于体内6个月[26],甚至有标记神经干细胞超过1年的记录[21],目前成为研究细胞迁移示踪的理想工具。
因此,本研究对 hAMSCs进行 PKH26荧光标记。标记后细胞形态和细胞生长状态、细胞周期和凋亡均无明显变化。CCK-8实验检测PKH26标记后细胞存活率>95%,表明该染料不影响细胞的活性,无细胞毒性作用。PKH26首次标记后,荧光强度随着细胞传代逐渐减弱,这可能与染料随着细胞分裂平均分配到子代细胞有关[27]。标记的细胞经过4次传代仍可观察到荧光显色,这说明标记的hAMSCs至少在20 d内可以被检测出。此外,hAMSCs移植后2周在实验组大鼠的子宫内膜层可观察到红色荧光,而在对照组和实验对照组未见红色荧光。由此推测,受损的子宫可能启动了体内的某些信号系统,当hAMSCs移植入体内后,经血迁移至子宫,并停留于此。然而本实验只观察了hAMSCs移植后2周的子宫组织情况,在今后的研究中,将继续观察hAMSCs在体内远期的迁移、增殖分化情况,并检测 hAMSCs对宫腔粘连的治疗效果及作用机制。

