-磷酸三钙陶瓷多孔结构厚度对释药过程影响的体外研究*
袁君杰薛锋* 张东倪伟峰殷诺 黄晓燕 肖海军谢幼专
脊柱结核病灶清除术前常搭配使用1~4周的抗结核药 物治疗,术后继续应用6~9月,以此来加强疗效[1]。全身用药往往难以在病变部位达到有效浓度,同时存在肝肾器官毒副作用[2]。传统的骨组织缺损修复主要通过自体骨移植实现,但自体骨来源有限,存在供体部位并发症。选择合适的支架材料结合抗生素形成药物缓释系统可有效解决此类问题,是当前研究的热点[3-5]。 -磷酸三钙( -tricalcium phosphate, -TCP)陶瓷是一种优良的骨组织工程支架材料[6],不仅能用作修复骨缺损[7,8],而且在药物缓释载体方面的应用也受到广泛关注[9-11], -TCP多孔结构内部除有微小孔隙外,还有许多明显的大孔,孔间相互连通,其结构类似正常松质骨,合适的孔径和孔内连接确保了其良好的骨传导性,有利于新骨长入,同时可以释放药物。有研究应用多孔 -TCP复合自体干细胞修复动物[12,13]和患者[14]的椎体骨缺损,效果满意。
药物从载体中释放受到药物本身、药物与载体结合方式、载体孔径和孔隙率等多种因素制约,目前 -TCP多孔结构区厚度对药物释放的影响尚不明确,为此,本研究设计制备了含贮药腔的多孔 -TCP作为药物缓释载体,通过直接填充法构建了利福平/-TCP药物缓释系统,分析其体外药物释放特性,明确 -TCP多孔结构厚度对释药过程的影响。
1 材料与方法
1.1 主要材料与仪器
利福平(Sigma-Aldrich,美国);酶标仪(Synergy HT,Bio-Tek美国);万能材料试验机(Instron,美国);双三元液相色谱系统(Ultimate 3000,Dionex,美国);隔水式电热恒温培养箱(上海跃进医疗器械厂,中国);小牛血清(Gibco,美国);扫描电镜(HitachiS-4800,日本);PMMA颗粒(Lucite International 8FAC15,英国); -TCP粉剂(LuciteInternational,英国);XRD(Escalab250Xi,Thermo Fisher,美国)。
1.2 方法
1.2.1 -TCP载体设计制备及XRD测试
设计制作2种圆柱状的多孔 -TCP载体(见图1),载体直径为14 mm,高30 mm,载体中心有贮药腔道,用于贮存药物,高25 mm,直径分别为3 mm和8 mm;孔隙率为75%,孔直径为(500±200) m,孔连接径为(100±50)m,适合于细胞的黏附、增殖培养和释放药物。多孔 -TCP载体是在上海贝奥路生物材料有限公司通过注浆成型法[14]烧结而成。多孔 -TCP载体的物相组成通过X射线衍射(X-ray Diffraction,XRD)测定(40kv,35mA)。
1.2.2 -TCP载体力学强度测试
使用万能材料试验机测定两种规格 -TCP载体的纵向压缩强度(n=5)。将圆柱状的试样纵向放置在载物台上,开动测试机,以2mm/min的恒定速度加载试样,直至试样破裂。同理,以磷酸盐缓冲液(Phosphate Buffered Saline,PBS)为介质的药物缓释系统,40周后取出 -TCP载体,清除贮药腔内残留的利福平,检测干燥后的载体纵向压缩强度(n=5)。
1.2.3 -TCP载体结构表征测试
选取力学强度测试后完好的 -TCP碎片,表面喷金后使用扫描电子显微镜(Scanning Electron Microscope,SEM)观察 -TCP多孔结构区的表面和断面形貌并拍照。随机选取20张低倍(30~100倍)多孔结构SEM图片,使用Photoshop CC软件测量大孔和孔内连接的数目、大小,评估单位面积多孔结构的大孔数及孔内连接与大孔数目之比。同理,观察测定以PBS为介质的药物缓释系统40周后 -TCP载体多孔结构大孔和孔内连接径数目、大小。
1.2.4 体外缓释实验
在无菌操作台内,分别往贮药腔直径3 mm和8 mm-TCP载体(n=10)内各填充0.3 g灭菌后的利福平粉剂。接着用无菌硅胶塞在贮药腔顶端封口,通过鱼线将组装好的药物缓释系统与螺旋玻璃瓶盖子串联,使其可以悬吊在溶液中,然后用游标卡尺测量出距 -TCP载体顶端5mm的位置,在该位置处缠绕一圈鱼线。
体外缓释实验的浸提介质分为两组,一组以PBS为介质(n=5),在玻璃瓶中预装200mLpH 7.4的PBS,然后将药物缓释系统悬吊在PBS中,液面距 -TCP载体顶端5mm。将整个缓释装置静置于37℃的恒温箱内,每日完全更换等量37℃新鲜PBS。使用酶标仪在波长474 nm处测定洗脱液的吸光度值,根据利福平溶液的标准曲线,计算溶液中利福平浓度,进而计算每日释药量和累积释药率。另一组以小牛血清(Calf Serum,CS)为介质(n=5),在玻璃瓶中预装200 mL CS,然后将药物缓释系统悬吊在CS中,液面距 -TCP载体顶端5 mm。将整个缓释装置静置于37℃的恒温箱内,每日微量换液,即每日更换10mL37℃新鲜CS。采用高效液相色谱法测定洗脱液中的利福平浓度,计算每日释药量和累积释药率。

1.2.5 数据统计分析
实验数据采用SPSS20.0统计软件处理。定量资料均采用表示,数据采用独立样本 检验进行检验。<0.05表示差异有显著性统计学意义。
2 结果
2.1 制备的 -TCP载体
经高温烧结之后的两种规格 -TCP载体如图1(Ad、Bd)所示。2种多孔 -TCP载体均呈圆柱状,高30mm,直径14 mm;载体中央有贮药腔,高为25 mm,直径分别为3 mm和8 mm。贮药腔直径3 mm和8 mm多孔 -TCP载体质量分别为(3.35±0.03)g、(2.25±0.02)g。

图1,-磷酸三钙载体设计图和实物图。图A、B分别为贮药腔直径3 mm和8 mm多孔 -磷酸三钙载体,图Aa、Ba为立体设计图,Ab、Bb为横截面设计图,Ac、Bc为纵切面设计图,Ad、Bd为实物图。
2.2 -TCP载体XRD测试结果
制备的 -TCP载体的XRD图谱如图2所示,试样各峰度值与 -TCP标准品一致,表明制备的 -TCP载体的物相组成是由钙和磷组成的,是纯粹的 -磷酸三钙生物陶瓷制品。
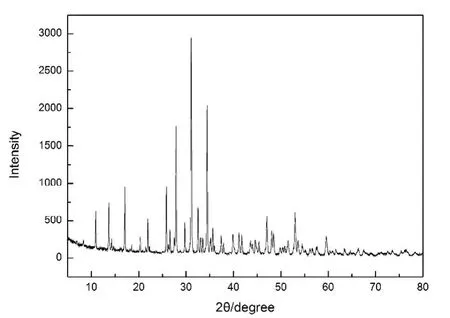
图2,-磷酸三钙载体XRD图。
2.3 -TCP载体力学强度测试结果
-TCP载体力学强度测试结果见图3,原始状态的贮药腔直径3 mm和8 mm多孔 -TCP的纵向压缩强度分别为(1.09±0.05)MPa、(0.71±0.04)MPa(<0.05)。贮药腔直径3 mm多孔 -TCP与贮药腔直径8 mm多孔 -TCP相比,其纵向压缩强度增幅达53.52%±7.04%(<0.05)。贮药腔直径3 mm和8 mm多孔 -TCP在PBS中浸泡40周后,其纵向压缩强度分别为(0.62±0.07)MPa、(0.41±0.05)MPa(<0.05),与缓释之前相比,其纵向压缩强度同比下降75.81%±8.06%、73.17%±9.76%(<0.05)。
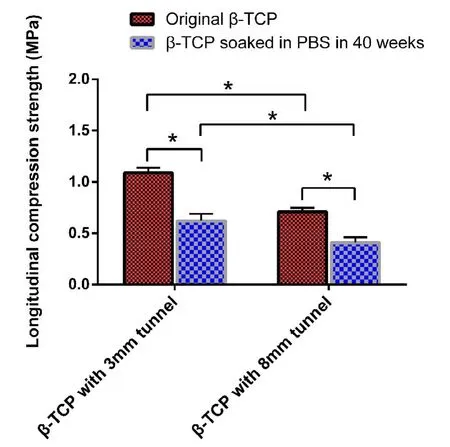
图3,-磷酸三钙载体缓释实验前后力学强度变化图。*表示<0.05。
2.4 -TCP载体SEM表征结果
在 -TCP载体多孔结构表面(如图4-Aa所示)存在许多大孔,多孔结构内部不同的大孔结构可通过孔内连接连通。相邻大孔结构之间为致密结构,致密结构的磷酸三钙颗粒之间结合紧密,颗粒棱角分明,边缘比较锐利,在少数颗粒之间存在微小的孔隙(见图4-Ac)。多孔结构表面大孔孔径为(308.9±19.6) m,孔内连接径为(75.3±12.7) m;单位面积多孔结构表面的大孔数目为(5.64±0.08)/mm2,孔内连接数目为(9.69±0.02)/mm2,孔内连接与大孔数目之比为1.71±0.01。多孔结构断面(如图4-Ab所示)大孔孔径为(540.7±83.0) m,孔内连接径为(65.3±18.8) m;单位面积多孔结构断面的大孔数目为(4.61±0.05)/mm2,孔内连接数目为(12.39±0.22)/mm2,孔内连接与大孔数目之比为 2.69±0.58。多孔结构表面和断面的大孔平均孔径为(438.7±133.0) m,平均孔内连接径为(69.6±16.8) m。
经过长达40周的体外缓释后,载体多孔结构表面大孔边缘较缓释之前平整、圆滑(见图4-Ba),孔径为(399.4±21.3)m,较缓释前增大 29.30%±6.90(<0.05);孔内连接径为(98.7±11.7) m,较缓释前增大31.08%±15.54(<0.05);单位面积多孔结构的大孔数目为 (4.53±0.02)/mm2,孔内连接数目为(11.59±0.08)/mm2,孔内连接与大孔数目之比为2.56±0.44,与缓释之前相比,增幅为 49.71%±25.73(<0.05)。多孔结构断面(见图4-Bb)大孔孔径为708.7±90.2 m,较缓释 前增 大 31.07%±16.68(<0.05);孔内 连 接径 为(164.4±14.2) m,较缓释前增大 51.76%±21.75(<0.05);单位面积多孔结构的大孔数目为(2.06±0.05)/mm2,孔内连接数目为(6.51±0.01)/mm2,孔内连接与大孔数之比为3.15±0.35,与缓释之前相比,增幅为 17.10%±13.01(<0.05)。体外缓释40周后, -TCP载体多孔结构表面和断面的大孔平均孔径为(614.6±214.4)m,较缓释前增大40.10%±48.87%(<0.05);平均孔内连接径为(128.3±38.5) m,较缓释前增大84.33%±55.32(<0.05)。载体经过长达40周浸泡后,多孔结构孔径明显增大,孔内连接数目增多,在相连大孔之间的致密结构也出现内连接孔(见图4-Bc)。

图4,-磷酸三钙载体缓释实验前后各部分结构SEM图。图A、B分别为缓释实验前后载体形貌,图Aa(×50)、Ba(×30)为多孔结构表面形貌,图Ab(×30)、Bb(×50)为多孔结构断面形貌,图Ac(×1500)、Bc(×1500)为致密结构表面形貌。
2.5 以PBS为介质组的利福平体外缓释结果
以PBS为介质的体外缓释组,体外缓释实验总共进行了40周,清除载体贮药腔内残留的利福平后干燥称重,贮药腔直径3mm和8mm多孔 -TCP质量分别为(3.29±0.02)g、(2.16±0.01)g,其质量较缓释前同比下降(0.06±0.01)g、(0.09±0.01)g(<0.05)。贮药腔直径3 mm和8 mm多孔 -TCP在体外40周的累积释药量分别为(234.87±31.75)mg 、(289.02±38.18)mg(<0.05),其累积释药率(如图5-D所示)分别为78.29%±10.58%、96.34%±12.73%(<0.05);利福平每2周累积释药率如图5-C所示,单一多孔结构 -TCP药物缓释系统的释药曲线波动较大,尤以贮药腔直径8 mm多孔 -TCP为载体的药物缓释系统最甚,后期释药波动幅度变小,趋势较平稳。在初始的4周,利福平从贮药腔直径3 mm和8 mm多孔 -TCP药物缓释系统中每日释放量见图 5-A,其累积释药量分别为(23.54±3.76)mg、(29.86±4.25)mg(<0.05),累积释药率(见图5-B)分别为7.85%±1.25%、9.95%±1.42%(<0.05)。
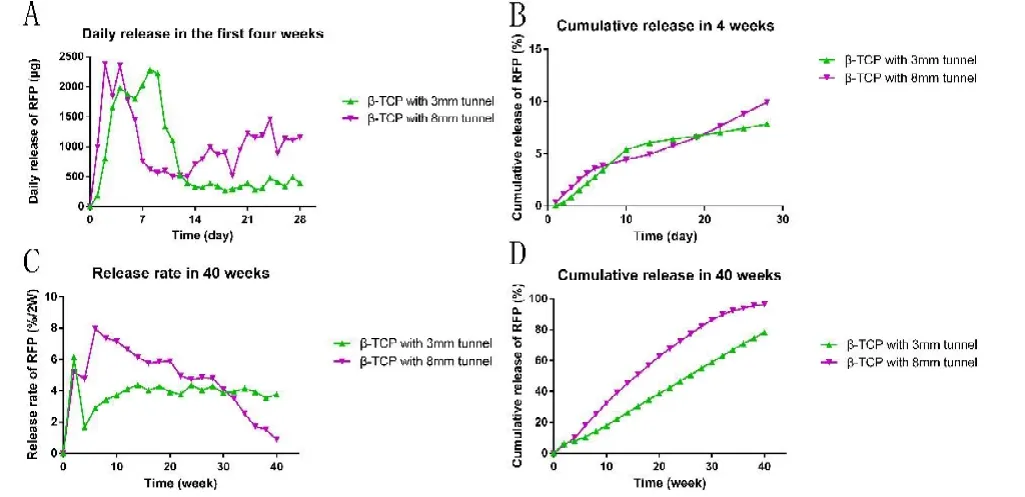
图5,以PBS为介质组的利福平体外缓释结果图。图A为缓释实验初始4周每天释药量。图 B为缓释实验初始4周利福平累计释药量,利福平从贮药腔直径3 mm和8mm多孔 -TCP药物缓释系统中累积释药率分别为7.85%±1.25%、9.95%±1.42%(<0.05)。图 C 为40周缓释实验利福平每2周累计释药率。图D为40周缓释实验利福平累计释药率,贮药腔直径3 mm和8 mm多孔 -TCP在体外40周的累积释药率分别为78.29%±10.58%、96.34%±12.73%(<0.05)。
2.6 以CS为介质组的利福平体外缓释结果
以CS为介质的体外缓释组,总共进行了4周实验。贮药腔直径3 mm和8 mm多孔 -TCP负载利福平后,在体外4 周的累积释药量分别为(27.54±2.15)mg、(30.95±2.51)mg(<0.05),其累积释药率(如图 6所示)分别为12.51%±0.72%、13.65%±0.83%(<0.05)。
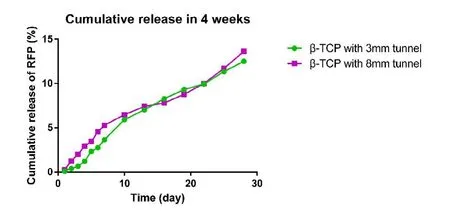
图6,以CS为介质组的利福平体外缓释结果图。
3 讨论
在脊柱结核病灶清除术后,单一通过全身运用抗结核药物治疗往往疗效不确切,这是因为抗生素药物不能真正到达骨感染部位,特别是在病灶清除术后残存的坏死或无血管部位。将药物负载到合适的载体构成药物缓释系统可以延长药物疗效、减少毒副反应、提高生物利用率等[15,16]。 -TCP已在临床上应用于骨组织修复,其无毒和良好的生物相容性已被广泛认知[8,10,17,18],本研究设计制备的 -TCP载体通过分析SEM图片得知,多孔结构大孔平均孔径为(438.7±133.0)m,孔内连接径为(69.6±16.8) m,与设计初衷的孔径范围基本相符。贮药腔直径3 mm多孔 -TCP与贮药腔直径8 mm多孔 -TCP相比,其纵向压缩强度增幅达53.52%±7.04%,说明多孔结构能起到一定的力学强度增幅作用,这与较厚的多孔结构含有的致密结构较多有关。贮药腔直径3 mm和8 mm多孔 -TCP在PBS中浸泡40周后,其质量较缓释前同比下降(0.06±0.01)g、(0.09±0.01)g(<0.05),纵向压缩强度同比下降75.81%±8.06%、73.17%±9.76%(<0.05),降幅明显,表明多孔结构 -TCP不易长期维持力学强度,容易降解。
本研究将药物缓释系统悬吊在液体中,避免了全浸泡放置时载体部分多孔结构与玻璃瓶壁接触,从而阻碍了利福平的释放;悬吊后液面距离载体顶端5 mm,而不是全部处于液体内,是由于硅胶塞在水平标记线(与液面平齐)之上,从而避免因为硅胶塞封闭不紧密,利福平从硅胶塞与载体缝隙间外漏而干扰实验结果。在载体外围缠绕一圈鱼线具有指示载体入水深度的作用,可以随时观测每次换液前后载体入水深度是否一致。
以 PBS为介质的体外缓释组,贮药腔直径3 mm和8 mm多孔 -TCP负载利福平后,在体外40周累积释药率分别为 78.29%±10.58%、96.34%±12.73%(<0.05)。两种规格 -TCP载体贮药腔周边的多孔结构厚度不同,贮药腔直径3mm多孔 -TCP贮药腔周边多孔结构厚5.5 mm,贮药腔直径8 mm多孔 -TCP载体贮药腔周边多孔结构厚3 mm,后者在 PBS中40周累积释药率是前者的1.23倍(<0.05),表明多孔结构能控制利福平释放速率,多孔结构越厚,其药物释放速率越慢。每个 -TCP载体负载0.3 g利福平后,单一多孔结构 -TCP药物缓释系统释药速度较快,其中贮药腔直径8mm的药物缓释系统在40周的累积释药率达96.34%,之后取出载体,发现在载体贮药腔内有红褐色的利福平沉积,这可能是因为利福平微溶于PBS,药物随时间推移慢慢积聚在一起,类似河床泥沙淤积过程,表明药物释放不仅与载体结构有关,还与药物本身的特性相关。
对于以CS为介质组,之所以采取微量换液,是由于动物血清成本较高,但以CS为介质组可以与体内缓释过程相对比,故设计了微量换液的CS介质组。在缓释实验开始的前4周,在以PBS为介质的溶液中,贮药腔直径3mm和8 mm多孔-TCP药物缓释系统的累积释药量分别为(23.54±3.76)mg、(29.86±4.25)mg,累积释药率分别为7.85%±1.25%、9.95%±1.42%;以 CS为介质组的累积释药量分别为(27.54±2.15)mg、(30.95±2.51)mg,其累积释药率分别为12.51%±0.72%、13.65%±0.83%。两种规格 -TCP载体构建的药物缓释系统以CS为介质组其利福平释放量高于以PBS为介质组,这可能与利福平药物特性有关,利福平微溶于水、PBS,易溶于有机溶剂,是疏水性物质,而动物血清中含有大量蛋白质,蛋白质是两性分子,含有疏水端和亲水端,能结合溶液中的利福平,溶液中游离的利福平减少,使载体内外溶液的利福平浓度梯度增大,从而增加利福平的释放。
影响磷酸钙载体释药的因素主要有被负载药物的扩散系数、载体材料孔径和孔隙率的大小及侵入或包裹载体的物质浓度等。药物的扩散系数、材料的孔径和孔隙率越大,侵入或包裹物的浓度越低,药物释放越快,反之亦然[19]。韩辰等[20]研究发现孔隙率可显著改变 -TCP结构,并影响释药速率,有望用于控制载药 -TCP陶瓷载体的缓释过程。本文研究表明药物从缓释系统中的释放特性不仅与多孔 -TCP载体的多孔结构厚度有关,还与药物本身的特性、洗脱液类型有关,-TCP多孔结构厚度能有效控制药物的释放。保持利福平浓度在(0.005-0.5)g/mL可以杀灭结核分枝杆菌[21,22]。在本部分体外研究中,多孔 -TCP载体负载利福平后在PBS洗脱介质中能够缓释长达40周以上,释药浓度均在治疗浓度之上,有望用于脊柱结核术后椎体缺损的治疗。

