山羊腰椎融合动物模型的围手术期管理*
马建青吴占勇*孔建军王会旺崔福斋仇志烨 赵朝晖吴春富冯慧霞宋占锋
动物实验是医学研究的基本手段之一,对实验动物围手术期的正确管理及术后感染和并发症的及时观测、防治等直接关系到实验动物的生活质量和动物实验能否顺利完成。骨科基础研究中常见利用犬、啮齿类和兔等小动物进行建模[1-4]。山羊作为体型较大动物,其椎体形状、大小及数目与人类的椎体比较相近[5,6],所以更适合应用于脊柱外科研究中,但多见于颈椎病方面的建模,腰椎疾病方面应用较少[7-12]。研究中,我们发现实验山羊围手术期的管理原则与骨科临床患者围手术期管理原则基本相似,但山羊作为偶蹄目实验动物有其生活、生理的特殊性,不适合于完全照搬临床患者围手术期的管理方法。本课题组在2016年8月至2018年2月期间,利用山羊为动物模型共计实施17例腰椎手术,在山羊的围手术期管理方面不断进行总结、吸取教训,现归纳分析如下。
1 术前实验动物基本情况评估
准备实验时,提前10天左右将山羊购进实验室(由河北省实验动物中心提供),进行实验前的环境适应性喂养。为了保证实验动物和动物实验的质量,在实验山羊的选取、购进和日常饲养管理中应以国际、国内相关管理标准为准绳[13-15]。并对所购进的每一只山羊建立实验档案。
1.1 基本信息评估及B超检测
基本信息包括品系来源(出生地)、年龄、性别、体重、毛色、羊角形状以及孕育情况等进行记录。山羊性情温顺,体型中等,易于饲养。本研究所用实验羊年龄为1.5岁,这个时间段正直山羊性成熟时期,所以应留意观察山羊是否怀孕,避免选取妊娠期的山羊,以选取“未孕未育”山羊为好。鉴于此,本课题在购进山羊后即对其下腹部行 B超检测,以排除山羊怀孕的可能。
1.2 健康状况评估
山羊健康状况主要以性情活泼、好动、叫声洪亮、精神饱满、皮毛发亮且顺滑、羊角粗壮等外观特征来大体判断。进一步通过山羊的进食状态和粪便来判断其健康状况,健康山羊主动取食、反刍状况良好,粪便湿润的球形。本研究所选取山羊体重在23.5 kg~37.5 kg之间,平均28.5 kg。对于脊柱外科手术的山羊动物模型应避免过胖或过瘦的体型,体重过重则容易导致手术切口易发生脂肪液化,进一步导致感染,影响切口正常愈合;体重过轻则抵抗力相对较弱,术中麻醉的耐受性相对偏低,影响术后恢复[16]。
2 术前准备
2.1 备血
羊血约占其活体重的7.6%~8.4%,成年时每千克体重血量为70.0 mL[17,18]。术前一周根据山羊体重对其抽血、备血。本研究中通过颈静脉抽血,平均重量为99.08 g。将血液存储于加有抗凝剂的血袋中即刻于冰箱冷藏,以备术中使用(见图1)。我们统计了自体血回输组和未输血组山羊的输血量、苏醒时间和取食饮水时间,数据显示自体血回输组山羊术后第二天山羊在饲养处内即可自由跑跳、喜取食和饮水,相对于术中未进行自体血回输的山羊,其生理功能和反应灵敏度均恢复较快(见表1)。这是本课题组实验方法创新点之一。山羊于术前24小时开始禁食、术前12小时禁饮水。同时,本课题组试验发现,为了让实验羊保持一个相对平衡体液环境,术前6小时可让其饮用淡盐水250 mL~500 mL。
2.2 术区备皮
术前1天对山羊腰背及骶髂部进行备皮,同时剃除耳廓外部被覆羊毛以显露耳缘静脉置留置针,建立输液通路以便术中补液;剃除额头处和双后肢、双臀部分羊毛以显露肌肉,便于术中肌电检测时电极的安放。术中利用动物用心电监护仪进行监测。备皮区域不宜偏大,否则可能会引起皮肤继发性创伤,影响术后恢复。因为山羊皮毛较为丰富,且在寒冷的秋冬季节,山羊在表皮层会生长出绒毛,增加了备皮的难度。经反复尝试和摸索,我们先用电动剃毛器褪去表层的皮毛,再选用“一次性使用备皮膏”(吉林天淇峻业)轻涂于皮肤表面,静置反应10分钟,利用无纺布擦去备皮膏,术区皮肤即刻光滑无绒毛附属物,即可进行下一步操作。
3 术中护理
3.1 麻醉方法
术前称重,术前半小时静脉注射阿托品0.5 mg,盐酸赛拉嗪 (陆眠宁)(吉林省华牧动物保健品有限公司出产),按使用说明书0.1mL/kg,用0.9%氯化钠注射液稀释成10%浓度后缓慢静注,观察羊反应,静注约16 mL后,羊眼睛半闭、四肢无力、呼吸浅快、流涎、角膜反射消失,停止给药,安放体位,准备手术。术中切皮前辅以局麻,将盐酸利多卡因注射液0.2g和甲磺酸罗哌卡因注射液178.8 mg稀释于20 mL浓度0.9%氯化钠注射液中,进行局部浸润麻醉,以减少陆眠宁用量,增加手术安全性。
3.2 气管插管与山羊手术体位摆放
气管插管、全身麻醉。喉镜配备6种型号齐全的镜片、7.0号普通气管导管、37号双腔气管导管、口咽通气道、开口器、胶布、绷带、牙垫、简易呼吸机。将羊仰卧位、头悬空、尽量后仰,选用3号直喉镜片,左手持喉镜提起会厌暴露声门,能清晰的看到声门随呼吸开合。右手持7.0号普通气管导管顺势插入气管,判断其插入气管内,深度26 cm~28 cm,套囊内注入2 mL气体,胶布固定。术中脉氧饱和度监测。将山羊俯卧于特制大型动物实验手术床上,身体两侧辅以体位垫固定,可以准备开始手术(见图2)。

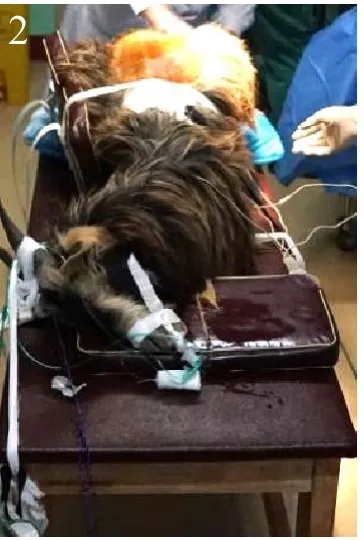
图2,动物手术体位摆放。

表1 自体血回输组和未输血组术后恢复情况比较
3.3 神经电生理检测
M.O’Brien等指出利用大鼠、小鼠和家兔等小动物模型揭示骨性关节炎疼痛的机制时,体内神经电生理检测是判断和评估神经元活动信号通路的有效方法[19]。本研究中创新性地将神经电生理技术应用至山羊腰椎手术模型中。具体方法为采用Nicolet Endevcr 16通道术中神经电生理监测仪行术中神经电生理监测,均采用MEP+EMG联合监测模式(见图3)。此检测用于观察手术操作对神经根和脊髓(运动传导)的影响,判断术后神经功能和羊的肢体活动功能。MEP检测方法:应用针电极经颅电刺激运动皮层区,相对于人脑脑电图国际10-20系统的C1和C2,互为正负电极,记录点可选前腿、左后腿、右后腿上下各两块肌肉。刺激电量为100mA~340mA。前腿肌肉MEP作为参照,观察麻醉深度对MEP的影响。选择合适电量,单个刺激皮层运动区,左右刺激至少两次,保存。术中观察MEP波幅,如果MEP波幅与前一次MEP波幅比降低≥50%,甚至消失即为异常。自由EMG监测神经根功能。即监测支配后腿肌肉的神经根功能状态。术中如刺激到脊髓前角或神经根,根据刺激强度、直接或间接刺激及神经根损伤,会出现单个或连续的高频爆发式动作电位。
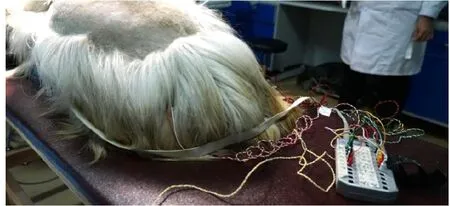
图3,术中神经电生理监测。
本研究中,所有实验山羊术后四肢活动均正常。因此,利用山羊动物模型开展腰椎融合手术时神经电生理检测对于术者对动物手术精细操作的把控具有重要意义。
典型病例:山羊,雌性,1.5岁,行腰椎后路减压椎间植骨融合单侧内固定术,其中L3-4和L5-6分别不同植骨材料。
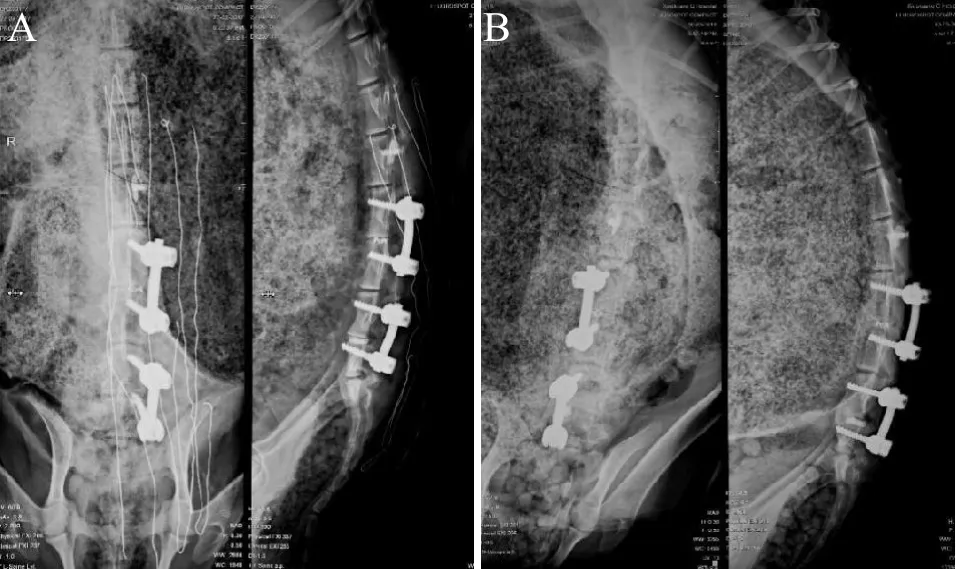
4 术后护理
4.1 术后影像学检查
术后即刻对实验山羊行X线腰椎正侧位、薄层CT检测,着重观察椎间隙和内植物情况。需要注意的是,由于山羊在进行影像学检查时仍处于麻醉状态,在做 X线正位检查时,需要人为控制山羊体位,故实验人员应穿戴防护衣进行操作,以防辐射。
4.2 麻醉恢复
调节动物房温度为25℃~27℃,使山羊侧卧位躺于干净棉垫上,棉垫下以稳定的木制床板支撑,床板距离地面约5cm~10 cm,应避免山羊身体直接与地面接触,给实验动物提供一个干燥、洁净的术后恢复环境是必要的。同时每隔1小时应观察山羊苏醒情况,在山羊四肢能自主活动和完全苏醒后将气管插管拔出。术后苏醒后至次日的夜间期间应禁食水,避免山羊呕吐现象发生。
4.3 抗感染护理
为保证能量供给,通过术中建立的静脉通道于术后前两天给予补液(0.9%氯化钠注射液、5%葡萄糖注射液、复方氨基酸注射液17AA-I各250mL),同时术后连续3天应用抗生素治疗(注射用头孢曲松钠)1 g/天。每天早晚观察手术切口情况,第三天拨出引流条,给予换药。本研究中,所有山羊均未出现术后切口感染现象。
除上述术后护理措施外,术后第四天应加强饮食管理,每天同时投放牛羊饲喂用苜蓿玉米淀粉颗粒饲料和玉米秸秆混合花生秧干草粗饲料,给其补给全面营养。每天同时保证实验山羊一定的活动量,促进其胃肠蠕动、食物吸收。
综上所述,腰椎融合手术山羊模型的围手术期管理涉及到术前准备、术中手术实施和术后生理功能恢复的各个细节。基于此,在设计动物实验的手术方案时就要求术者和所有实验参与人员对实验步骤熟练掌握,并对可预见的实验问题做出应急预案,确保生物安全和环境安全,同时在处理实验问题的过程中及时总结经验教训,不断提高对实验动物围手术期的护理水平、保证其生活质量和动物福利,提升动物实验的质量和效率。

