沉默纤维介素2基因表达对急性坏死性胰腺炎小鼠的治疗作用
邵利梅 叶晓华 丁进
纤维介素2(fibrinogen-like protein 2, FGL2)为纤维蛋白原超家族成员,在体内存在两种形式,即膜型FGL2(mFGL2)和分泌型FGL2(sFGL2),mFGL2具有凝血酶原酶活性,可通过介导各脏器内微血栓的形成引起器官损伤,sFGL2是T细胞的效应分子,发挥免疫调节活性,防止组织损伤[1]。Xi等[2]报道,沉默MHV-3诱导的暴发性肝炎小鼠的FGL2基因表达可减轻肝细胞的坏死和凋亡。叶晓华[3]报道,急性坏死性胰腺炎(acute necrotic pancreatitis, ANP)大鼠胰腺组织FGL2 表达升高,且与细胞凋亡密切相关。故本研究构建携带靶向FGL2的小干扰RNA(small interfering RNA, siRNA)的腺病毒(Ad-FGL2-siRNA) ,探讨FGL2在ANP小鼠胰腺细胞凋亡中的作用及机制。
材料与方法
一、材料及试剂
健康SPF级雄性C57/BL小鼠由上海实验动物研究中心提供。饲养在安静、恒温恒湿、12 h自然光照与黑暗交替、食水持续供给的环境中,所有操作均遵守浙江大学金华医院动物保护条例。牛磺胆酸钠购自美国Sigma公司,ELISA试剂盒购自北京四正柏生物科技有限公司,SYBR Green Master Mix购自美国Life technologies公司,FGL2抗体购自美国Santa Cruz公司,EnVision试剂盒购自丹麦Dako公司,TUNEL凋亡试剂盒购自瑞士Roche公司。
二、动物分组及模型制备
实验前动物禁食12 h,不禁水。采用腹腔内注射10%水合氯醛(2 ml/kg体重)麻醉,将小鼠分为对照组、ANP组、Ad-FGL2-siRNA组,每组6只。对照组开腹轻翻动胰腺组织后关腹;ANP组采用胰胆管逆行注射4%牛磺胆酸钠溶液(1 ml/kg体重)方法诱导ANP模型;Ad-FGL2-siRNA组在造模前经尾静脉注射0.5 ml 4×108pfu/ml的Ad-FGL2-siRNA。对照组及ANP组经尾静脉注射等剂量不携带Ad-FGL2-siRNA的腺病毒。术后6 h处死小鼠,抽取下腔静脉血0.5 ml,分离血清,置-20℃冰箱保存;取胰腺组织标本,部分置于4%多聚甲醛保存,部分经液氮速冻后置-80C°冰箱保存。
Ad-FGL2-siRNA由上海锐赛生物科技有限公司设计并构建。靶向FGL2的siRNA正向序列为5′-TGCTGTTCTTTGAGCACCTCCTCCATGTTTTGGCCA-CTGACTGACATGGAGGATGCTCAAAGAA-3′,反向序列为5′-CCTGTTCTTTGAGCATCCTCCATGTCAGTCAGTGGCCAAAACATGGAGGAGGTGCTCAAAGAAC-3′。
三、胰腺组织病理学检查
取固定的胰腺组织常规行病理学检查。光镜下随机选取10个视野,根据Schmidt等[4]的标准对胰腺损伤的水肿、出血、腺泡细胞变性和间质炎症进行评分。
四、血清TNF-α和IL-1β水平检测
采用ELISA法测定血清TNF-α和IL-1β水平,按试剂盒说明书操作。根据标准品的A450值绘制标准曲线,获取二元方程式,计算待测标本的TNF-α和IL-1β水平。
五、胰腺组织FGL2 mRNA及蛋白表达检测
应用Trizol法提取胰腺组织RNA,反转录成cDNA后应用美国ABI 7500型实时荧光定量PCR仪进行扩增。FGL2正义引物序列为5′-TGCCTTGCGTTTCAGTCG-3′,反义引物序列为5′-AATCCCATTACGGACACCTTT-3′。内参β-actin正义引物序列为5′-CCTGGAGAAACCTGCCAAGTA-3′,反义引物序列为5′-TCATACCAGGAAATGAGCTTGAC-3′。每个样本做3个复孔,以双蒸水代替cDNA模板作为空白对照。应用公式2-ΔΔCt计算FGL2 mRNA表达量。
应用RIPA裂解液提取速冻胰腺组织的总蛋白,使用BCA法定量蛋白后常规行蛋白质印迹法检测FGL2蛋白,以β-actin作为内参。FGL2一抗工作浓度1∶200,最后ECL发光,X片曝光、显影、定影。采用Image J软件进行条带扫描,以目的条带与内参条带的灰度值比表示蛋白相对表达量。
同时,取固定的胰腺组织,常规制备切片,采用免疫组织化学法检测FGL2蛋白表达,以BSA代替一抗作为对照,依据EnVision试剂盒说明书操作。FGL2一抗工作浓度1∶50,辣根过氧化物酶标记的二抗工作浓度1∶1 000,最后DAB 显色剂显色,苏木素复染。以胞质染为淡黄色至棕褐色为阳性细胞标志,主要浸润于微血管的内皮细胞和间质组织。在200倍光镜下随机选取10个不同视野,阳性细胞率为阳性细胞数/总细胞数×100%,取均值。
六、胰腺组织细胞凋亡检测
采用末端脱氧核苷酸转移酶(terminal deoxynu-cleotidyl transferase,TdT)介导dUTP缺口末端标记法检测胰腺组织细胞凋亡,按试剂盒说明书操作。用标准的荧光过滤装置在(520±20)nm的荧光下观察,绿色荧光为凋亡细胞,镜下计数凋亡细胞。
七、统计学处理
结 果
一、各组小鼠胰腺组织的病理学改变
对照组胰腺组织学形态保持正常,ANP组的胰腺组织表现为水肿、出血、腺泡欠完整和炎症细胞浸润,Ad-FGL2-siRNA组胰腺组织的病理损伤较ANP组明显减轻(图1)。对照组、ANP组、Ad-FGL2-siRNA组小鼠胰腺组织的病理评分分别为(1.33±0.21)、(9.17±0.98)、(6.26±0.52)分,ANP组较对照组显著升高,Ad-FGL2-siRNA组较ANP组显著下降,但仍显著高于对照组,差异均有统计学意义(P值均<0.05)。
二、各组小鼠血清 TNF-α、IL-1β水平变化
对照组、ANP组、Ad-FGL2-siRNA组小鼠血清TNF-α 水平分别为(63.8±4.2)、(240.4±18.6)、(123.0±10.3)ng/L;IL-1β水平分别为(43.6±4.4)、(186.6±18.7)、(92.0±10.9)ng/L。ANP组较对照组显著增高,Ad-FGL2-siRNA组较ANP组显著下降,但仍显著高于对照组,差异均有统计学意义(P值均<0.05)。
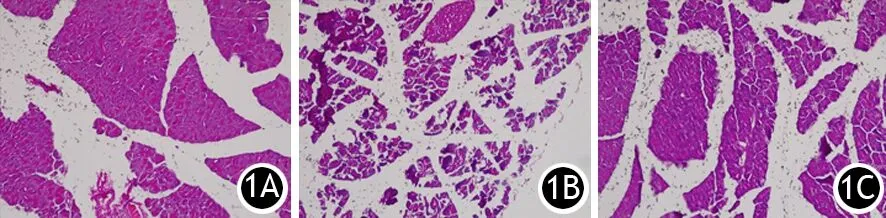
图1 对照组(1A)、ANP组(1B)、Ad-FGL2-siRNA组(1C)小鼠胰腺组织病理学改变(HE ×200)
三、各组小鼠胰腺组织FGL2mRNA及蛋白表达变化
对照组、ANP组、Ad-FGL2-siRNA组小鼠胰腺组织FGL2 mRNA相对表达量分别为1.20±0.22、4.40±1.21、2.15±0.56,ANP组较对照组显著增高,Ad-FGL2-siRNA组较ANP组显著下降,差异均有统计学意义(P值均<0.05),而Ad-FGL2-siRNA组FGL2 mRNA表达量虽高于对照组,但差异无统计学意义。
对照组、ANP组、Ad-FGL2-siRNA组小鼠胰腺组织FGL2蛋白相对表达量分别为0.33±0.08、1.23±0.24、0.68±0.09(图2),FGL2阳性细胞率为(2.56±0.31)%、(15.10±3.23)%、(8.68±1.81)%(图3),ANP组均较对照组显著增加,Ad-FGL2-siRNA组均较ANP组显著减少,但仍显著高于对照组,差异均有统计学意义(P值均<0.05)。
四、各组小鼠胰腺组织细胞凋亡数
对照组、ANP组、Ad-FGL2-siRNA组小鼠胰腺组织内细胞凋亡数分别为(4.51±1.21)、(35.81±4.11)、(11.79±3.02)个/200倍视野,ANP组、Ad-FGL2-siRNA组显著多于对照组,Ad-FGL2-siRNA组又较ANP组显著减少,差异均有统计学意义(P值均<0.05)。

图2 对照组(1)、ANP组(2)、Ad-FGL2-siRNA组(3)FGL2蛋白表达(蛋白质印迹法)

图3 对照组(3A)、ANP组(3B)、Ad-FGL2-siRNA组(3C)FGL2蛋白表达(免疫组织化学染色 ×200)
讨 论
ANP早期很多因素可引起胰腺腺泡细胞的损伤或死亡,腺泡细胞坏死会提高胰腺细胞内的胰蛋白酶活性,释放多种炎症因子,激活炎症级联反应,而坏死-凋亡转变机制在病情的严重程度方面起了极大的作用[5-7]。针对重症急性胰腺炎(SAP)的免疫细胞的成熟、凋亡、分化等进行调控,是近几年来ANP治疗领域的方向之一[8]。FGL2属于纤维蛋白原家族,由活化的巨噬细胞和内皮细胞表达,能催化凝血酶原转化为凝血酶,启动凝血过程。FGL2可参与ANP大鼠微血栓形成,促进了SAP的发生与发展[3,9]。本课题组既往的研究表明,FGL2在ANP动物模型及SAP患者外周血高表达,引起ANP相关性肝损伤的肝细胞微血栓形成[10],并与一些其他疾病的细胞凋亡密切相关。腺病毒介导的微小RNA靶向调节mfgl2、mFas和mTNFR1,能明显改善爆发性肝衰竭的肝细胞坏死和凋亡[2];进一步研究表明IL-33通过靶向FGL2保护重症病毒性肝炎小鼠[11];此外,沉默FGL2也可抑制心肌细胞的凋亡,改善糖尿病大鼠的心功能[12]。但FGL2对ANP细胞凋亡及疾病进展的作用尚不清楚。
复制缺陷型腺病毒是最先进、研究最好的载体系统之一,可高水平表达外源基因[13],既往实验表明Ad-FGL2-siRNA对体外靶基因有明确的抑制作用[2]。本研究首次在ANP小鼠模型中通过Ad-FGL2-siRNA沉默FGL2基因来研究其作用,结果表明,FGL2基因沉默可显著缓解ANP的胰腺病理学损伤,减少胰腺组织的水肿、出血、腺泡破坏和炎症细胞浸润,提示了FGL2基因沉默对ANP的保护作用。此外,免疫细胞, 特别是与先天免疫相关的炎症细胞(包括中性粒细胞、 巨噬细胞等),它们介导并放大了级联样的促炎反应,决定着ANP的严重程度[14]。研究显示,在ANP病程的不同时期,通过促进或抑制中性粒细胞及CD4+T细胞的凋亡,可减轻早期ANP炎性应答,缓解ANP症状[15-16]。本研究结果显示,Ad-FGL2-siRNA显著下调了促炎症细胞因子TNF-α和IL-1β水平,这对阻止局部组织损伤发展为系统炎症反应起到了关键作用[9],促炎细胞因子的下调也与上述胰腺病理学损伤的缓解相一致。本研究结果还显示,Ad-FGL2-siRNA在ANP早期抑制了腺泡细胞的凋亡,这与上述沉默FGL2可抑制其他系统疾病的细胞凋亡结论相一致[2]。综上所述,FGL2可能参与了小鼠ANP的发生发展,沉默FGL2基因表达,可抑制炎症细胞的聚集和浸润,抑制腺泡细胞的凋亡,从而对ANP早期起到一种保护作用。

