病毒性心肌炎患儿外周血中微小RNA-98的表达及其对凋亡相关蛋白/凋亡相关蛋白配体表达的影响
吕爱婷,冯迎军,孙琪青,候维纳
(郑州大学附属儿童医院血管内科,河南 郑州 450000)
病毒性心肌炎(viral myocarditis,VM)是临床常见心血管疾病,在所有年龄段中均有发病,在儿童以及青少年中发病率最高[1]。有调查显示,近年来VM发病年龄呈下降趋势,严重影响患者生活质量[2]。部分患儿症状较严重,可进一步发展为扩张型心肌病、心律失常等,预后不良。目前,关于VM的发病机制尚无统一定论,其发生与多种因素有关。有研究显示,凋亡相关蛋白(factor associated suicide,Fas)/凋亡相关蛋白配体(factor associated suicide ligand,FasL)诱导细胞凋亡是心肌损伤的重要机制[3]。近年来较多研究发现,微小RNA(micro RNA,miR)与细胞增殖、分化、凋亡、氧化应激有关,能够特异结合靶基因3′非翻译区进而调控基因的表达。关于miR-98在心肌梗死、哮喘等疾病中的作用均有研究,其表达水平的异常与疾病的发生密切相关,但在VM中的研究较少[4]。本研究通过检测VM患儿外周血中miR-98的表达,分析其与Fas/FasL的关系,探究VM的发生机制,并通过细胞实验进一步验证miR-98在VM发病中的作用。
1 资料与方法
1.1一般资料选择2015年9月至2017年7月郑州大学附属儿童医院收治的VM患儿62例作为研究对象(VM组),病程1~3(1.04±0.23)个月,患儿均符合VM诊断标准[5]。病例纳入标准:年龄≤12岁;患儿监护人知情同意。排除标准:患有肺、肾、肝以及血液系统等原发性疾病;扩张型心肌病患儿;近1个月内服用阿奇霉素等。根据左心室射血分数(left ventricular ejection fraction,LVEF)及心肌肌钙蛋白(cardiac troponinI,cTnI)水平,将VM组患儿分为轻度组(EF≥50%,cTnI<0.1 μg·L-1或正常)和重度组(EF<50%,cTnI>0.2 μg·L-1或正常)。轻度组38例,男20例,女18例;年龄 1~12(5.42±1.16)岁;重度组24例,男14例,女10例;年龄 1~12(5.69±1.34)岁。另选取同期体检健康的56例儿童作为对照组,其中男30例,女26例;年龄3~11(5.14±0.93)岁。3组受试者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会批准。
1.2血液样本收集所有研究对象在清晨空腹状态下于肘部曲侧采集静脉血3 mL,3 000 r·min-1离心10 min,取血清,置于-20 ℃冰箱保存。
1.3主要试剂与仪器人心肌细胞(human cardiac myocytes,HCM)购自美国Sciencell公司,H9C2心肌细胞来源于乳鼠胚胎期心肌组织,RNA提取试剂盒购于日本TaKaRa公司,RNA反转录试剂盒购于美国Thermo Fisher Scientific公司,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、TBST缓冲液购于美国BD公司,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、二甲基亚枫(dimethyl sulfoxide,DMSO)、碘化丙啶(propidium iodide,PI)购于美国Sigma公司;实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪购于美国Bio-Rad公司。
1.4实验方法
1.4.1qRT-PCR检测3组受试者外周血中miR-98及Fas、FasLmRNA表达采用RNA提取试剂盒提取3组受试者外周血总RNA,将RNA反转录为cDNA。Fas上游引物序列为5′-AAAAACTGGGGCTGCCCTTA-3′,下游引物序列为5′-CTTTGTGGGGGATGGAACAA-3′;FasL上游引物序列为5′-ACTACCGCCACCACCTCTGA-3′,下游引物序列为5′-GGCCACCAGAACCATGAAAA-3′。miR-98上游引物序列为5′-CGGCTGAGGTAGTAGATTGT-3′,下游引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTC-3′。β-actin上游引物序列为5′-GAGGGAAATCGTGCGTGAC-3′,下游引物序列为5′-CTGGAAGGTGGACAGTGAG-3′。U6上游引物序列为5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物序列为5′-CGCTTCACGAATTTGCGTGTCAT-3′。反应体系共20 μL:2×SYBR Green Mix 10 μL,H2O 8 μL,10×cDNA模板1 μL,上下游引物各 0.5 μL。反应程序为:95 ℃变性5 min,95 ℃ 15 s、60 ℃ 20 s,72 ℃ 1 min,35个循环,72 ℃延伸10 min。以U6作为内参基因在CFX manager 软件上按照2-ΔΔCt算法分析miR-98相对表达量,以β-actin作为内参基因分析Fas、FasL mRNA相对表达量。
1.4.2Westernblot检测3组受试者外周血中Fas、FasL蛋白表达在外周血中加入蛋白裂解液放置冰上反应30 min,离心后收集上清提取总蛋白,BCA试剂盒测定蛋白浓度,分别制备体积分数8.0%、12.5%的分离胶与浓缩胶,统一上样30 μg蛋白,蛋白样品进入浓缩胶时电压为80 V,进入分离胶后,电压升高至120 V,电泳结束后切除目的条带蛋白凝胶并转移至PVDF膜上,置于冰上进行转膜反应,电压设置为100 V,反应时间为1 h,加入TBST清洗3次,加入体积分数5%脱脂牛奶封闭 1 h,TBST清洗后加入Fas、FasL一抗稀释液(1500),4 ℃震荡过夜,TBST清洗3次,加入二抗稀释液(110 000),室温下孵育2 h,TBST清洗后在凝胶成像仪中观察蛋白表达情况。
1.4.3细胞分组及处理HCM、H9C2心肌细胞在含有体积分数10%胎牛血清的达尔伯克改良伊格尔培养基中于37 ℃、体积分数5%CO2培养箱内进行培养。取对数生长期HCM、H9C2心肌细胞接种至35 mm培养皿,当细胞生长至培养皿底面积80%时进行分组。将细胞分为空白组、阴性转染组和miR-98 转染组,空白组细胞不做任何处理,阴性转染组细胞转染阴性对照小干扰RNA(small interfering RNA,siRNA)(序列为5′-CAGUACUUUUGUGUAGUACAA-3′),miR-98转染组细胞转染miR-98 siRNA(序列为5′-AACAAUACAACUUACUACCUCA-3′)。转染后室温静置20 min,加入细胞培养瓶中,置于 37 ℃、体积分数5%CO2培养箱中培养48 h。
1.4.4MTT法检测HCM、H9C2心肌细胞增殖情况收集转染后培养48 h的各组细胞,调整细胞密度为1×107L-1接种至细胞培养板,置于37 ℃、体积分数5%CO2培养箱中分别培养12、24、48、72 h,培养结束后加入10 μL MTT孵育4 h,加入100 μL DMSO溶液,在570 nm处测吸光度。细胞抑制率=(转染组吸光度-空白吸光度)/空白吸光度×100%。
1.4.5HCM、H9C2心肌细胞中miR-98及Fas、FasL蛋白表达参照“1.4.1、1.4.2项”检测miR-98及Fas、FasL蛋白表达的方法进行操作。
1.4.6平板细胞克隆形成实验检测HCM、H9C2心肌细胞克隆形成能力将转染后培养48 h的细胞置于培养皿中培养7 d后,加入固定剂(甲硫醇冰醋酸=71)反应15 min,随后加入含质量分数0.1%结晶紫的体积分数20%甲醇溶液染色 25 min,拍照并计算细胞克隆数量。以直径大于 50 μm作为1个克隆。
1.4.7流式细胞仪检测HCM、H9C2心肌细胞凋亡情况收集转染后培养48 h的HCM、H9C2心肌细胞,加入2.5 g·L-1胰蛋白酶消化细胞,收集细胞后采用预冷磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗,加入体积分数70%乙醇溶液固定1 h,PBS清洗细胞后,空白组加100 μL DMSO溶液,miR-98转染组、阴性转染组加100 μL DMSO和20 μL PI,37 ℃避光反应20 min,流式细胞仪检测细胞凋亡情况。
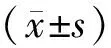
2 结果
2.1VM组和对照组儿童外周血中miR-98及Fas、FasLmRNA表达结果见表1。VM组患儿外周血中miR-98相对表达量低于对照组,Fas、FasL mRNA表达量高于对照组,差异均有统计学意义(P<0.05)。重度组患儿外周血中miR-98相对表达量低于轻度组,Fas、FasL mRNA相对表达量高于轻度组,差异均有统计学意义(P<0.05)。
2.2VM组和对照组儿童外周血中Fas、FasL蛋白表达情况结果见图1、图2、表2。VM组患儿外周血中Fas、FasL蛋白相对表达量高于对照组,差异有统计学意义(P<0.05)。重度组患儿外周血中Fas、FasL蛋白相对表达量高于轻度组,差异有统计学意义(P<0.05)。
表1VM组和对照组儿童外周血中miR-98及Fas、FasLmRNA表达比较
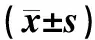

组别nmiR-98Fas mRNAFasL mRNA对照组561.00±0.161.08±0.071.00±0.06VM组620.59±0.08a1.34±0.21a1.52±0.18a 轻度组240.67±0.121.18±0.131.12±0.17 重度组380.46±0.06b1.63±0.27b1.77±0.26b
注:与对照组比较aP<0.05;与轻度组比较bP<0.05。
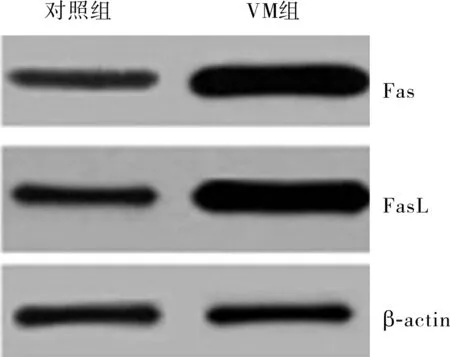
图1VM组和对照组儿童外周血中Fas和FasL蛋白表达(Westernblot)
Fig.1ExpressionofFasandFasLproteininperipheralbloodofchildrenintheVMgroupandcontrolgroup(Westernblot)

图2轻度组和重度组患儿外周血中Fas及FasL蛋白表达(Westernblot)
Fig.2ExpressionofFasandFasLproteininperipheralbloodofchildreninthemildgroupandseveregroup(Westernblot)
表2VM组和对照组儿童外周血中Fas及FasL蛋白表达比较
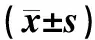

组别nFas蛋白FasL蛋白对照组561.00±0.091.00±0.13VM组621.46±0.18a1.52±0.14a 轻度组241.13±0.161.18±0.09 重度组381.67±0.28b1.71±0.23b
注:与对照组比较aP<0.05;与轻度组比较bP<0.05。
2.3VM患儿外周血miR-98与Fas、FasL蛋白表达的相关性Pearson相关性分析结果显示,VM患儿外周血miR-98与Fas、FasL均呈显著负相关(r=-516、-463,P<0.05);见图3。

图3VM患儿外周血miR-98与Fas、FasL的相关性
Fig.3CorrelationbetweenmiR-98andFas,FasLinperipheralbloodofVMpatients
2.4转染后HCM、H9C2心肌细胞克隆形成情况结果见图4和表3。miR-98转染组HCM、H9C2心肌细胞克隆数量低于空白组和阴性转染组,差异均有统计学意义(P<0.05)。
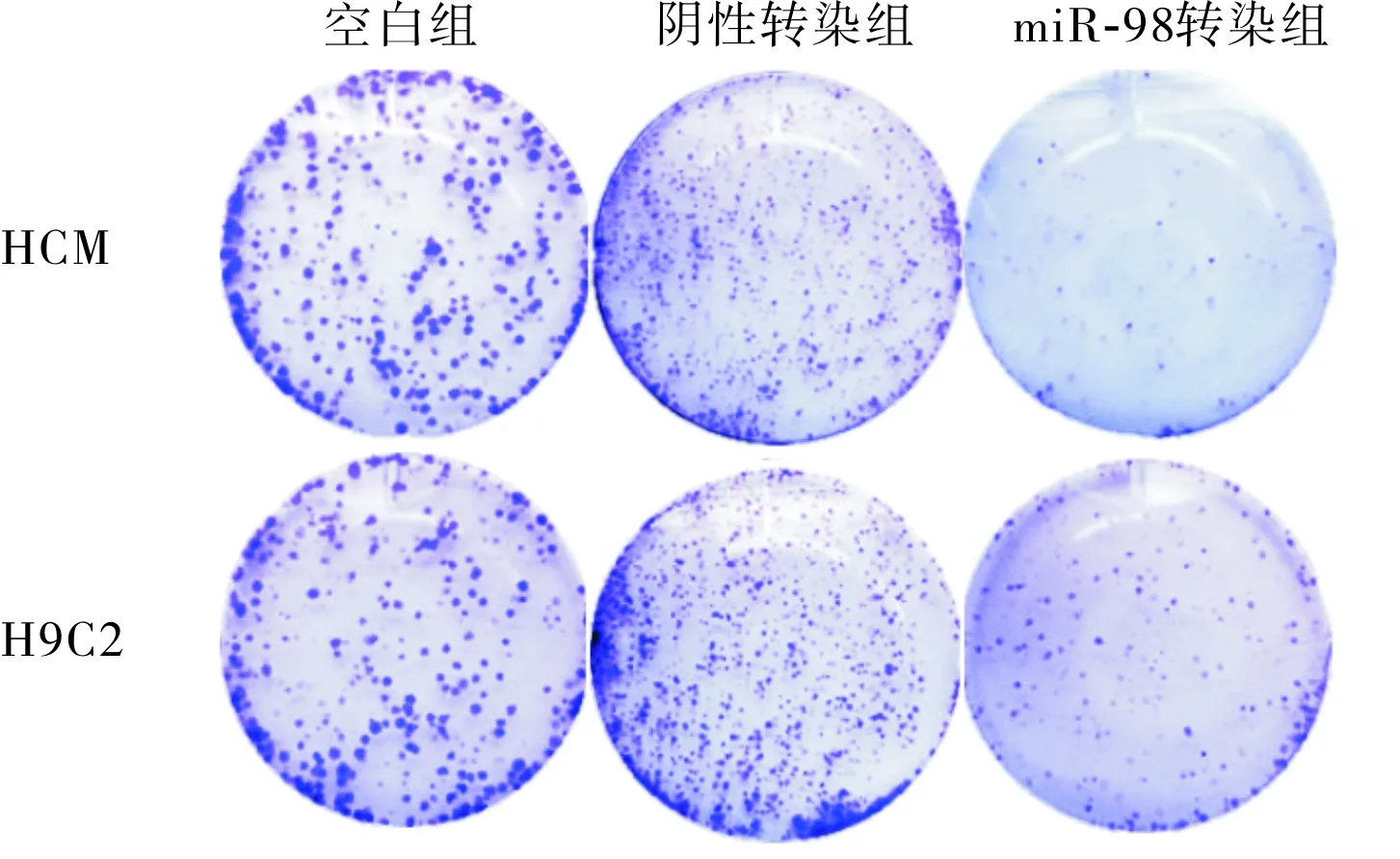
图4各组HCM、H9C2心肌细胞克隆形成情况
Fig.4ColonyformationofHCMandH9C2cardiaccellsineachgroup
表3各组HCM和H9C2心肌细胞克隆数量比较
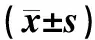

组别克隆数量/个HCM细胞H9C2细胞空白组81.26±15.4784.53±13.79阴性转染组87.26±17.2388.41±14.07miR-98转染组23.48±5.13a26.72±5.62a
注:与空白组和阴性转染组比较aP<0.05。
2.5各组HCM、H9C2心肌细胞增殖情况结果见表4。随着培养时间延长,miR-98转染组HCM、H9C2心肌细胞抑制率逐渐升高。miR-98转染组HCM、H9C2心肌细胞抑制率在各时间点均高于空白组和阴性转染组,差异有统计学意义(P<0.05)。
2.6各组HCM、H9C2心肌细胞中miR-98及Fas、FasL蛋白表达结果见表5、表6和图5。miR-98转染组心肌细胞中miR-98相对表达量低于空白组和阴性转染组,Fas、FasL蛋白相对表达量高于空白组和阴性转染组,差异均有统计学意义(P<0.05)。
表4各组HCM和H9C2心肌细胞抑制率比较
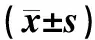
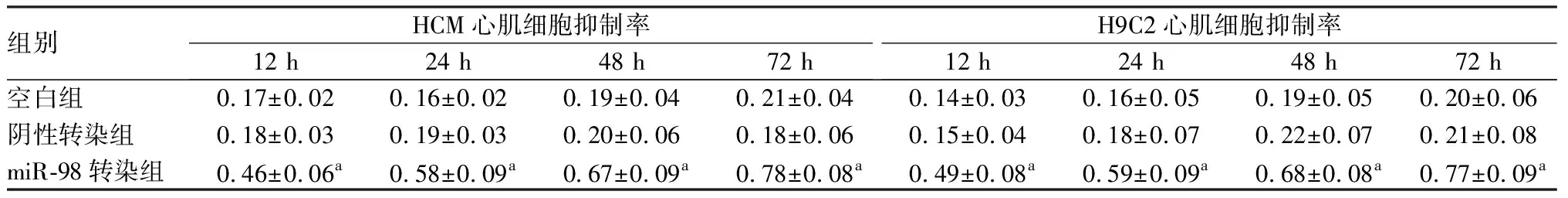
组别HCM心肌细胞抑制率12 h24 h48 h72 hH9C2心肌细胞抑制率12 h24 h48 h72 h空白组0.17±0.020.16±0.020.19±0.040.21±0.040.14±0.030.16±0.050.19±0.050.20±0.06阴性转染组0.18±0.030.19±0.030.20±0.060.18±0.060.15±0.040.18±0.070.22±0.070.21±0.08miR-98转染组0.46±0.06a0.58±0.09a0.67±0.09a0.78±0.08a0.49±0.08a0.59±0.09a0.68±0.08a0.77±0.09a
注:与空白组、阴性转染组比较aP<0.05。
表5各组HCM、H9C2心肌细胞中miR-98表达比较
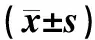
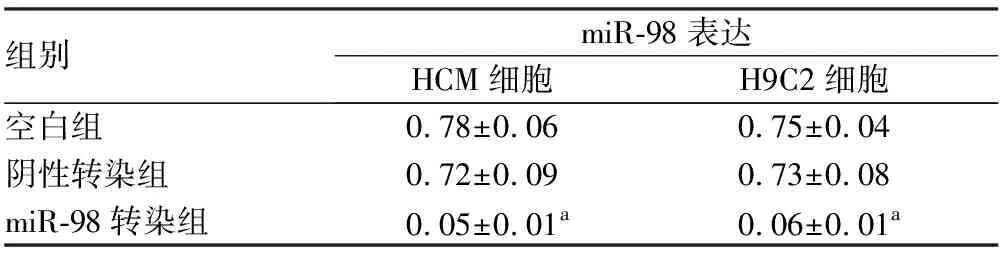
组别miR-98表达HCM细胞H9C2细胞空白组0.78±0.060.75±0.04阴性转染组0.72±0.090.73±0.08miR-98转染组0.05±0.01a0.06±0.01a
注:与空白组和阴性转染组比较aP<0.05。
表6各组HCM和H9C2心肌细胞中Fas、FasL蛋白表达比较
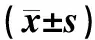

组别HCMFas蛋白表达FasL蛋白表达H9C2Fas蛋白表达FasL蛋白表达空白组0.25±0.030.31±0.040.24±0.040.33±0.05阴性转染组0.31±0.060.33±0.050.41±0.070.45±0.09miR-98转染组0.71±0.18a0.83±0.15a0.79±0.12a0.89±0.13a
注:与空白组和阴性转染组比较aP<0.05。

注:A:空白组;B:阴性转染组;C:miR-98转染组。
图5各组HCM和H9C2心肌细胞中Fas、FasL蛋白表达(Westernblot)
Fig.5ExpressionofFasandFasLproteininHCMandH9C2cardiaccellsineachgroup(Westernblot)
2.7各组HCM、H9C2心肌细胞凋亡情况结果见图6和表7。miR-98转染组细胞凋亡率均高于空白组和阴性转染组,差异有统计学意义(P<0.05)。
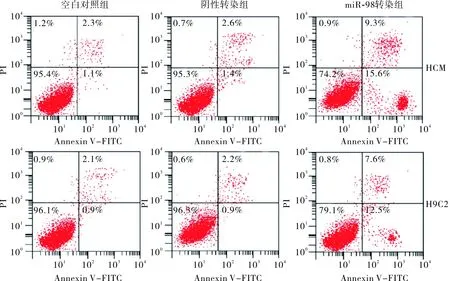
图6各组HCM、H9C2心肌细胞凋亡情况
Fig.6ApoptosisofHCMandH9C2cardiaccellsineachgroup
表7各组HCM、H9C2心肌细胞凋亡率比较
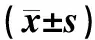
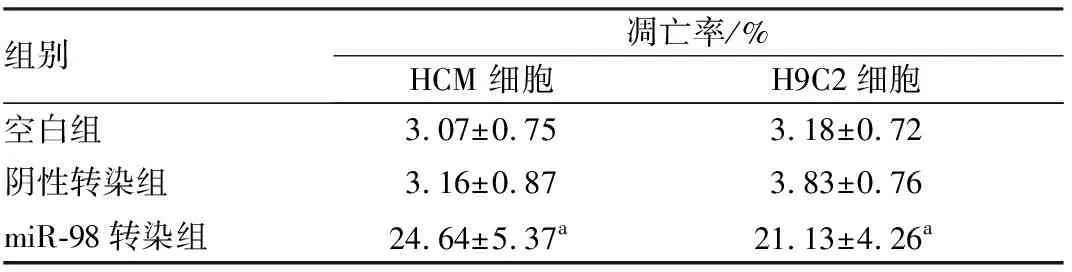
组别凋亡率/%HCM 细胞H9C2细胞空白组3.07±0.753.18±0.72阴性转染组3.16±0.873.83±0.76miR-98转染组24.64±5.37a21.13±4.26a
注:与空白组和阴性转染组比较aP<0.05。
3 讨论
VM是指毒素或病毒攻击心肌细胞后,造成局部性或弥漫性心肌间质发生炎性浸润以及心肌纤维变形、坏死,导致心功能障碍的全身性疾病[6]。部分VM患者首发症状为上腹剧烈疼痛、恶心呕吐,这些临床表现较易掩盖病情,耽误诊断,延误治疗的最佳时机,造成病死率高。关于VM发病机制目前尚无统一定论。研究显示,心血管组织中miR表达上调或下调参与调控心力衰竭、血管增殖、心脏发育、心肌肥大等疾病的发生[7]。有研究证实,Fas/FasL诱导的细胞凋亡在VM的发生、发展中发挥重要作用[8]。本研究通过检测miR-98在VM患儿外周血中的表达,探究其在VM发生中的可能机制。
miR属于单链小分子RNA,能够在转录后水平调控靶基因表达,进而对机体的生长、发育及疾病的发生、发展进行调节。有研究显示,对大鼠心肌细胞进行过氧化氢处理,miR-98表达明显降低,而对细胞进行miR-98过表达处理,则心肌细胞活性明显增强[9]。在健康者以及动脉粥样硬化(atherosclerosis,AS)患者血清中进行miR基因筛选,结果显示,在下调的miR中,miR-98下调幅度最大,说明其下降与AS的发生密切相关[10]。最近有研究报道,VM患者血清中miR-98水平明显降低,这一结果说明miR-98水平的异常与VM的发生有关[11]。本研究结果显示,VM患儿血清中miR-98表达明显低于对照组,且随着病情程度的加重,其水平逐渐降低,说明miR-98与VM的发生、发展有关,与上述结果一致。
Fas、FasL均为细胞跨膜蛋白,Fas主要在心脏、肝脏、淋巴细胞中表达,FasL主要在自然杀伤细胞中表达,当二者结合后,Fas将细胞凋亡信号传递至细胞内,致使细胞凋亡,此外,Fas/FasL介导的细胞毒性,可通过促进自然杀伤细胞凋亡对VM进行调控[12-15]。临床研究显示,VM患者外周血中Fas水平升高后,心肌细胞凋亡率明显增加,表明Fas/FasL诱导的细胞凋亡与VM的发生密切相关[16]。HUANG等[17]研究显示,VM患儿外周血中Fas蛋白的表达明显高于对照组,并且与淋巴细胞的凋亡率呈正相关,提示Fas/FasL介导的淋巴细胞凋亡与VM的发生密切相关。本研究结果显示,VM患儿外周血中Fas、FasL mRNA及蛋白水平均明显升高,且随着病情程度的加重逐渐升高,提示Fas/FasL介导的细胞凋亡可能与VM的发生密切相关。相关性分析结果显示,miR-98与Fas、FasL呈显著负相关,推测二者可能以负调控参与VM的发生。
为验证结论,本研究进一步进行体外细胞实验,结果显示,转染miR-98 siRNA后HCM、H9C2心肌细胞抑制率均明显高于空白组和阴性转染组,细胞克隆形成数量也下降,说明抑制miR-98表达后,心肌细胞活性明显降低。且转染后HCM、H9C2心肌细胞凋亡率明显增加,Fas、FasL蛋白表达明显增加,进一步说明抑制miR-98表达后可引发心肌细胞凋亡,其可能通过Fas/FasL诱导细胞凋亡。有研究显示,miR-98可通过靶向调控Fas/Caspase-3参与心肌细胞凋亡[18]。有研究通过双荧光素酶报告分析法分析miR-98与Fas/FasL靶向关系,结果显示,miR-98可与编码Fas/FasL的3′非翻译区结合,抑制Fas/FasL的表达[19-20]。
综上所述,miR-98在VM患儿外周血中表达水平下降,可能通过调节Fas/FasL在心肌细胞中的表达来调控心肌细胞凋亡,从而参与VM 的发生。

