郑州地区耐多药结核分枝杆菌gyrA和gyrB基因突变特征及对氟喹诺酮类药物耐药研究
梁丽丽,苑 星,刘 新,崔秀琴,高 谦
(1.河南省胸科医院内六科,河南 郑州 450000;2.新乡医学院第一附属医院结核内二科,河南 卫辉 453100;3.复旦大学上海医学院教育部分子病毒学重点实验室,上海 200032)
结核病是威胁全世界的公共卫生问题,是2016年全球九大死亡原因之一,因结核病而死亡的人数居传染病死亡人数之首[1]。耐药结核病是结核病防控的难点和重点,世界卫生组织最新耐药结核病治疗指南建议将氟喹诺酮类(fluoroquinolones,FQs)药物作为抗结核治疗方案的核心药物之一[2]。FQs药物对结核分枝杆菌(Mycobacteriumtuberculosis,MTB)的杀菌机制是作用于由gyrA、gyrB基因编码的2个A亚基和B亚基组成的DNA解旋酶,通过影响DNA复制而产生杀灭MTB的效果,MTB对FQs药物产生耐药的分子机制是gyrA、gyrB基因的氟喹诺酮耐药决定区(quinolone resistance determining region,QRDR)发生突变[3]。但不同的FQs药物及不同地区FQs药物主要的耐药基因及突变位点均不同,本研究旨在了解郑州地区耐多药(multi-drug resistant,MDR)肺结核患者对FQs药物的耐药情况,分析MDR MTB对FQs药物耐药的耐药基因和突变位点,并与药物敏感性试验进行对比,筛选出判断MDR MTB对FQs药物耐药敏感性和特异性更高的耐药基因及位点,以指导临床合理应用FQs药物治疗MDR肺结核。现将结果报道如下。
1 资料与方法
1.1一般资料采用双盲、前瞻性的临床研究方法,收集2015年5月至2016年12月河南省胸科医院收治的肺结核患者256例为研究对象,其中男189例,女67例,年龄18~82(44.1±16.5)岁,均根据中华人民共和国卫生行业标准中肺结核诊断标准确诊[4]。纳入标准:(1)年满18岁;(2)临床确诊肺结核(包括初治和复治患者);(3)愿意在入组时提供足量痰标本;(4)已签署知情同意书。排除标准:无法提供足量痰标本者。本研究在美国临床试验注册网站(clinicaltrials.gov)注册(注册号:NCT02251327)并通过河南省胸科医院伦理委员会批准。
1.2主要试剂与仪器MGIT液体培养管、BACTEC MGITTM960液体培养系统、分枝杆菌药物敏感性试剂盒均购自美国Becton Dickinson公司,罗氏培养基购自珠海贝索生物有限公司,异烟肼(isoniazide,INH)、利福平(rifampicin,RFP)、氧氟沙星(ofloxacin,Ofx)、莫西沙星(moifloxacin,Mfx)、二甲基亚砜(dimethylsulfoxide,DMSO)购自美国Sigma公司,TE缓冲液购自北京索莱宝科技有限公司,2×Taq Master Mix和 DNA纯化试剂盒购自北京天根生化科技有限公司;超低温冰箱(日本三洋公司),聚合酶链式反应(polymerase chain reaction,PCR)仪(杭州博日科技有限公司)。
1.3标本采集及处理所有患者均在入组时留取至少2 mL痰标本。将标本进行MTB固体罗氏培养、液体分枝杆菌培养。培养阳性的MTB菌液分为2个部分,一部分进行药物敏感性试验,另一部分 -80 ℃ 保存备用。所有培养、药物敏感性试验均按相关的标准化程序进行操作[5]。药物敏感性试验中培养基药物终浓度如下:INH 0.4 mg·L-1,RFP 40.0 mg·L-1,Ofx 2.0 mg·L-1,Mfx 0.5 mg·L-1(Mfx 0.5),Mfx 2.0 mg·L-1(Mfx 2.0)。药物敏感性结果判定:耐药百分比(含药培养基上菌落数/对照培养基上菌落数×100%)>1%者为MTB对该抗结核药物耐药。对INH和RFP同时耐药的菌株则为MDR MTB。
1.4MDRMTBDNA模板的制备将药物敏感性试验确定为MDR MTB者所对应的保存菌株从 -80 ℃ 复苏,重新进行液体分枝杆菌培养,从有MDR MTB生长的培养基中取MDR MTB菌落转移至含 1 mL 生理盐水的Eppendorf离心管中,80 ℃ 30 min灭活,12 000 r·min-1离心5 min,弃上清液,将菌体沉淀加入500 μL TE缓冲液充分悬浮,沸水浴 10 min,迅速置冰上2 min,12 000 r·min-1离心 10 min,上清液即为DNA模板溶液。将上清液样本按编号顺序排列,吸取DNA溶液置于8连排管中,每3排的第8个样本设1个阳性对照(已知突变的样本)。
1.5MDRMTB的PCR扩增及测序使用PCR引物扩增MDR MTB的gyrA、gyrB基因。PCR反应体系为50.0 μL,其中2×Taq Master Mix 25.0 μL,引物3.0 μL,DMSO 1.5 μL,DNA模板3.0 μL,蒸馏水 17.5 μL。gyrA引物序列:5′-GGCCGTCGTAGTTAGGGATG-3′,gyrB引物序列:5′-GACGCGAAAGT-CGTTGTGAA-3′。PCR扩增条件为95 ℃预变性2 min,95 ℃变性20 s、54 ℃退火40 s、72 ℃延伸 2 min,共35个循环,72 ℃延伸5 min,12 ℃保存。扩增后的PCR产物均为320个碱基对,送上海桑尼生物科技有限公司进行纯化和测序。
1.6应用基因突变判断MDRMTB对FQs药物耐药的敏感性和特异性应用ClustalW(欧洲生物信息研究所)序列对比软件,将扩增产物的测序结果与标准MTB菌株H37Rv的gyrA和gyrB基因序列进行比对,若与标准MTB菌株序列相同,则gyrA和gyrB基因无突变,即为野生株;若序列不同,则证实gyrA和gyrB基因突变,即为耐药株。记录所有耐药株的突变类型和突变位点,以该菌株的FQs药物敏感性试验结果为金标准,可得出应用gyrA和gyrB基因突变判断MDR MTB对FQs药物耐药的敏感性和特异性。
1.7统计学处理应用SPSS 20.0软件进行分析,计数资料进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1MTB培养阳性者的抗结核药物耐药情况256例患者中,MTB培养阳性215例,其中初治患者80例,复治患者135例;非MDR肺结核患者137例,MDR肺结核患者78例(77例为复治患者,1例为初治患者)。137株非MDR MTB临床分离株中,对FQs药物耐药10株,其中对Ofx耐药10株,对Mfx耐药8株,对Mfx2.0耐药1株。78株MDR MTB临床分离株中,对FQs药物耐药45株,其中对Ofx耐药43株,对Mfx 0.5耐药43株,对Mfx 2.0耐药25株。非MDR MTB临床分离株对Ofx、Mfx 0.5、Mfx 2.0的耐药率显著低于MDR MTB临床分离株(χ2=61.21、66.73、45.87,P<0.001),见表1。
表1215例MTB培养阳性肺结核患者MTB临床分离株药物敏感性试验结果
Tab.1Drugresistanceofphenotypedrugsensitivitytestresultsin215pulmonarytuberculosispatientswithpositiveMTBculture
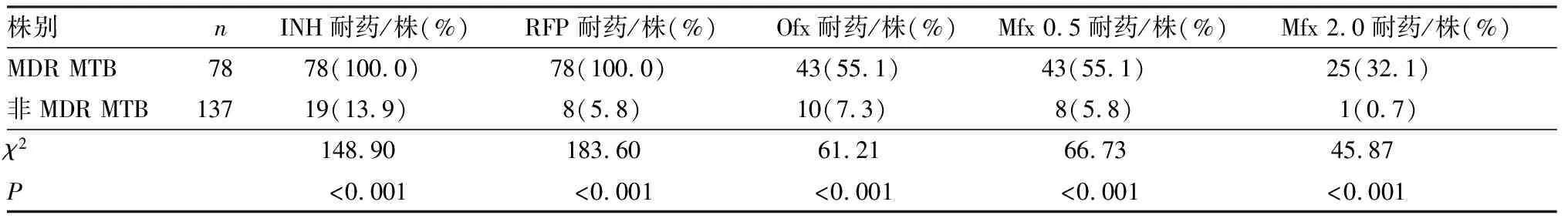
株别nINH耐药/株(%)RFP耐药/株(%)Ofx耐药/株(%)Mfx 0.5耐药/株(%)Mfx 2.0耐药/株(%)MDR MTB7878(100.0)78(100.0)43(55.1)43(55.1)25(32.1)非MDR MTB13719(13.9)8(5.8)10(7.3)8(5.8)1(0.7)χ2148.90183.6061.2166.7345.87 P<0.001<0.001<0.001<0.001<0.001
2.2对Ofx及Mfx耐药的MDRMTB基因突变类型与突变位点结果见表2。43株对Ofx耐药的MDR MTB中,39株(90.7%)gyrA基因突变,5株(11.6%)gyrB基因突变;43株对Mfx 0.5耐药的MDR MTB中,38株(88.4%)gyrA基因突变,5株(11.6%)gyrB基因突变;25株对Mfx 2.0耐药的MDR MTB中,25株(100.0%)gyrA基因突变,3株(12.0%)gyrB基因突变。
45株对FQs药物耐药的MDR MTB经基因测序发现,gyrA基因突变分布于90、91、94位点,涉及3个密码子,7种突变类型,其中94位点突变最多;gyrB基因突变分布于534、539、540、543、551位点,涉及5个密码子,5种突变类型,突变位点分布均匀。gyrA基因94位点突变26株,药物敏感性试验证实对Ofx、Mfx 0.5耐药26株(100.0%),对Mfx 2.0耐药19株(73.1%)。gyrA基因91位点突变5株,药物敏感性试验证实对Ofx、Mfx 0.5耐药5株(100.0%),对Mfx 2.0耐药3株(60.0%)。gyrA基因90位点突变11株,药物敏感性试验证实对Ofx耐药8株(72.7%),对Mfx 0.5耐药7株(63.6%),对Mfx 2.0耐药4株(36.4%)。43株Mfx耐药的gyrA基因突变株中,发现5株双突变株,其中包括2株A90V+S91P、1株A90V+D94N、1株A90V+D94Y、1株D94N+D94Y。
表2MDRMTB的药物敏感性试验及gyrA、gyrB基因测序结果
Tab.2ResultsofdrugsensitivitytestandthesequencingresultsofgyrA,gryBgenesinMDRMTB
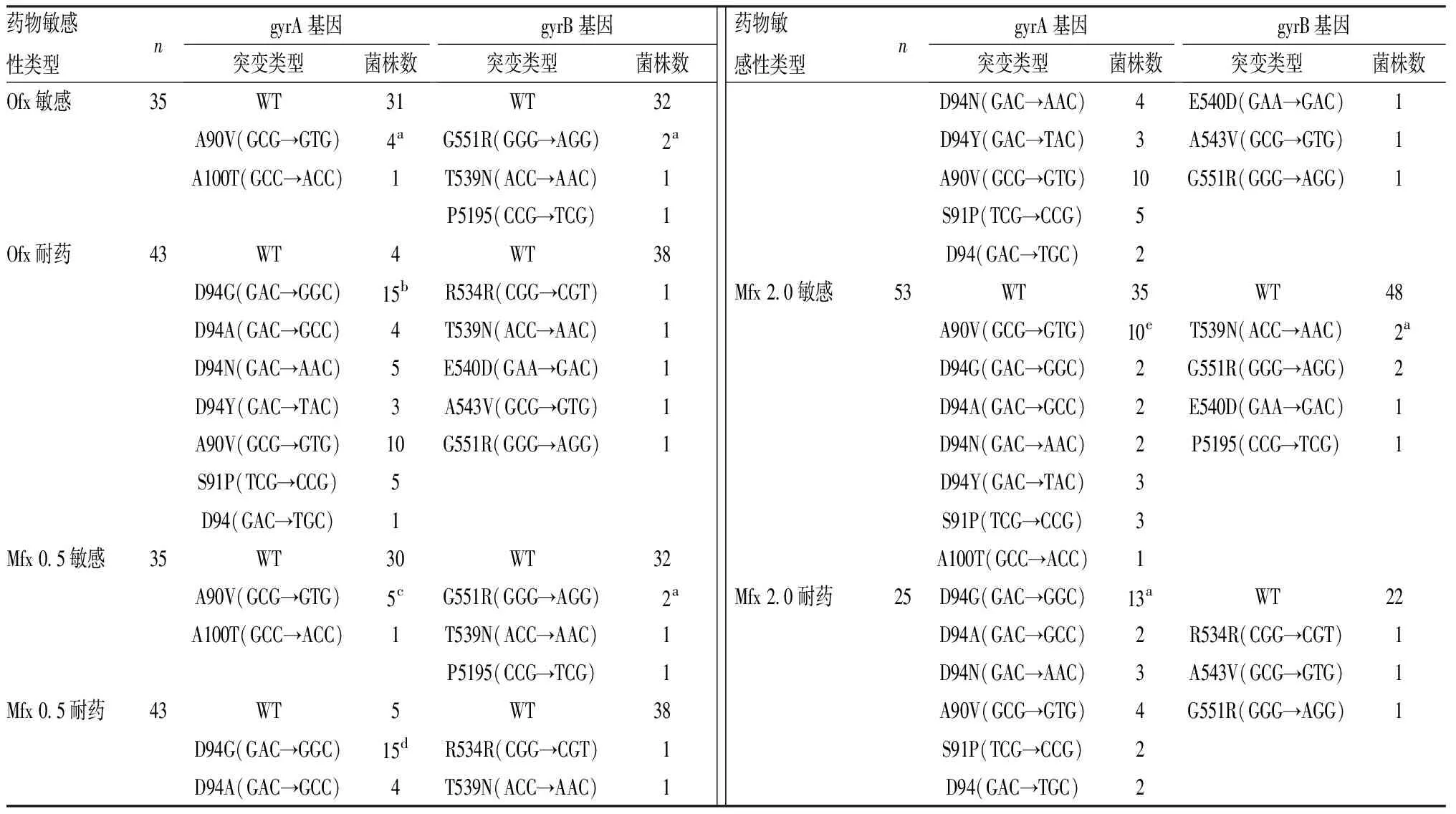
药物敏感性类型ngyrA基因突变类型菌株数gyrB基因突变类型菌株数Ofx敏感35WT31WT32A90V(GCG→GTG)4aG551R(GGG→AGG)2aA100T(GCC→ACC)1T539N(ACC→AAC)1P5195(CCG→TCG)1Ofx耐药43WT4WT38D94G(GAC→GGC)15bR534R(CGG→CGT)1D94A(GAC→GCC)4T539N(ACC→AAC)1D94N(GAC→AAC)5E540D(GAA→GAC)1D94Y(GAC→TAC)3A543V(GCG→GTG)1A90V(GCG→GTG)10G551R(GGG→AGG)1S91P(TCG→CCG)5D94(GAC→TGC)1Mfx 0.5敏感35WT30WT32A90V(GCG→GTG)5cG551R(GGG→AGG)2aA100T(GCC→ACC)1T539N(ACC→AAC)1P5195(CCG→TCG)1Mfx 0.5耐药43WT5WT38D94G(GAC→GGC)15dR534R(CGG→CGT)1D94A(GAC→GCC)4T539N(ACC→AAC)1药物敏感性类型ngyrA基因突变类型菌株数gyrB基因突变类型菌株数D94N(GAC→AAC)4E540D(GAA→GAC)1D94Y(GAC→TAC)3A543V(GCG→GTG)1A90V(GCG→GTG)10G551R(GGG→AGG)1S91P(TCG→CCG)5D94(GAC→TGC)2Mfx 2.0敏感53WT35WT48A90V(GCG→GTG)10eT539N(ACC→AAC)2aD94G(GAC→GGC)2G551R(GGG→AGG)2D94A(GAC→GCC)2E540D(GAA→GAC)1D94N(GAC→AAC)2P5195(CCG→TCG)1D94Y(GAC→TAC)3S91P(TCG→CCG)3A100T(GCC→ACC)1Mfx 2.0耐药25D94G(GAC→GGC)13aWT22D94A(GAC→GCC)2R534R(CGG→CGT)1D94N(GAC→AAC)3A543V(GCG→GTG)1A90V(GCG→GTG)4G551R(GGG→AGG)1S91P(TCG→CCG)2D94(GAC→TGC)2
注:WT(wild type)指菌株的相关基因片段测序未发生突变。a:有1株为双突变;b:有5株为双突变;c:有2株为双突变;d:有4株为双突变;e:有3株为双突变。
2.3应用耐药基因判断MDRMTB对FQs药物耐药的敏感性和特异性结果见表3。检测gyrA基因突变判断MDR MTB对FQs药物耐药的特异性高于gyrB基因突变(χ2=17.86、15.44、13.92,P<0.001);检测gyrA基因突变判断MDR MTB对Ofx耐药的敏感性高于gyrB基因突变(χ2=4.53,P<0.05)。
表3应用gyrA与gyrB基因突变判断MDRMTB对FQs药物耐药的敏感性和特异性
Tab.3SensitivityandspecificityofjudgingFQsdrugresistanceinMDRMTBbygyrAandgyrBgenemutations
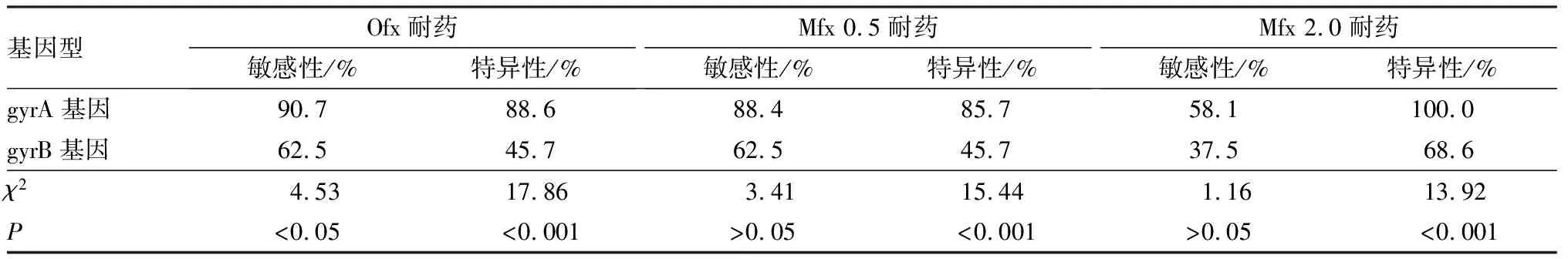
基因型Ofx耐药敏感性/%特异性/%Mfx 0.5耐药敏感性/%特异性/%Mfx 2.0耐药敏感性/%特异性/%gyrA基因90.788.688.485.758.1100.0gyrB基因62.545.762.545.737.568.6χ24.5317.863.4115.441.1613.92P<0.05<0.001>0.05<0.001>0.05<0.001
注:以药物敏感性试验结果为金标准。
3 讨论
目前,与MTB对FQs药物耐药相关的基因中,研究最广泛的是gyrA基因和gyrB基因突变。王志锐等[6]研究证明,gyrA基因QRDR发生突变是MTB对FQs药物产生耐药的主要原因。但国内有关MDR MTB对FQs药物耐药基因的相关研究较少,本研究主要就MDR MTB对FQs药物耐药的相关基因和突变位点进行分析,以寻找最能体现MDR MTB对FQs药物耐药的基因突变。本研究结果显示,在90.7%的对Ofx耐药MDR MTB中发现gyrA基因突变;在88.4%的低浓度Mfx(0.5 mg·L-1)耐药MDR MTB中发现gyrA基因突变;在100%的高浓度Mfx(2.0 mg·L-1)耐药MDR MTB中发现gyrA基因突变;以上结果说明gyrA基因突变是MDR MTB对FQs药物耐药的主要原因。本研究中MDR MTB与FQs药物耐药相关的gyrA基因突变分布于90、91、94位点,其中gyrA基因于94位点出现突变的频率最高,且在gyrA基因94位点出现突变的所有MDR MTB均对Ofx和低浓度Mfx耐药,并对大部分高浓度Mfx耐药,不仅说明MDR MTB对FQs药物存在交叉耐药性,还提示gyrA基因94位点突变可能是判断MDR MTB 对FQs药物耐药的一个敏感指标。故在确定MDR肺结核患者抗结核治疗方案时,若分子基因检测证实gyrA基因94位点突变,不应再选择FQs药物,或至少不能将其做为抗结核治疗方案中的核心药物之一。
本研究结果显示,在gyrA基因突变并对Mfx耐药的MDR MTB中还发现5株双突变菌株,包括2株A90V+S91P、1株A90V+D94N、1株A90V+D94Y、1株D94N+D94Y。这5株双突变菌株中仅1株对高浓度Mfx耐药,其余4株均对低浓度Mfx耐药,与以往刘志广等[7]的研究结论“gyrA基因的双突变与MTB对高浓度FQs药物耐药有关”不同。其原因可能为所观察的菌株不同,刘志广等[7]研究的菌株为MTB,而本研究的菌株为MDR MTB;gyrA基因的双突变株在样本中比例较少,故本研究认为,双突变菌株对高浓度或低浓度FQs药物耐药的关系较难判断。
本研究中,gyrB基因突变分布于534、539、540、543、551位点,在对FQs药物耐药菌株中gyrB基因突变发生率为11.6%~12.0%。有研究证实,gyrB基因在540位点的突变与FQs药物耐药密切相关[8],但本研究发现,gyrB基因5个位点的突变分布均匀,并未发现540位点突变频率高于其他位点。在本研究中,gyrB基因突变常与gyrA基因突变共同存在,gyrB基因的突变率远低于gyrA基因,故认为gyrB基因突变并不是判断MDR MTB对FQs药物耐药的敏感性和特异性指标。
FQs药物是治疗结核病重要的二线药物,但FQs药物的临床应用已二十余年,且被广泛应用于其他细菌感染的治疗,致使该类药物的耐药率不断上升。本研究发现,78株MDR MTB临床分离株,对Ofx的耐药率为55.1%,对Mfx 0.5的耐药率为55.1%,对Mfx 2.0的耐药率为32.1%,明显高于非MDR MTB临床分离株。
综上所述,郑州地区MDR MTB对FQs药物耐药率较高,耐药的主要原因是gyrA基因突变,最常见的gyrA基因突变位于94位点。gyrB基因突变率明显低于gyrA基因。故对MDR MTB患者来说,在应用分子基因检测技术检测MDR MTB对FQs药物的耐药性时,应重点检测gyrA基因突变。
本研究尚有一些不足之处,如样本量较小,没有进行FQs药物最低抑菌浓度的测定,无法准确了解gyrA、gyrB基因不同位点突变与最低抑菌浓度的相关性,还需今后的进一步研究。

