贯筋藤酶解山羊乳酪蛋白糖巨肽的工艺研究
赵存朝,王雪峰,黄梦,魏光强,黄艾祥
(云南农业大学食品科学技术学院,昆明 650201)
0 引 言
贯筋藤(Dregea sinensis hemsl)为萝藦科、南山藤属植物,攀援木质藤本,俗称“奶浆藤”[1]。生长于海拔500~3000米山地森林中或灌木丛中,在中国滇西北地区,长期以来用贯筋藤茎杆的热水溶液加工乳饼,而不是常规的酸水做凝乳剂[2]。作者所在课题组通过国家基金项目-贯筋藤凝乳机理的研究(31160331)结果表明,贯筋藤蛋白酶对CN,α、β、κ-CN均有降解作用,α-CN部分降解,β-CN和κ-CN全部降解,是一种复合蛋白酶,主要是分子量23.8 ku的半胱氨酸蛋白酶procerain B,该酶具有耐高温、耐酸碱性能较好、凝乳活力较高等酶学特性[3-5];通过MALDI-TOF质谱仪测定酶切肽段的分子量、蛋白多肽序列测序仪测定氨基酸序列,确定κ-CN的酶切位点为Ala90-Glu91,产生分子量分别12 ku的副κ-酪蛋白和6.9 ku的CGMP;且不同于大多数凝乳酶的酶切位点Phe105-Met106[6]。
1 实验
1.1 材料与试剂
山羊乳,贯筋藤凝乳酶(由实验室提供[3-6])酶活力为223.135 SU/mL。牛血清蛋白,唾液酸;其他试剂均为国产分析纯。
1.2 仪器与设备
URA14M 0018分光光度计,RE-52AA旋转蒸发仪,TGL20M高速冷冻离心机,HWS24型水浴锅,DYY-6C电泳仪,Bro-rid伯乐垂直电泳槽。
1.3 方法
1.3.1 山羊乳CGMP粗提工艺流程
山羊乳脱脂(3 040 g、离心10 min)→酶解→灭酶(沸水浴10 min)→离心(3 040 g离心20 min)→20%的硫酸铵盐析→离心(10 000 g离心10 min)→ 透析脱盐(分子量为500~1 000 u的透析袋)→ 冷冻干燥(5~10 MPa,-50℃)→CGMP粗品。
1.3.2 酶解制备CGMP单因素工艺筛选
那天午后,知了在树上叽叽喳喳地叫着,我对着天空,呆呆地望着它,妈妈见我这样,急忙想出一个好点子,我们去图书馆吧!我像一只被放出笼子的小鸟一样,冲到了图书馆。
以贯筋藤蛋白酶酶解山羊乳后酶解液的水解度和CGMP含量为指标。考察酶解时间(20,30,40,50,60 min),酶解温度(70,75,80,85,90℃),酶的添加量(以脱脂山羊乳体积的4%,5%,6%,7%,8%,9%)对山羊乳酶解液水解度和CGMP质量浓度的影响,确定贯筋藤蛋白酶酶解山羊乳的最佳因素水平。
1.3.3 山羊乳源CGMP提取工艺响应面实验设计
在单因素试验的基础上,利用响应面Box-Behnken实验设计,选取酶解时间、酶解温度、酶的添加量3个因素,进行3因素3水平的试验设计,优化贯筋藤蛋白酶提取山羊乳源酪蛋白糖巨肽的工艺参数。响应面分析因素及水平如表1所示。
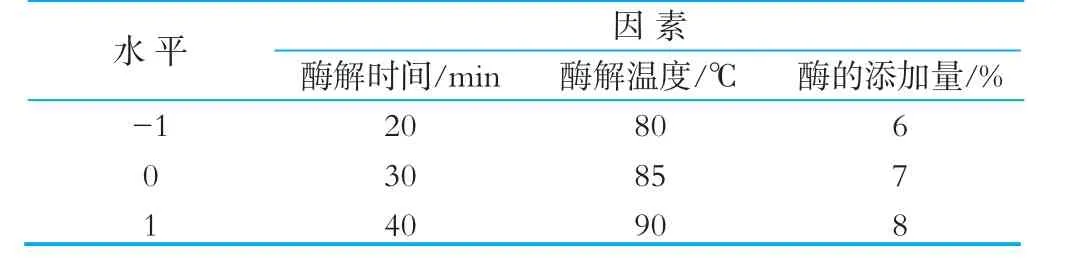
表1 响应面实验因素与水平设计
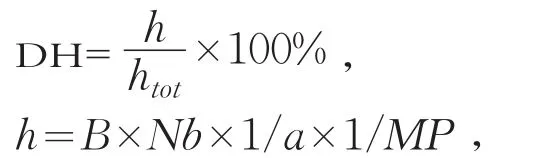
式中:h为单位质量蛋白质中被水解的肽键的量(mmol/L);htot为单位质量蛋白质中肽键的总量(mmol/L),乳酪蛋白浓度为htot=8.2 mmol/L;B为水解过程中的耗碱量(mL);Nb为碱液浓度(mol/L);MP为水解液中蛋白质质量(g);a为校正系数(设贯筋藤蛋白酶=1)。
(2)CGMP质量浓度测定[10]。κ-酪蛋白是酪蛋白中唯一含有糖成分的蛋白质,而唾液酸(N-乙酰神经氨酸)都集中在CGMP上,所以可以用测定唾液酸含量的大小鉴定CGMP生成量的多少。配制3.26 mmol/L的唾液酸标准溶液,分别取不同浓度的标准溶液2 mL,加入间苯二酚试剂工作液2 mL(2%的间苯二酚溶液10 mL,加入浓度为0.1 mol/L的硫酸铜溶液0.25 mL,加入浓盐酸80 mL,用蒸馏水定容至100 mL,
1.3.4 山羊乳酶解液中CGMP的检测
(1)水解度测定[15]。水解度的测定采用p H-stat法,水解度的计算公式为置于室温4 h后4℃储存)至具塞试管中,加盖置于沸水浴中加热15 min,然后快速冷却,加有机溶液乙酸丁酯-正丁醇(85:15)4 mL,振荡提取后在37℃下水浴5 min,4℃(2 860 g)转速离心10 min,取上层有机相,于波长580 nm处测定吸光值。绘制标准曲线回归方程为:y=1.4141x+0.0409(0.1008~0.6048 mg/mL,R2=0.999;y为吸光度,x为唾液酸标准液浓度。取样品溶液2 mL,参照标准曲线制作方法测定水解液吸光值。

式中:A580为水解液吸光度;V1为水解液体积;V2为山羊奶体积。
(3)CGMP纯度测定[16]。采用紫外吸收法测酪蛋白糖巨肽的浓度。CGMP的化学特征为不含芳香族氨基酸,只有205 nm~217 nm处的紫外吸收,在280 nm处没有紫外吸收。因此,210 nm与280 nm处的紫外吸收差值可用于CGMP纯度的评价。本实验测定山羊乳酶解液超滤后不同分子量的CGMP粗品的纯度。
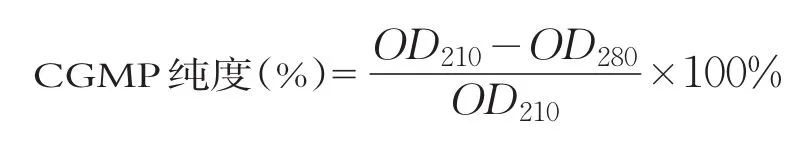
式中:OD210-210 nm吸光度;OD280-280 nm吸光度。
(4)蛋白质测定采用考马斯亮蓝比色法[17]。
(5)CGMP的糖基化度[18]。CGMP的功能性成分是唾液酸,CGMP片段中唾液酸含量与蛋白质含量的比值越大,则糖基化度越大。糖基化度为间苯二酚-盐酸法测定唾液酸在580 nm处的吸光度与水解液中蛋白含量的比值。

1.3.5 理化指标测定
(1)水分质量分数测定根据GB 5009.3-2016中的直接干燥法进行;(2)脂肪分数测定根据GB 5413.3-2010中的相关方法进行;(3)蛋白质质量分数测定根据GB 5009.5-2010中的凯氏定氮法,对蛋白质质量分数进行测定;(4)灰分测定根据GB 5009.4-2016中的相关方法进行。
1.4 数据处理
采用Excel 2013对实验数据进行整理,利用Design-Expert 8.0.6进行响应面分析、利用spss24对数据进行方差显著性分析。
2 结果与分析
2.1 酶解制备CGMP单因素实验
以贯筋藤蛋白酶酶解山羊乳温度(70,75,80,85,90℃),时间(20,30,40,50,60 min),酶的添加量(4%,5%,6%,7%,8%,9%)为考察因素,对脱脂后的山羊乳进行酶解,4 000 g离心20 min;离心后取上清液,测定其水解度及唾液酸质量浓度,结果如图1所示。

图1 酶解因素对水解度及唾液酸质量浓度的影响
图1 中,所有的值表示为平均值±标准差(X±SD;n=3);CGMP质量浓度及水解度曲线上具有相同字母表示差异不显著(P>0.05)。
由图1可以看出,山羊乳酶解液水解度及唾液酸质量浓芳随着酶解温度的提高呈先上升后下降趋势;酶解液水解度及唾液酸质量浓度85℃是显著高于其他酶解温度,分别为19.68%和2.846 mg/mL(P<0.05);实验过程中,发现随着温度的提高,山羊乳的凝乳时间在缩短,且85℃时山羊乳5 min内凝乳,凝乳时间较短;原因可能是:凝乳发生时总的κ-酪蛋白被水解掉约80%后,在钙离子与酪蛋白胶粒间形成化学键形成凝块或凝固的乳,使部分CGMP不能测定出来,造成CGMP含量及水解度下降[19]。
随着时间增加山羊乳酶解液唾液酸含量呈上升后下降的趋势;酶解液唾液酸含量在酶解30 min时显著高于其他酶解时间,2.661 mg/mL(P<0.05);随着时间的延长,水解度随时间增加呈上升趋势。原因可能是:随时间延长导致除CGMP外的非目标肽增加,水解度不断提高,但30 min时酶解液中CGMP含量最高,故选择30 min为最佳酶解时间。
随着酶添加量的增加,山羊乳酶解液水解度及其中唾液酸含量呈上升趋势;当酶的添加量超过7%时水解度趋近于平缓,差异不显著,酶的添加量超过6%时CGMP含量趋近于平缓,差异不显著(P<0.05);酶的添加量达到7%时,山羊乳酶解液水解度及CGMP含量最大,故选取7%为酶解最适添加量。原因可能是:随着酶的添加量提高,酪蛋白胶粒表面的κ-酪蛋白分子层部分分解,内部的α,β-酪蛋白失去胶体保护作用也会被贯筋藤凝乳酶水解,所以山羊乳酶解液水解度会随之提高,所以内层酪蛋白在很短时间内会和贯筋藤蛋白酶发生反应,自然会引入非目标肽类,所以本实验不能使酶解反应无限制的进行[20]。
2.2 响应面试验
2.2.1 响应面试验设计与结果
根据单因素试验结果,建立Box-Behnken Design中心组合设计试验模型,通过拟合二次方程计算最优工艺组合以及山羊乳CGMP的最大理论提取量。选择酶的添加量(X1)、酶解温度(X2)、酶解时间(X3)进行三因素三水平响应面试验,实验结果如表2所示。
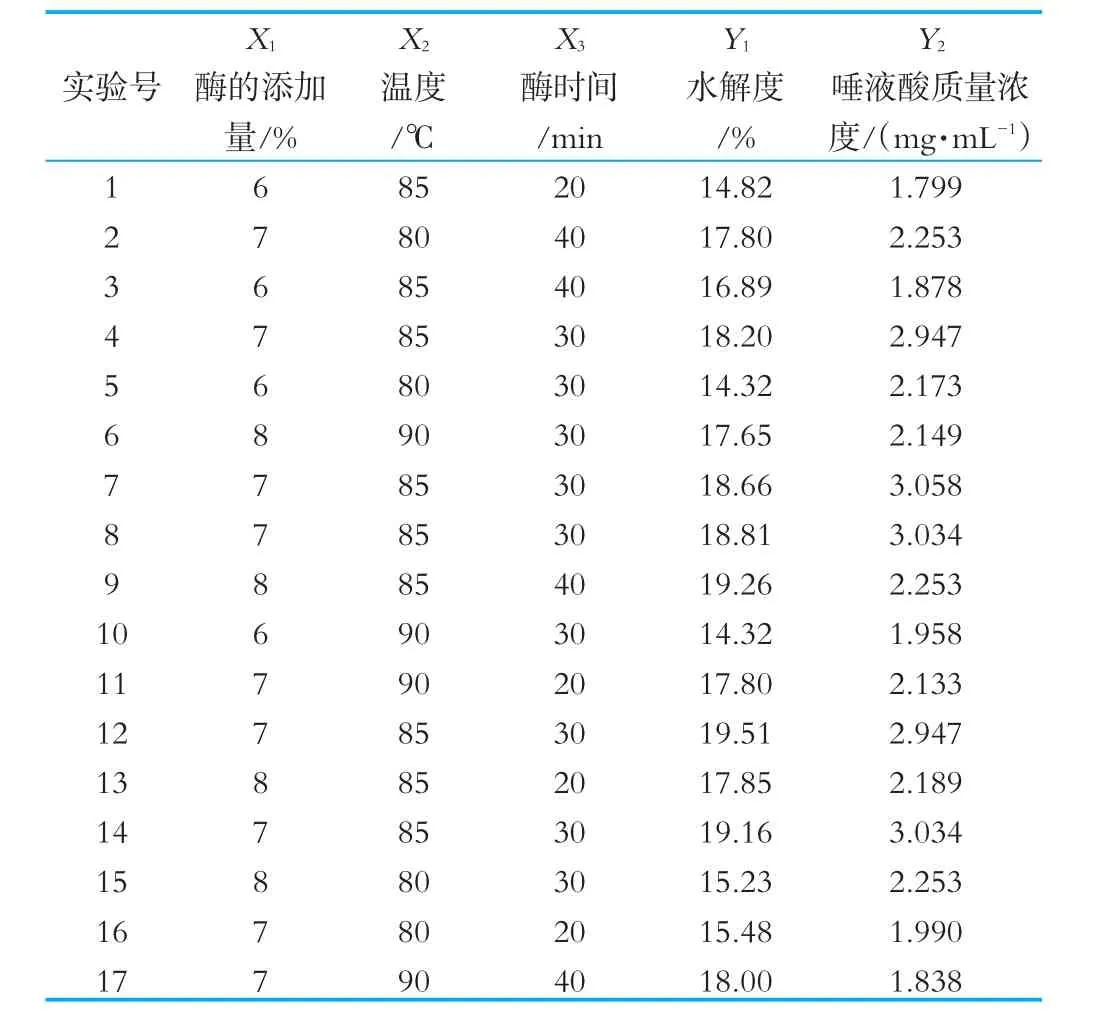
表2 响应面分析方案及结果
2.2.2 模型建立及显著性检验
利用Design-Expert8.0.6软件对表2进行多元回归拟合,得到羊乳酶解液水解度、唾液酸含量与酶的添加量(X1)、温度(X2)、时间(X3)的二次方程模型为:Y1=18.87+1.21X1+0.62X2+0.75X3+0.6X1X2-0.17X1X3-0.53X2X3-1.78X12-1.71X22+0.11X32;Y2=3+0.13X1- 0.074X2+0.014X3+0.028X1X2-(3.75×10-3)X1X3-0.14X2X3-0.45X12-0.42X22-0.53X32。回归模型的方差分析结果如表3所示。
由表3方差分析可知:山羊乳乳清水解度回归模型显著性检验P<0.0001<0.05,乳清中唾液酸质量浓度回归模型显著性检验P<0.0001<0.05,说明两者二次多元回归模型极显著;山羊乳乳清水解度回归模型失拟性检验P=0.7716>0.05,唾液酸质量浓度回归模型失拟性检验P=0.1027>0.05,可以认为所选水解度及CGMP质量浓度二次回归模型与实际试验拟合性充分模型失拟不显著。水解度回归诊断表明,决定系数R2=0.9746,信噪比Adeq precisior=14.764,唾液酸质量浓度回归诊断表明,决定系数R2=0.9865,信噪比Adeq precisior=18.532。这表明方程的拟合度和可信度均很高,可用于预测山羊乳乳清的水解度及唾液酸的提取质量浓度。离散系数C.V(Y的变异系数)表示实验本身的精确度,C.V值越小,实验的可靠性越高,水解度拟合C.V值为2.47%,唾液酸质量浓度过C.V值为3.45%。综上所述,回归模型拟合程度良好,实验误差小,能够准确的分析和预测山羊乳酶解液的水解度及唾液酸的提取量,说明实验操作可信度高,具有一定的实践指导意义。由回归系数显著性表明,在所取因素水平范围内,各因素对山羊乳水解度影响的顺序为:酶的添加量>酶解时间>酶解温度;各因素对山羊乳乳清唾液酸含量影响的顺序为:酶的添加量>酶解温度>酶解时间。

表3 水解度及唾液酸含量回归模型方差分析结果
2.2.3 响应面分析结果
图2和是通过二次回归模型拟合的响应面变化三维曲面。响应面和等高线的稀疏程度可直观地反映温度℃、时间min、酶的添加量%之间交互作用对山羊乳蛋白水解度%及其中唾液酸质量浓度的影响,当等高线呈圆形时表示两因素交互作用不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著。
由图2可以看出:随着时间的延长山羊乳水解度呈上升趋势,而温度的不断上升使山羊乳水解度呈先上升后下降趋势,与单因素实验结果一致,表4方差分析显示,贯筋藤酶解温度与酶解时间交互作用显著,P=0.0252<0.05;随着贯筋藤蛋白酶添加量与温度的提高,山羊乳水解度呈先上升后下降的趋势,表4方差分析显示,贯筋藤蛋白酶的添加量与温度交互作用显著,P=0.042<0.05;固定酶的添加量为0水平,随着时间及酶解温度的提高山羊乳酶解液中CGMP质量浓度呈先上升后下降的趋势,表3方差分析显示,酶解时间与温度交互作用显著,P=0.0107<0.05;二次回归模型拟合结果显示,酶的添加量7.24%,时间达31.76 min,酶解温度为85.21℃时,山羊乳清水解度及唾液酸含量响应曲面出现最高点,水解度预测值19.21%,唾液酸质量浓度预测值2.991 mg/mL。
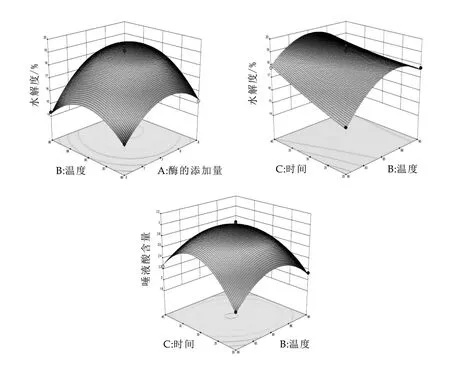
图2 各因素交互作用对山羊乳水解度及唾液酸质量浓度影响的响应面
2.2.4 最佳条件的确定和回归模型的验证
回归模型通过响应面法得到最优山羊乳清水解度及唾液酸含量的工艺条件,为验证该模型的预测是否准确,考虑实际操作情况的方便性与设备参数状况,确定贯筋藤蛋白酶酶解山羊乳最佳工艺条件为:酶的添加量7%,酶解温度85℃,酶解时间32 min,在此条件下进行6次重复实验,结果表明水解度为21.19%±0.46%,CGMP质量浓度为(2.821±0.0331)mg/mL,与预测值接近,说明模型准确可靠。山羊乳在酶解过程中凝乳状态良好,水解稳定。
2.3 山羊乳源CGMP的检测
配制质量浓度为5 mg/mL的山羊乳CGMP冻干粉粗品,对其进行检测,实验结果如表4所示。

表4 山羊乳CGMP检测
2.4 理化指标测定
相关理化指标结果如表5所示。

表5 山羊乳CGMP理化指标测定 %
3 结 论
(1)实验以贯筋藤蛋白酶、山羊乳为材料,利用酶法对山羊乳源CGMP的提取工艺进行优化,重点分析酶解因素作用规律,通过响应面试验Box-Behnken设计优化了贯筋藤酶解山羊乳源CGMP的最佳提取工艺。
(2)利用贯筋藤酶解山羊乳制备的CGMP具有较高的糖基化度及纯度,为提高山羊乳资源的综合利用水平,生物活性制剂、保健食品、医药品的开发提供了理论依据。

