结肠占位合并肝右叶占位的罕见病例多学科讨论及文献回顾
林沛楠 陈晓锋 孙婧 梅竹 顾艳宏
肝内胆管细胞癌,又称胆管癌,是指起源于二级胆管上皮细胞及其分支的腺癌,约占胃肠道恶性肿瘤的3%,无明显症状,发现时已多为晚期,因此早期诊断和及时治疗显得尤为重要。其转移常发生的部位为肝、腹膜和肺,转移至其他部位较罕见,但也有少量报道。本文报道了1例肝内胆管细胞癌结肠转移的罕见病例及文献回顾,以期类似罕见病能获得正确的诊疗。
一、一般资料
患者,冯某,男性,54岁。因腹痛、腹胀1月余于2016年10月29日住入江苏省人民医院结直肠外科。患者1月前出现间断腹痛、腹胀,可自行缓解,无明显便血、便秘,无恶心、呕吐,症状逐渐加重。外院CT提示肝右叶占位、升结肠占位。近期体重无明显减轻。既往有高血压病史5年,服用络活喜治疗,血压控制可。无特殊家族史和个人史。
入院评估:体重指数(body mass index,BMI)22 Kg/m2;营养风险评分:1分;日常生活能力评分(activity of daily living,ADL)评级:I 级;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分:0 分。查体无明显阳性体征。
入院检查:血常规:血红蛋白为96 g/L,尿粪三大常规、肝肾功能、凝血功能未见明显异常。血清肿瘤标志物示:甲胎蛋白(AFP)为2 ng/mL(0~20.0 ng/mL),癌胚抗原(CEA)为103.9 ng/mL(0~4.7 ng/mL),糖链抗原19-9(CA19-9)>1 000 U/mL(0~39.0 U/mL)。查肠镜见回盲部及回盲瓣见新生物,表面高低不平伴破溃,肠腔见新鲜血迹,活检质地脆,易出血。肠镜病理示:(回盲部)腺上皮不典型增生,癌变。胸腹部CT示:盲升结肠局部管壁增厚,周围脂肪间隙模糊,肠管周围及肠系膜见数枚肿大淋巴结。考虑结肠CA,建议结合临床及肠镜。肝右叶见一大小约3.5 cm×3.4 cm低密度影,病灶呈周围强化,考虑转移灶可能。患者初步诊断为结肠癌肝转移(IV期)。
二、诊治经过
1.第一次MDT讨论:放射科医生:该患者动脉期CT图像显示在肝脏S6段可见一个肿块,直径约3 cm×4 cm,边缘轻度强化,无远端胆管扩张、局部包膜凹陷,静脉期显示肝脏病变更清楚。盲升结肠肠壁不均匀增厚、强化,病变突破浆膜层,累及壁外脂肪组织,伴病灶内侧多发肿大淋巴结,左侧盆壁一枚肿大淋巴结(图1),根据影像学表现考虑盲升结肠癌伴周围淋巴结转移,肝脏占位考虑肝转移。
病理科医生:该患者肠镜病理送检组织为3块活检肠镜黏膜,低倍镜下可见腺管样结构,互相融合形成筛孔样结构,与正常肠黏膜之间没有移行关系。基于细胞学形态异常,如核异性、核浆比例失调、核增大,以及组织结构异常,如筛状结构、共壁现象等,诊断“腺上皮不典型增生伴癌变”。
结直肠外科医生:根据病史以及影像科解读、病理科分析,该患者升结肠癌(回盲部)肝转移诊断明确。根据影像学表现,原发灶和肝转移灶均为初始可切除,是否需要术前新辅助化疗没有明确的循证医学证据,NCCN指南亦无明确答复。2015版ESMO指南明确提出要从“手术技术标准”和“肿瘤学预后因素”两个维度考量围手术期治疗模式。复发风险评分的五个参数包括:转移瘤数目、大小、转移瘤出现的时间、原治疗目标发瘤区域淋巴结是否转移及血CEA水平。根据该患者的情况建议直接手术,患者营养评分、一般状况佳,肝脏病灶可同期切除。
肿瘤内科医生:该患者初步诊断考虑结肠癌肝转移,肝脏单发病灶,一般有两种处理意见:(1)新辅助化疗+手术+术后辅助化疗,(2)直接手术+术后辅助化疗。评判新辅助治疗主要看两个指标:(1)技术上是否可切,(2)预后。根据外科医生的意见,技术上可切。该患者从影像学上来看有淋巴结转移,肝脏转移为同时性,且为单发,直径小于5 cm,CEA<200 ng/mL,CRS评分计0~1分,因此无论从技术上还是预后评估上,都建议直接手术切除,不建议术前新辅助化疗。总体来说,越容易切除、预后越好的肿瘤越不需要术前新辅助化疗;反之,切除越困难、预后越差的患者,不但需要术前化疗,而且化疗方案的强度也应增强。
总结:综合团队意见,该患者考虑为结肠癌肝转移,一般状况良好,CRS评分为1分,初始可切除,建议直接手术同期切除原发灶和肝转移灶。
2.治疗情况:患者于2016年11月4日行结肠癌根治术+肝右叶部分切除术,术中见腹盆腔无腹水,肝脏右后叶一肿块,直径约3 cm,质地硬,脾脏、大网膜未见明显转移,升结肠系膜可及数枚肿大的淋巴结,肿瘤位于回盲部,侵犯浆膜层,直径约6 cm,浸润型。
术后病理:(右半结肠)腺癌,Ⅱ~Ⅲ级,伴大片坏死,溃疡型,肿块大小3.5 cm×3 cm×2 cm,肿瘤浸润肠壁全层达浆膜外纤维脂肪结缔组织,可见神经侵犯及脉管内癌栓,上、下切缘及另送(吻合圈)未见癌组织残留。免疫组化:肿瘤细胞CDX-2(-),CK7(+),CK20(+),Villin(+),Muc-1(+),Muc-2(-),结合HE切片,本例为腺癌,Ⅱ~Ⅲ级,免疫表型符合胆管来源(图2)。
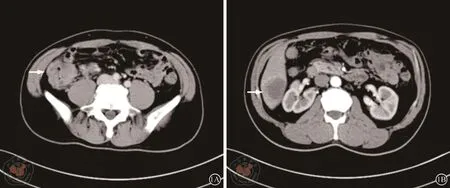
图1 全腹部的CT增强。1A左图结肠占位;1B右图肝脏占位
肠周及另送(201、202、213组)淋巴结见癌转移(5/9、2/2、3/3、1/3),另见癌结节2枚,大小直径0.4 cm、直径2 cm。另送(203、212组)淋巴结未见癌转移(0/8、0/4)。慢性阑尾炎。(肝脏)腺癌,Ⅱ~Ⅲ级,伴大片坏死,肿瘤大小4.5 cm×4 cm×3 cm。免疫组化:肿瘤细胞CK7(灶+),CK20(-),Villin(-),CDX-2(-),Muc-1(+),结合HE切片,本例为腺癌,Ⅱ~Ⅲ级,免疫表型符合胆管来源(图3)。
术后4周至复查CT示肝脏多发异常信号影,考虑转移瘤。肿瘤标志物CEA为61.8 ng/mL,CA19-9为1324 U/mL。
予吉西他滨联合替吉奥方案化疗4周期,期间肿瘤标志物CEA、CA19-9进行性下降,最低时CEA为5.98 ng/mL,CA19-9为175.5 U/mL;2周期复查CT提示病灶缩小,总体评价为稳定,4周期结束后复查,CEA为12.23 ng/mL,CA19-9为303.5 U/mL,较前升高;CT及MRI评价为疾病进展。后续患者及家属拒绝进一步化疗,仅予对症支持治疗,患者于 2017年04月24日去世,一线治疗无进展生存时间为4个月,总生存时间为6个月。
三、反思
病理科医生:该患者术后标本的形态学表现和活检标本不完全一致,术后标本的腺样结构消失,出现散在的、分化极差的梭形肿瘤细胞。由于病理形态与肠镜活检形态不一致,出现了分化更差的细胞,同时在结肠肿块和肝脏肿块上都出现了大片的坏死,为了证实肿瘤的来源,做了免疫组化。第一批免疫组化做了CK7,CK20,CDX-2和Villin,同时在肝脏和肠上检测,发现CDX-2完全不表达,然而CDX-2在肠癌上敏感性非常高,往往会出现90%以上的阳性。CK7一般来说在肠癌不表达,而该患者的肠和肝脏都出现了CK7的表达。CK20在肠肿瘤表达,肝脏肿瘤不表达。提示该患者的肿瘤并非起源于结肠,而是起源于胆道。第二批追加了几个标记,发现黏液蛋白,Muc-1,Muc-2,SATB2,E-cadherin等肠特异性蛋白无表达,而CK19、CD10等胆道标记有表达,最终诊断腺癌来源于胆管。
活检标本是内镜诊断的重要依据,但是内镜活检标本存在两方面的局限性,1.根据WHO诊断标准,结直肠腺癌的诊断必须看到浸润,但活检标本的深度达不到手术切除标本的水平,无法判断浸润深度,故导致诊断不足,不能诊断腺癌,只能诊断腺上皮不典型增生,癌变;2.肠镜活检标本不能通过简单的HE图像判断起源。因此,也时有内镜病理报告与手术病理报告不一致的情况发生。
影像科医生:该患者的影像学表现是非常典型的结肠癌肝转移。胆管细胞癌的增强特点也是边缘不规则强化,延迟扫描可见延迟强化,表现为延迟期病灶中心密度升高。肿块可压迫胆管引起远端胆管扩张,病灶内部的纤维组织引起肝包膜回缩为其间接征象。该患者的病灶仅表现边缘不规则强化,未见远端胆管扩张和包膜回缩,加上肠道的占位及肠道占位周边的淋巴结肿大,还是没法从影像学上考虑是胆管癌肠转移。
外科医生:结肠作为一个转移器官一般都是腹腔种植于肠浆膜面,然后向黏膜面侵犯。这个患者根据肠镜描述、手术中所见、标本描述以及术后病理检查,像是肿瘤起源于黏膜并向外侵犯,还伴有这么多系膜淋巴结转移。临床上很难理解这样的罕见病例。

图2 结肠病灶免疫组化CDX-2(-),CK7(灶+),CK20(+)
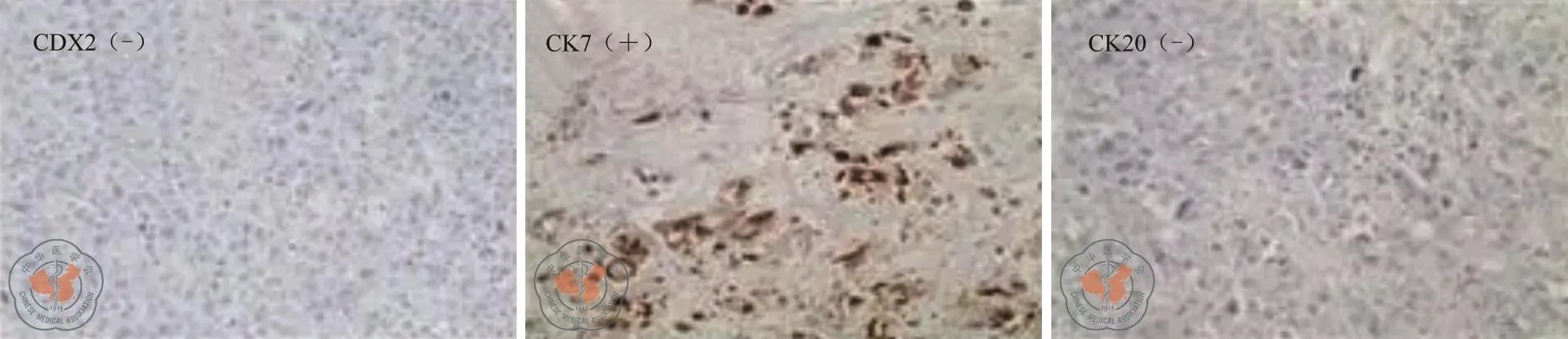
图3 肝脏病灶免疫组化CDX-2(-),CK7(灶+),CK20(-)病理诊断:肝内胆管细胞癌伴升结肠转移(IV期)
四、文献回顾与讨论
同时出现肝胆恶性肿瘤和消化道恶性肿瘤的病例中,大多数是消化道肿瘤肝脏转移。然而,尽管数量很少,但仍有肝胆恶性肿瘤消化道转移的病例被报道(表1),本例是已有文献报道中的第9例。在这9例患者中,男性6例,女性3例,男性稍多于女性;患者年龄在57~76岁之间。ICC发生肠转移多于ECC;9例患者中,结肠转移部位分别是升结肠2例,横结肠2例(同时发生降结肠转移),降结肠4例,乙状结肠1例。9例中6例为同时性肠转移,3例为异时性肠转移,转移时间间隔分别为15个月,5年,6年;这3例均为肝内胆管细胞癌,且患者性别为男性,其中2例转移部位为降结肠。9例患者中没有发现腹腔转移或腹膜种植,手术标本的淋巴结转移也极为少见,因此我们很难以淋巴转移或腹膜直接转移来解释这种特殊的转移机制,血行转移的解释相对合理,这也和其他转移性大肠癌的方式相符。免疫组化中,CK-20在大约70%~95%的结直肠腺癌和20%~40%的胆胰腺癌中表达阳性;CK-7在90%~100%的胆胰腺癌和5%~25%的结直肠腺癌中表达阳性;两者相组合,超过90%的结直肠癌中CK-7表达阴性同时CK-20表达阳性,而大约三分之一到三分之二的胆胰腺癌中CK-7表达阴性同时CK-20表达阴性或阳性。CDX-2是消化道腺癌中高度敏感及特异的标志物,在大约98%的胃、结直肠腺癌中表达阳性。因此本例中免疫组化的CK-7、CK-20、CDX-2的组合可用于鉴别原发性或继发性大肠癌。
五、总结
肝内胆管细胞癌肠转移是一种罕见的远处转移,罕见病的诊疗过程给临床诊断带来了挑战。但是对于这种多发病灶的患者,特别是同时分布于多个器官,确定各个病灶之间的关系,明确其来源,对治疗方式的选择、预后以及后续患者的生活质量尤为重要。本例病例虽是误诊,但未误治,其转移机制尚不清楚,我们报道这个病例,一方面是给同行提供借鉴,提高罕见病的诊疗;另一方面是想引起共鸣,希望更多类似的病例能被报道,以寻找其共性,探究其机制。

