维吾尔族不同龋敏感儿童变异链球菌临床分离株gftB、gftC基因遗传多态性研究
连冰洁 刘 媛 张洋洋 赵 今
龋病是以细菌为主的多种因素相互作用引起的一种慢性感染性疾病。儿童龋病已成为一个非常严重的公众健康问题。课题组前期对乌鲁木齐市3~5岁维吾尔族和汉族儿童进行流行病学调查及细菌学研究发现维吾尔族儿童与汉族儿童相似,主要致龋菌为变异链球菌(streptococcus mutans,变链菌)[1]。对于维吾尔族高龋和无龋儿童进行基因多态性的初步分析发现,龋敏感性与其基因多态性有相关性[2]。维吾尔族高龋和无龋儿童变链菌临床分离株生物膜状态下致龋能力差异较大,变链菌临床分离株的高致龋力可能与其携带有合成胞外多糖能力较强的菌株有关[3]。本实验利用前期实验所得生物膜状态下合成水不溶性葡聚糖(water-insoluble glucan,WIG)能力较强和较弱的变链菌作为研究对象,通过PCR-RFLP技术比较葡萄糖基转移酶编码基因gtfB、gtfC基因遗传多态性与其合成水不溶性葡聚糖的关系,推测其与维吾尔族儿童龋病发生的相关性。
资料和方法
1.主要仪器及试剂
YQX-Ⅱ厌氧培养箱(上海新苗医疗器械制造有限公司);全波长酶标仪(美国伯乐Bio-Rad);PCR扩增仪(美国伯乐Bio-Rad);电泳仪(北京六一仪器厂);电热恒温水浴锅(上海精宏实验设备有限公司);核酸蛋白测定仪(美国赛默飞世尔);凝胶成像分析系统:(美国伯乐Bio-Rad));比浊仪:美国(Becton Dickinson and Company)。
脑心浸液培养基(brainhear in fusion,BHI)(北京索莱宝科技有限公司);细菌基因组DNA提取试剂盒(离心柱型)(北京百泰克生物技术有限公司);蛋自酶K(广州东盛生物科技有限公司);溶菌酶(北京索莱宝科技有限公司);2×Taq PCR MasterMix(北京博迈德科技发展有限公司);GoldenViewTM核酸染料(北京博迈德科技发展有限公司);琼脂糖(上海生工生物工程有限公司);5×TBE Buffer(上海生工生物工程有限公司);限制性内切酶 BsrⅠ (Fermentas);λDNA/HindⅢ Marker(北京博迈德科技公司)。
2.实验菌株:选取课题组前期对维吾尔族高龋和无龋儿童变链菌临床分离株在生物膜状态下合成水不溶性葡聚糖能力较强菌株(高龋菌株)18株(OD值>0.30)、较弱菌株(无龋菌株)12株(OD值<0.15)。(OD值为吸光度值[3])。
3.全菌DNA提取及鉴定:将实验菌株接种于BHI平板,37℃厌氧培养48小时,观察菌落生长情况,镜检无污染,再接种于BHI液体培养基中,厌氧培养18小时,镜检无污染。用基因组DNA提取试剂盒提取各菌株DNA,-20℃保存。
4.引物设计与合成:采用引物设计软件Primer Premier 5进行引物设计[4],扩增变链菌 gtfB(5226bp)目的基因片段。上游引物5’CAAAGATGAAGAAGCAGTAAT 3’;下游引物5’TTCTATAACAAAAGCACAATG 3’
5.目的基因扩增:PCR反应条件:模板DNA3μl,Taq mix12.5μl,上下游引物各 0.5μl,ddH2O8.5μl至总反应体积 25μl。
gtfB 循环参数:95℃预变性 5min,(95℃变性30s,58℃退火 1min,70℃延伸 2min)×23 循环;72℃总延伸10min。
PCR产物检测:用移液器吸取PCR扩增产物6μl经0.8%琼脂糖凝胶电泳(1×TBE缓冲液,电压90V电泳50min),验证所得到的目的基因片段。
gtfC 循环参数:95℃预变性 5min,(95℃变性30s,58℃退火 1min,70℃延伸 2min)×23 循环;72℃总延伸10min。
PCR产物检测:用移液器吸取PCR扩增产物6μl经0.8%琼脂糖凝胶电泳(1×TBE缓冲液,电压100V电泳45min),验证所得到的目的基因片段。
6.限制性片段长度多态性分析:吸取gtfB、gtfC PCR 产物各 10μl,BsrⅠ内切酶 0.6μl,10×酶切缓冲液7.4μl,ddH2O补足总体积至20μl。混匀,37℃水浴过夜。1.5%琼脂糖凝胶电泳(1×TBE缓冲液,电压90V电泳50min),验证酶切是否彻底,同时比较各菌株酶切后的电泳图。
7.核苷酸序列测定:利用PCR-RFLP分析不同基因型菌株中,各选择4个扩增样本委托北京博迈德科技有限公司进行纯化和测序。序列进行同源性分析,并与Genebank序列比较。利用DNAMAN和DNAStar软件分析序列结果的变异位点。
8.统计学方法:采用SPSS17.0软件进行分析,对变链菌不同WIG合成能力菌株的基因型分布情况用双侧χ2检验。
结 果
1.DNA定量:抽提的变链菌临床分离株全菌基因组DNA浓度为500~700μg/mL,共获得的纯化基因组30~50μg的纯化基因组DNA。所有实验菌株OD260nm/OD280nm比值均在1.7~1.9之间。说明抽提产物无蛋白质、酶污染。
2.PCR扩增产物电泳结果
(1)gtfB PCR扩增产物电泳结果
以变链菌全菌基因组DNA为模板,扩增出5.2kb的目的片段。扩增产物电泳结果为单一条带,未见任何杂带,表明扩增特异性较高(图1)。

图1 变链菌临床分离株gtfB5226bp基因扩增
2.gtfC PCR扩增产物电泳结果
以变链菌全菌基因组DNA为模板,扩增出的目的片段为4.3kb。扩增出的PCR产物电泳结果表现为单一的条带,未见任何杂带,表明扩增的特异性较好(图 2)。
3.酶切结果分析
(1)变链菌临床分离株gtfB5226bp酶切结果分析:变链菌临床株的扩增产物经BsrⅠ酶切后在3%琼脂糖凝胶上共呈现出3种基因型:A型、B型、C型(图3)。A型、B型酶切后有5条片段,C型有4条片段。3种基因型在高、低黏附能力菌株中所占比例见表1。合成WIG高组以A型为主,合成WIG低组以B型为主。C型在两组中所占比例均较小。经双侧检验可以看出,合成水不溶性葡聚糖能力不同菌株基因型构成比不同,差异具有统计学意义(P<0.05)。
(2)变链菌临床分离株gtfC4337bp酶切结果分析:变链菌临床分离株的扩增产物经SsPⅠ酶切后在3%琼脂糖凝胶上共呈现出2种基因型:A型、B型。A型、B型酶切后有3条片段(图4)。2种基因型在合成水不溶性葡聚糖能力不同的菌株中所占比例见表2。合成WIG高组与低组均以A型为主。经双侧检验表明,合成WIG能力不同的菌株基因型构成比无统计学意义(P>0.05)。
4.变链菌gtfB基因DNAStar、DNAMAN软件分析

图2 变链菌临床分离株gtfC4337bp基因扩增
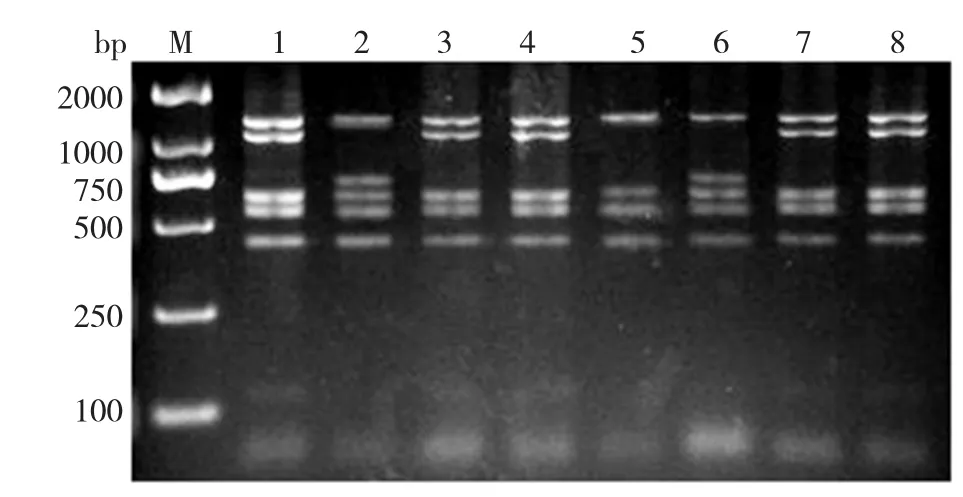
图3 变链菌临床分离株gtfB5226bp被BsrⅠ酶切后的PCR-RFLP类型

表1 合成水不溶性葡聚糖较高组和较低组变链菌gtfB5226bp的基因型分布
经DNAStar、DNAMAN软件分析2种基因型菌株gtfB基因测序结果,A基因型有6个酶切位点,电泳后表现为5条片段,B基因型有4个酶切位点,酶切消化后电泳表现为4条片段,限制性内切酶BsrI可以识别5‘-ACTGGN↓-3’的片段,B基因型1422bp位点碱基由A→G,导致1419~1424bp片段由 5‘-ACTAGC-3’突变为 5‘-ACTGGC↓-3’而产生B基因型。所有菌株之间以及与Genebank序列比较,同源性达到98%~99%。

图4 变链菌临床分离株gtfC4337bp被SsPⅠ酶切后的PCR-RFLP类型

表2 合成水不溶性葡聚糖较高组和较低组变链菌gtfC4337bp的基因型分布
讨 论
变异链球菌的毒力因子表现在黏附作用,合成胞外多糖能力以及产酸和耐酸作用。变链菌可以利用食物中的蔗糖产生胞外多糖(extracellular polysaccharides,EPS),促进细胞间的粘附和包膜形成,研究证实龋病的发生与胞外多糖(EPS)含量的升高和持续的低pH环境相关[5]。Mattos等[6]发现乳牙龋齿的发病率与变链菌合成的水不溶性葡聚糖含量呈正相关的结果。杨江华等[7]发现部分高龋菌株合成水溶性葡聚糖与水不溶性葡聚糖的量均高于其他菌株,中龋组和无龋组同样有个别菌株合成胞外多糖的能力高于其他菌株。同时所有菌株合成水溶性葡聚糖的量均多于水不溶性葡聚糖的量。水溶性葡聚糖的主要作用是作为细菌胞外能源仓库及底物,而水不溶性葡聚糖则具有很强的黏性,在细菌黏附过程中起着很重要的作用。前期研究推测维吾尔族易患龋儿童在生物膜状态下,变链菌产生大量黏性多糖,促进致病菌的黏附于聚集,加速代谢,引发龋病。EPS的合成能力可以从一个侧面反映菌株致龋性的差异。
以水不溶性葡聚糖为主的胞外多糖具有很强的黏性,可以促进细菌在牙齿表面的黏附,并影响生物膜的物理和化学性质,对牙菌斑生物膜结构的完整性起到了很大的作用[8]。该多糖是由蔗糖作为主基板通过细菌的Gtfs和Ftfs合成的。变形链球菌产生三个Gtfs,其中包括合成α(1,3)-水不溶性葡聚糖(GtfB 和 GtfC)和 α(1,6)水溶性葡聚糖(GtfC 和GtfD),以及 FTF,产生的 β(2,1)果聚糖。GtfB 和GtfC已被证明是龋齿发病机制中的重要致病因素。变链菌与其他自由存在的细胞有很大不同,主要是以生物膜粘附的方式存在。生物膜的形成可以加强保护细胞在恶劣的环境中生存。变链菌在牙齿表面形成了极为多样的高密度细胞生物膜,这些细菌与龋病的形成有密切的关系。以往的研究中,多为gtfBC片段的扩增,包括gtfB的大部分以及gtfC的上游部分,认为其编码产物主要影响水不溶性葡聚糖的合成。林焕彩等[9]利用限制性内切酶HinfI,TaqI,MboI对gtfBC基因片段进行酶切分析,与标准株UA159对比发现HinfI,TaqI酶切位点出现特异性,而MboI酶切图谱未发现差异。而高龋儿童和无龋儿童的酶切片段差异无统计学意义。可能是两组儿童患龋情况与这三个酶切位点不重叠。Renata等[4]对76株儿童变链菌临床分离株通过限制性内切酶BsrI和SsPI分别对gtfB,gtfC基因片段进行酶切分析,发现gtfB酶切后出现10种基因型,酶切图谱表现出7至8条片段;gtfC出现5种基因型,有3至5条片段。推测合成葡聚糖能力的高低以及形成生物膜的能力可能与这两种基因的多态性有密切的关系。本实验中同样运用限制性内切酶BsrI和SsPI对gtfB,gtfC基因进行酶切消化,gtfB出现3种基因型,分别有4条或者5条片段组成。合成水不溶性葡聚糖较高组以A型为主,合成量低组以B型为主,两组菌株C型所占比例均较少。这3种基因型在两组间分布差异具有统计学意义。限制性内切酶BsrI可以识别 5‘-ACTGGN↓-3’的片段,通过测序,发现gtfB基因在1422bp的位点上发生了基因突变,形成了5‘-ACTGGC↓-3’的酶切片段,从而形成了B基因型,其对水不溶性葡聚糖的合成可能会起到减低作用,可能会在一定程度上影响菌株的致龋能力。限制性内切酶SsPI可以识别5‘-AAT↓ATT-3’的片段,gtfC经SsPI酶切后出现2种基因型,均表现出三条片段。合成水不溶性葡聚糖较高组与较低组均以A型为主。这2种基因型在两组菌株中的构成不具有统计学意义。由此,证实了gtfB的基因多态性与其合成水不溶性葡聚糖的能力有相关性。而gtfC基因所表现出来的多态性在两组菌株的构成比例基本相似,没有明显的差别。推测维吾尔族儿童的水不溶性葡聚糖的合成可能与gtfB基因之间存在着更加密切的关系。对于gtfC基因的多态性与水不溶性葡聚糖合成的关系同样值得继续关注,可能在扩大样本量的研究当中会有更加详尽的结果出现。本实验与Renata的研究结果相差较大,分析原因可能与研究人群的差异较大有密切关系,我们研究的维吾尔族儿童在这两个酶切片段内可能存在更多的保守区域,考虑今后扩大样本含量继续分析差异的来源。

