鞘内注射HDAC抑制剂增加持续性术后痛大鼠脊髓TNF-α的含量*
胡兴国 宋立娟 张励才
(1湖南省桃源县人民医院麻醉科,桃源415700;2山东省滨州医学院附属医院麻醉科,滨州256600;3徐州医科大学江苏省麻醉学重点实验室&江苏省麻醉与镇痛应用技术重点实验室,徐州221004)
持续性术后痛(persistent postoperative pain)又称术后慢性疼痛(chronic postsurgical pain),严重影响手术病人的预后和生活质量,但其形成和维持的确切机制尚不清楚[1,2]。明确其机制对制定防治措施有重要意义。Flatters[3]提出的大鼠皮肤肌肉切口和牵拉(skin/muscle incision and retraction, SMIR)术后持续性痛模型,其操作过程模拟了临床外科手术操作,是一种探讨持续性术后痛机制和治疗的新手段。研究证实肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)是神经损伤和神经炎症过程早期释放的重要致炎因子,在炎性痛和神经病理性痛的产生中起核心作用[4,5]。组蛋白乙酰化修饰是一种重要的表观遗传现象,这种修饰可改变基因活性,调控基因表达。组蛋白乙酰化水平升高可使染色体结构松解,促进基因转录表达。有研究表明,炎性痛、神经病理性痛及切口痛均存在组蛋白乙酰化水平的异常[6,7]。在炎性痛、神经病理性痛模型中全身性或鞘内给予组蛋白去乙酰化酶(histone deacetylase, HDAC)抑制剂具有确切的镇痛作用和增强阿片类药物的镇痛效应[7]。本课题组前期研究表明脊髓TNF-α和组蛋白乙酰化也参与了大鼠皮肤/肌肉切口和牵拉(skin/muscle incision and retraction, SMIR)持续性术后痛的形成和维持[8~10]。但组蛋白乙酰化对持续性术后痛时脊髓TNF-α的影响仍不清楚,因此本研究拟通过给予HDAC抑制剂,评价组蛋白乙酰化对持续性术后痛时脊髓TNF-α含量的调控作用。
方 法
1.主要试剂与仪器
辛二酰苯胺异羟肟酸(SAHA,Sigma公司,美国),曲古霉素A(TSA,Sigma公司,美国),TNF-α酶联免疫吸附法(ELISA)试剂盒(上海依科赛公司),IITC电子镇痛测试仪(IITC Life Scienc公司,美国)。
2.实验动物
清洁级健康雄性SD大鼠,体重200~250 g,2月龄,由徐州医科大学实验动物中心提供。安静环境,室温19~25℃,昼夜交替,自由获取水和食物,适应环境1周后开始实验。本实验均遵从国际疼痛学会相关指南,以尽量减少实验动物数目及对实验动物的伤害为原则,并经徐州医科大学实验动物伦理委员会的许可。
3.鞘内置管
采用改良腰部鞘内置管法行鞘内置管[11]:大鼠水合氯醛400 mg/kg 腹腔注射麻醉后取俯卧位,摸清两侧髂棘连线为L6,背部剃毛消毒后在L5-6间隙处作长约为2.5 cm的皮肤纵切口,切开该处背棘肌筋膜,分离L6棘突两侧肌肉,切除部分L6棘突以暴露L5与L6棘突间隙,用小针穿破硬膜可见甩尾,夹取PE-10导管沿穿刺孔插入可见甩尾,置入约1.5 cm,可见脑脊液流出或注入生理盐水可见水回流。封背部外露约2 cm固定。于置管后1 d取无运动障碍的大鼠鞘内注射2%利多卡因20 μl,注药后30 s内未出现双下肢麻痹的剔除本研究。
4.大鼠SMIR持续性术后痛模型的建立
按Flatters法[3]建立大鼠SMIR持续性术后痛模型。水合氯醛400 mg/kg腹腔注射麻醉后仰卧位固定,在大腿中部隐静脉内侧4 mm处做一长1.5~2 cm的皮肤切口暴露腿部肌肉,然后于浅层肌肉(股薄肌)做一长7~10 mm切口,钝性分离浅层肌肉,见白色的内收肌群筋膜后,切口内置入显微牵开器。将牵开器尖头置入浅层肌肉下后拉开皮肤肌肉至2 cm,暴露内收肌群筋膜,持续牵拉1 h。在牵拉过程中,隐神经被牵开器拉伸并移位,但由于其处于肌肉表层并没有受坚硬物体如骨头等的压迫。牵拉期间大鼠切口处给予无菌生理盐水纱布覆盖保湿并保温,1 h后缝合皮肤肌肉,手术后常规给予抗生素抗感染治疗。
5.动物分组
选择鞘内置管成功的SD雄性大鼠64只,采用随机数字表法随机分为8组(n= 8):假手术+人工脑脊液(artificial cerebrospinal fluid, ACSF)组(Ⅰ组),假手术+溶媒二甲基亚砜(dimethyl sulfoxide,DMSO)组(Ⅱ组),假手术+辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)组(Ⅲ组),假手术+曲古菌素 A(Trichostatin A, TSA)组(Ⅳ组),SMIR + ACSF组(Ⅴ组),SMIR + DMSO组(Ⅵ组),SMIR + SAHA组(Ⅶ组)和SMIR+TSA组(Ⅷ组)。Ⅰ-Ⅳ组行假手术,Ⅴ-Ⅷ组采用Flatters法制备大鼠SMIR持续性术后痛模型。Ⅰ组和Ⅴ组大鼠于术前1,2,3,4 d及术后1 d每天鞘内注射(i.t.)ACSF 20 μl一次;Ⅱ组和Ⅵ组,Ⅲ组和Ⅶ组,Ⅳ组和Ⅷ组于术前1,2,3,4 d及术后1 d每天分别i.t.DMSO (10 μl),SAHA (50 μg, 10μl)或 TSA (2 μg,10 μl),并在每次注药后经导管给予 ACSF 10 μl冲洗导管。
6.机械缩足反应阈(MWT)的测定
于术前1 d (T0)、术后1、3、7、14和21 d (T1-5)时,参照文献[12]介绍的方法测定MWT。将有机玻璃箱(28 cm×14 cm×16 cm)置于金属筛网上,大鼠放入玻璃箱中,适应30 min后,用电子麻醉镇痛测试仪垂直刺激大鼠术侧后肢足底中部,逐渐增加刺激强度直至发生缩足反应,仪器自动记录压力值,重复测量5次,每次间隔5 min,取平均值即为MWT。
7.ELISA法检测脊髓TNF-α含量
T4时MWT测定完毕后,每组随机取4只大鼠,水合氯醛 400 mg/kg麻醉,迅速断头处死取脊髓腰膨大节段,称重,按比例加入组织裂解液(100 mg组织加0.4 ml裂解液)。将标本匀浆充分,4℃下14 000 g/min × 10 min离心,收集上清液,在-80℃保存。根据ELISA试剂盒中说明书操作,波长为450 nm,参考波长为620 nm处,用酶标仪测定光密度,根据标准曲线算出TNF-α浓度。
8.统计学处理
应用SPSS 16.0软件进行统计学分析。计量资料以均数±标准差(±SD)表示,各组T1-5与T0值比较采用单因素方差分析;多组间比较采用多因素方差分析。检验水准为α = 0.05,P< 0.05为差异有统计学意义。
结 果
1.各组大鼠MWT变化
与T0比较,Ⅰ组大鼠在T1-5时MWT无明显变化(P> 0.05);与Ⅰ组和T0比较,Ⅱ-Ⅳ组大鼠在T1-5时MWT无统计学差别(P> 0.05),Ⅴ-Ⅷ组大鼠在T2-5时MWT明显下降(P< 0.05);与Ⅴ组比较,Ⅶ-Ⅷ组大鼠在T3-5时MWT明显升高(P均 < 0.05);Ⅴ组与Ⅵ组,Ⅶ组与Ⅷ组分别比较,MWT无统计学差异(P> 0.05,见表1)。
2.各组大鼠脊髓TNF-α含量的变化
与Ⅰ组比较,Ⅱ-Ⅳ组大鼠在T4时脊髓TNF-α含量无明显差别(P> 0.05),Ⅴ-Ⅷ组大鼠在T4时脊髓TNF-α含量明显升高(P< 0.05);与Ⅴ组比较,Ⅶ-Ⅷ组大鼠在T4时脊髓TNF-α含量明显下降(P< 0.05);Ⅴ组与Ⅵ组,Ⅶ组与Ⅷ组分别比较,脊髓TNF-α含量无统计学差异(见表2)。
讨 论
本研究参照文献[3,13]介绍的方法制备大鼠持续性术后痛模型,结果表明,Ⅴ组T2-4时MWT较Ⅰ组明显降低,提示模型制备成功。本研究参照文献[14,15]及预实验结果,选择鞘内注射羟肟酸类组蛋白去乙酰化酶抑制剂辛二酰苯胺异羟肟酸或曲古菌素 A以及其剂量和给药时点。参照本课题组前期研究显示在SMIR术后12~14 d时大鼠机械性痛觉过敏最为明显[9,10],选择T4时检测脊髓TNF-α含量。
表2 各组大鼠在T4时脊髓TNF-α含量的比较(pg/ml,n = 4,±SD)Table 2 Comparison of the concentration of TNF-α in the spinal cord of rats among different groups at T4(pg/ml, n = 4,±SD)
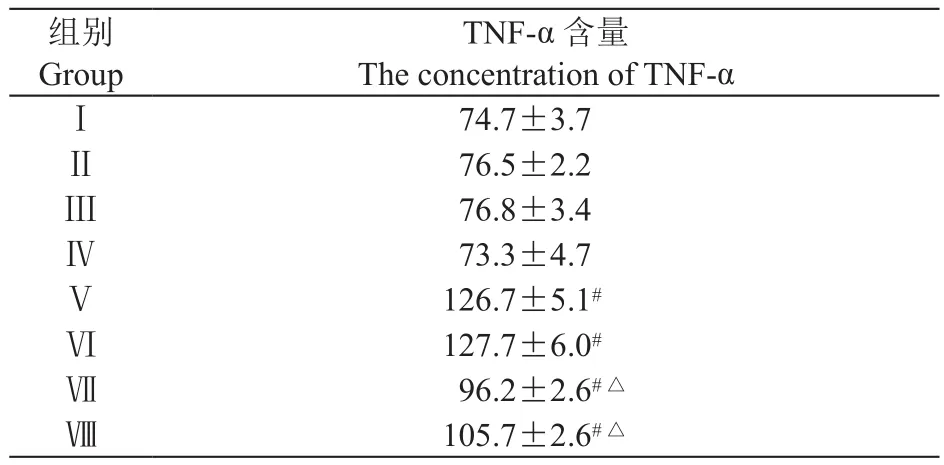
表2 各组大鼠在T4时脊髓TNF-α含量的比较(pg/ml,n = 4,±SD)Table 2 Comparison of the concentration of TNF-α in the spinal cord of rats among different groups at T4(pg/ml, n = 4,±SD)
#P < 0.05,与Ⅰ组比较,compared with group Ⅰ; △P < 0.05,与Ⅴ组比较,compared with groupⅤ.
TNF-α 含量The concentration of TNF-αⅠ74.7±3.7Ⅱ76.5±2.2Ⅲ 76.8±3.4Ⅳ73.3±4.7Ⅴ126.7±5.1#Ⅵ127.7±6.0#Ⅶ96.2±2.6#△Ⅷ105.7±2.6#△组别Group
表1 各组大鼠MWT的比较(g,±SD)Table 1 Comparison of the MWT in each group of rats (g,±SD)

表1 各组大鼠MWT的比较(g,±SD)Table 1 Comparison of the MWT in each group of rats (g,±SD)
*P < 0.05,与 T0比较,compared with T0 ; #P < 0.05,与Ⅰ组比较,compared with group Ⅰ; △P < 0.05,与Ⅴ组比较,compared with group Ⅴ.
(n = 4)Ⅰ58.5±3.4 60.8±1.8 60.4±2.1 61.0±2.1 62.0±1.5 58.0±3.3Ⅱ59.8±2.8 58.7±3.7 57.5±4.0 57.8±4.2 58.5±3.3 59.6±2.5Ⅲ58.2±3.0 58.0±2.7 57.1±1.6 57.6±1.4 57.4±3.1 61.1±3.2Ⅳ60.4±1.2 58.9±3.3 58.6±2.7 57.1±2.8 59.4±2.2 60.9±2.7Ⅴ59.7±2.8 61.2±1.6 50.3±2.8*# 34.3±1.5*# 29.6±1.8 *# 46.9±2.9*#Ⅵ 58.4±1.7 59.4±2.2 47.4±1.6*# 35.9±2.4*# 28.3±2.4*# 46.3±2.7*#Ⅶ 59.1±2.0 58.3±1.6 48.7±1.2*# 42.1±1.6*#△ 34.5±1.5*#△ 50.7±1.7*#△Ⅷ 60.4±2.2 61.3±1.7 46.7±2.6*# 39.9±1.5*#△ 36.1±2.1*#△ 51.3±2.8*#△组别Group T0T1T2T3T4T5(n = 8)(n = 8)(n = 8)(n = 8)(n = 8)
为了均衡容量、压力、溶媒二甲基亚砜和辛二酰苯胺异羟肟酸及曲古菌素对实验结果的影响,本研究设置Ⅰ-Ⅳ组,结果表明,Ⅰ-Ⅳ组MWT、脊髓TNF-α含量无差异。可通过检测MWT和(或)热缩足反射潜伏期(PWL)反映持续性术后痛程度。Flatters[3]及本课题组前期研究[12]表明,SMIR制备持续性术后痛模型大鼠术后出现机械刺激痛觉过敏,而PWL在术后各时点无差异。故本研究仅检测MWT。
神经元和胶质细胞均可分泌TNF-α。研究证实TNF-α在疼痛中枢敏感化形成中具有重要作用[5]。中枢或外周给予TNF-α均可引起大鼠痛觉过敏和痛觉超敏,能促进前列腺素(PGs)、一氧化氮(NO)以及P物质等大量伤害性递质或调质的释放和表达;在外周和中枢神经损伤引起的神经病理性痛模型中,脊髓背角及损伤部位TNF-α和TNF受体1显著上调。在角叉菜胶和酵母多糖诱导的胸膜炎大鼠炎症模型,发现TNF-α在激活其他细胞因子(尤其是IL-1β,IL-6和IL-8)级联反应中起带头作用[16]。本课题组前期[8]的研究发现,大鼠SMIR术后第7 d脊髓TNF-α含量明显增加,术后第12 d达到高峰,并持续到术后第22 d,与SMIR术后MWT变化基本一致,表明TNF-α的变化与大鼠SMIR持续性术后痛的发生发展有关,进一步证实了脊髓TNF-α的增加参与了大鼠SMIR持续性术后痛的形成。
研究显示在慢性疼痛状态,影响伤害感受性基因表达的表观遗传学因素包括:组蛋白乙酰化、DNA甲基化、非编码RNA以及染色质重塑,其中组蛋白乙酰化在病理性疼痛产生和维持过程中起重要作用[17]。在大鼠坐骨神经分支损伤(spared nerve injury, SNI)以及脊神经结扎(spinal nerve ligation,SNL)神经病理性痛模型中均发现脊髓背角HDAC表达上调,乙酰化组蛋白3 (Ac-H3)的表达下调,其改变与热痛觉过敏的发生相一致[18,19]。在大鼠完全弗式佐剂(complete freund's sadjuvant, CFA)炎性痛模型的研究中也发现大鼠脊髓背角HDAC表达上调[18]。研究还发现在炎性痛、神经病理性痛模型中全身性或鞘内给予HDAC抑制剂具有确切的镇痛作用和增强阿片类药物的镇痛效应[7,20],提示组蛋白的乙酰化调节在神经病理性痛和炎性痛的发展和维持中发挥重要的作用。本课题组前期[9]的研究结果显示,SMIR持续性术后痛组大鼠术后3 d时形成痛觉过敏,持续至术后21 d,并开始缓解,同时脊髓Ac-H3或Ac-H4术后3 d时表达水平明显下调,术后21 d时表达开始上调,提示大鼠术后脊髓脊髓背角组蛋白乙酰化水平降低。本研究表明,与Ⅰ组比较,Ⅴ组大鼠在发生机械性痛觉过敏的同时,TNF-α含量明显升高,而鞘内给予HDAC抑制剂SAHA或TSA后,在减轻SMIR引起的机械性痛觉过敏的同时,能部分逆转SIMR引起的脊髓TNF-α含量的升高,进一步证实了脊髓TNF-α生成增加与SMIR持续性术后痛的发生有关,而持续性术后痛时脊髓TNF-α含量升高部分与组蛋白乙酰化异常调节有关,持续性术后痛引起的脊髓TNF-α含量升高还存在其它方面的机制。
综上所述,鞘内给予HDAC抑制剂对持续性术后痛具有镇痛作用,持续性术后痛时脊髓TNF-α含量增加可能与组蛋白乙酰化异常调节有关。

