荧光材料La2O3:Eu的制备及表征
金梦蝶,吕芳莹,胡 强,王蒙蒙,刘 琳,李可心
(赤峰学院 化学化工院,内蒙古 赤峰 024000)
1 前言
我国的稀土储量居世界第一,因此稀土作为我国能源的一个重要来源,多年来稀土化合物的发光性能研究一直受到重视.稀土化合物在如今的化学领域具有十分长远的研究意义,是发光材料的一个重要来源,并且稀土化合物具有其高效的物理、化学性能,因此也应用于高分子材料.不仅如此,稀土化合物在科研领域涉及冶金、农业、医学、石油化工等各个行业,故稀土化合物在如今的社会发展中有着重大意义.
合成稀土化合物的方法有很多中,其中张曼在《水热合成三棱柱形Y2O3:Eu及发光性质研究》、潘小青等在《稀土发光材料的水热法合成及其发光强度》等文章中都提及到一种方法,即水热法[1-4].它因为操作简单、可控制其组成及其纯度的优点,因此成为合成稀土金属化合物的一个重要实验方法.水热法指以水溶液为体系,在一个密闭反应器中,将体系加热,使其在高温高压下反应,进而制备材料.李强等学者在无机材料学报发表的《纳米Y2O3:Eu3+的荧光特性》以及朱国贤等发表的《YF3:Eu3+的水热合成和发光性质》都提及到稀土金属铕[5-6],将铕掺杂氧化镧纳米荧光材料的合成条件,王雪娇等在《铕掺杂氧化镧纳米荧光材料的水热合成及性能表征》[7]中也提及到.结果需要通过红外光谱、荧光光谱分析等方式对产物进行表针.莎仁等在《球形La2O3:Eu纳米晶的制备及其发光特性》中提及球形La2O3:Eu纳米晶[8-10]具有独特的发光性能,因此在研究该化合物制备过程中,对最佳反应条件的探究显得尤为重要,并最终得出最佳实验条件.
在探究稀土化合物La2O3:Eu合成过程中的最佳条件,应该采用控制变量法,从浓度、温度、pH值等方面入手,最终得到最佳的合成条件.本文是通过研究上述条件对稀土金属的合成的影响,进而得出最佳实验条件.
2 实验部分
2.1 实验仪器
电热恒温鼓风干燥箱,101FAB-1型,上海樹立仪器仪表有限公司;
马弗炉,SX2-4-13型,上海一恒科技有限公司;
傅立叶变换光谱仪,IS5型;
荧光分光光度计,F96型;
800离心机,上海宇隆仪器有限公司;
pH计,PHS-2F型,上海仪电科学仪器股份有限公司;
粉末压片机,FW-4A型,天津市拓普仪器有限公司;
石英比色皿,上海海光光学元件厂;
恒温调温磁力搅拌电热套,山东省菏泽市祥龙电子科技有限公司;
电子天平,TP-214型,北京赛多利斯仪器系统有限公司;
20mL反应釜若干;
以及100mL容量瓶2个 量筒1个 1mL移液管 2mL移液管 玻璃棒 滴管 针管 坩埚钳 烧杯若干 坩埚若干.
2.2 药品
氧化镧(La2O3)分析纯,瑞科稀土冶金及功能材料国家工程研究中心;
氧化铕(Eu2O3)分析纯,瑞科稀土冶金及功能材料国家工程研究中心;
硝酸溶液,含量(65%—68%),葫芦岛市渤海化学试剂厂;
氨水,分析纯,天津市河东区红岩试剂厂;
无水乙醇,分析纯,沈阳市华东试剂厂;
溴化钾,天津市河东区红岩试剂厂;
二次蒸馏水.
2.3 主要溶液的配制
2.3.1 硝酸镧的配制(0.2mol/L)
用分析天平称取氧化镧白色粉末3.2560克于小烧杯中,用少量硝酸将其溶解,待其成为无色透明溶液,将所得溶液全部倒入100mL容量瓶中,并用二次蒸馏水定容.
2.3.2 硝酸铕的配制(0.2mol/L)
称取氧化铕白色粉末3.5262克于小烧杯中,用硝酸将其溶解,并用电热套微热,使其变成无色透明溶液,将其全部倒入100mL容量瓶中,用二次蒸馏水将其定容.
2.4 合成La2O3:Eu的实验步骤
2.4.1 不同配比合成La2O3:Eu
分别取硝酸镧溶液3.00mL放入7个小烧杯中,再分别加入 0.20mL、0.30ml、0.50mL、0.60mL、0.70mL、0.90mL以及1.00mL硝酸铕与硝酸镧混合,加入10.00mL的二次蒸馏水,用氨性缓冲液将其pH调到10.50,并且搅拌10分钟(min),此时溶液呈现不同的浑浊程度.将搅拌后的溶液转移到反应釜中,并用二次蒸馏水洗涤烧杯,将其一并加入反应釜中.将反应釜放置于烘箱中,并且设置温度为180℃.12小时(h),将反应釜取出,待其自然冷却后,用离心机将溶液分别用二次蒸馏水和无水乙醇各洗涤三次,然后将产品倒入滤纸槽中,放入烘箱,调节烘箱温度为60℃.6h后,将产品转移到马弗炉中,设置温度为900℃,1h后取出,即得到La2O3:Eu.
2.4.2 不同pH环境合成La2O3:Eu
分别取4份3.00mL硝酸镧溶液和0.50mL硝酸铕溶液于4个小烧杯中,再分别加入10.00mL二次蒸馏水,用氨性缓冲溶液分别将混合溶液的pH值调节到 8.57、9.17、10.01 以及 10.45,并搅拌10min,此时溶液呈现不同的浑浊程度.将搅拌后的溶液转移到反应釜中,并用二次蒸馏水洗涤烧杯,将其一并加入反应釜中.将反应釜放置于烘箱中,并且设置温度为180℃.12h后,将反应釜取出,待其自然冷却后,用离心机将溶液分别用二次蒸馏水和无水乙醇各洗涤三次,然后将产品倒入滤纸槽中,放入烘箱,调节烘箱温度为60℃.6h后,将产品转移到马弗炉中,设置温度为900℃,1h后取出,即得到La2O3:Eu.
2.4.3 不同温度下合成La2O3:Eu
分别取3份3.00mL硝酸镧溶液和0.50mL硝酸铕溶液于3个小烧杯中,再分别加入10.00mL二次蒸馏水,用氨性缓冲溶液将混合溶液的pH值调节到10.45,并搅拌10min,此时溶液呈现相同的浑浊程度.将搅拌后的溶液转移到反应釜中,并用二次蒸馏水洗涤烧杯,将其一并加入反应釜中.将反应釜放置于烘箱中,并且设置温度为180℃.12h后,将反应釜取出,待其自然冷却后,用离心机将溶液分别用二次蒸馏水和无水乙醇各洗涤3次,然后将产品倒入滤纸槽中,放入烘箱,调节烘箱温度为60℃.6h后,将产品分别转移到3个马弗炉中,分别设置温度为 700℃、800℃、1000℃,1h后取出,即得到La2O3:Eu.
2.5 试样表征
2.5.1 不同配比的红外光谱检测
由于配比的不合适,硝酸镧3.00mL和硝酸铕0.20mL以及硝酸镧3.00mL和硝酸铕1.00mL所得产物量特别少,无法进行表征.剩余的五组分别取出如下量进行红外光谱的研究.
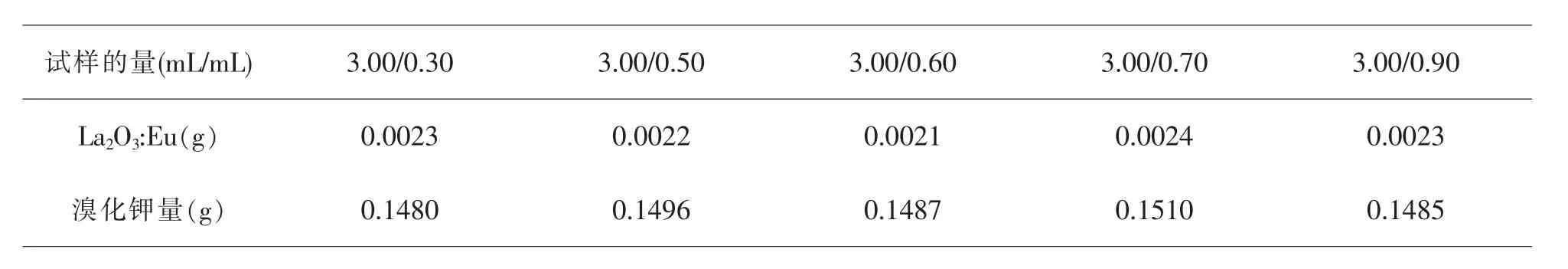
试样的量(m L/m L) 3.0 0/0.3 0 3.0 0/0.5 0 3.0 0/0.6 0 3.0 0/0.7 0 3.0 0/0.9 0 L a 2 O 3:E u(g) 0.0 0 2 3 0.0 0 2 2 0.0 0 2 1 0.0 0 2 4 0.0 0 2 3溴化钾量(g) 0.1 4 8 0 0.1 4 9 6 0.1 4 8 7 0.1 5 1 0 0.1 4 8 5
将产物和溴化钾混合后放入玛瑙研钵中研磨10min,然后将研磨后的产品在压片机上进行压片,将制成的片放入红外检测仪进行检测.
2.5.2 不同pH环境下的红外光谱检测
分别取出如下量进行红外光谱的研究.
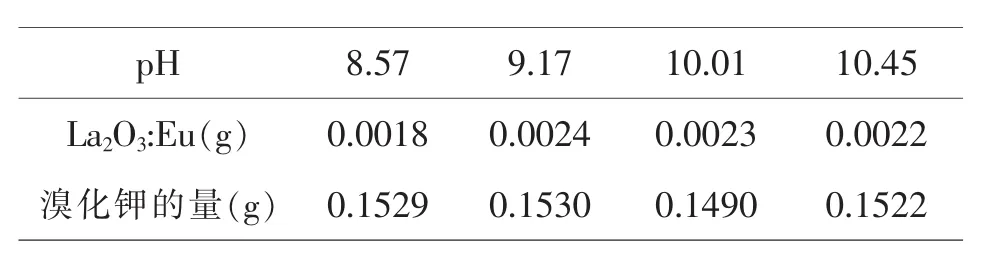
p H 8.5 7 9.1 7 1 0.0 1 1 0.4 5 L a 2 O 3:E u(g) 0.0 0 1 8 0.0 0 2 4 0.0 0 2 3 0.0 0 2 2溴化钾的量(g) 0.1 5 2 9 0.1 5 3 0 0.1 4 9 0 0.1 5 2 2
将产物和溴化钾混合后放入玛瑙研钵中研磨10min,然后将研磨后的产品在压片机上进行压片,将制成的片放入红外检测仪进行检测.
2.5.3 不同温度的红外光谱检测
分别取出如下量进行红外光谱的研究.
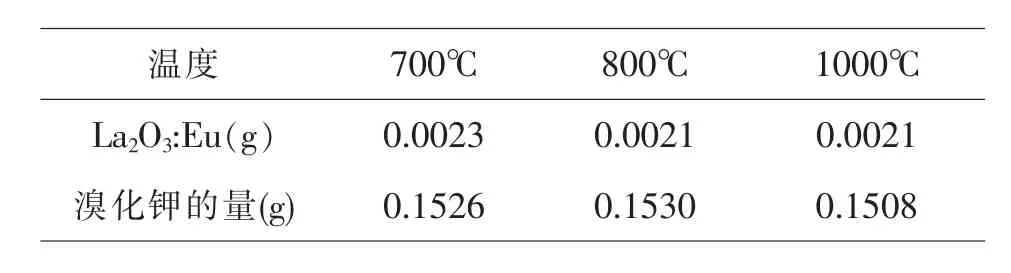
温度 7 0 0℃ 8 0 0℃ 1 0 0 0℃L a 2 O 3:E u(g) 0.0 0 2 3 0.0 0 2 1 0.0 0 2 1溴化钾的量(g) 0.1 5 2 6 0.1 5 3 0 0.1 5 0 8
将产物和溴化钾混合后放入玛瑙研钵中研磨10min,然后将研磨后的产品在压片机上进行压片,将制成的片放入红外检测仪进行检测.
2.5.4 荧光检测
取3.00mL硝酸镧溶液和0.50mL硝酸铕溶液于1个小烧杯中,再加入10.00mL二次蒸馏水,用氨性缓冲溶液将混合溶液的pH值调节到10.45,并搅拌10min,然后将此溶液转移到比色皿中,用可见分光光度计进行检测,波长范围为400-660nm.
3 实验结果与讨论
3.1 红外光谱图
3.1.1 不同配比的红外光谱图
首先讨论不同配比对生成物的影响,如下5幅图片分别是当硝酸镧为3.00mL硝酸铕分别为0.30mL、0.50mL、0.60mL、0.70mL、0.90mL 的红外谱图,如图1-5.
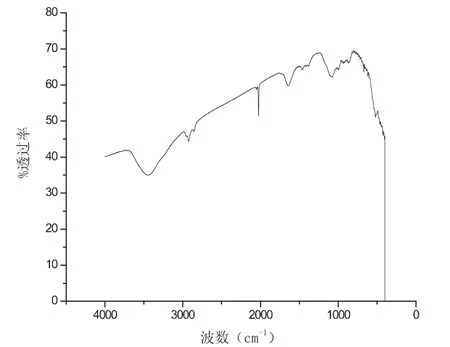
图1 镧铕比为10:1红外谱图
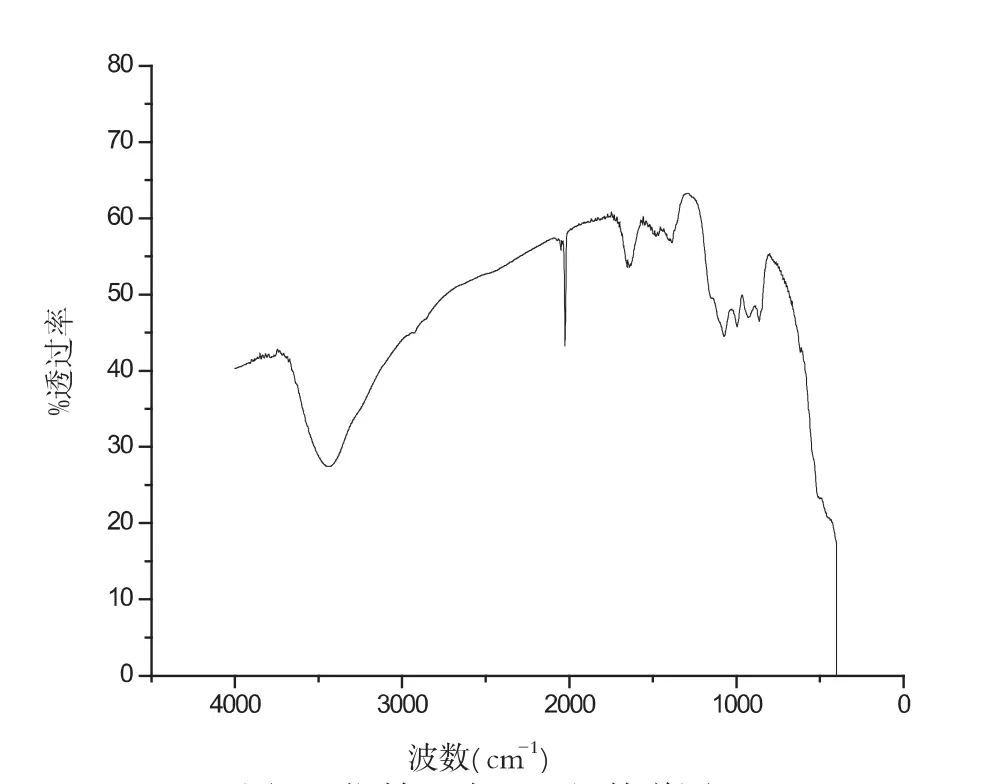
图2 镧铕比为6:1红外谱图
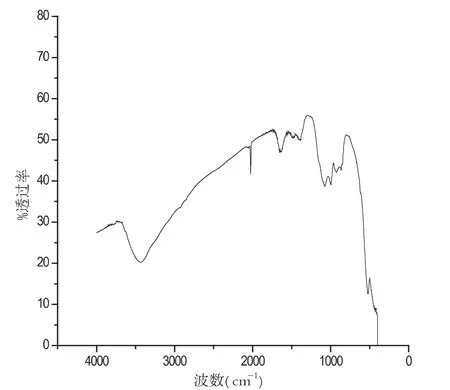
图3 镧铕比为5:1红外谱图
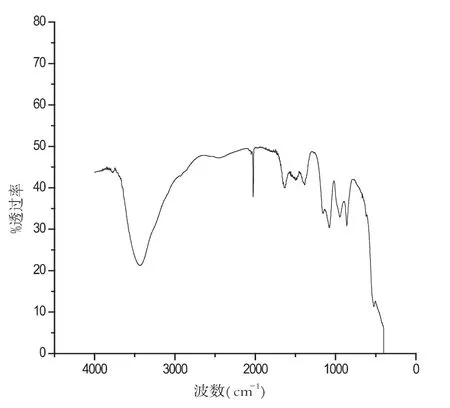
图4 镧铕比为4:1红外谱图
硝酸镧和硝酸铕的配比对样品的性质起着重要作用,从图1到图5分别是在pH、温度等其他实验参数保持不变的条件下,两种物质不同配比的红外谱图.对比几组红外谱图,分析在波数为2000cm-1和3500cm-1处的两组峰的峰型,可以得出当取硝酸镧3.00mL和硝酸铕0.50mL的时候,及当两种物质的配比为6:1时候,峰型最好,产品最好.
3.1.2 不同pH值的红外谱图
然后讨论不同pH值对生成物的影响,如下图6-9分别是当 pH 值为 8.57、9.17、10.01、10.45的红外谱图
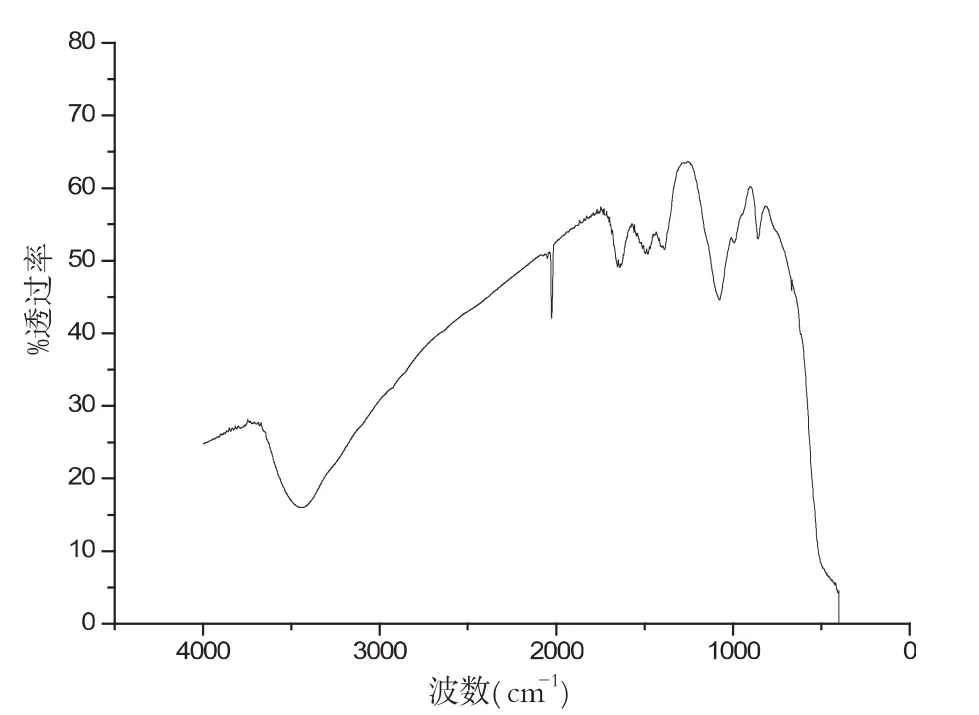
图5 镧铕比为3:1红外谱图
样品在不同pH环境下,其性质也不同,图6-9分别是在配比、温度等其他实验参数保持不变的条件下,样品在不同pH环境下的红外谱图,对比几组红外谱图,可以分析波数在2000cm-1和3500cm-1左右处的峰值,我们可以清晰地看出样品在pH为10.45时候,峰型最好.
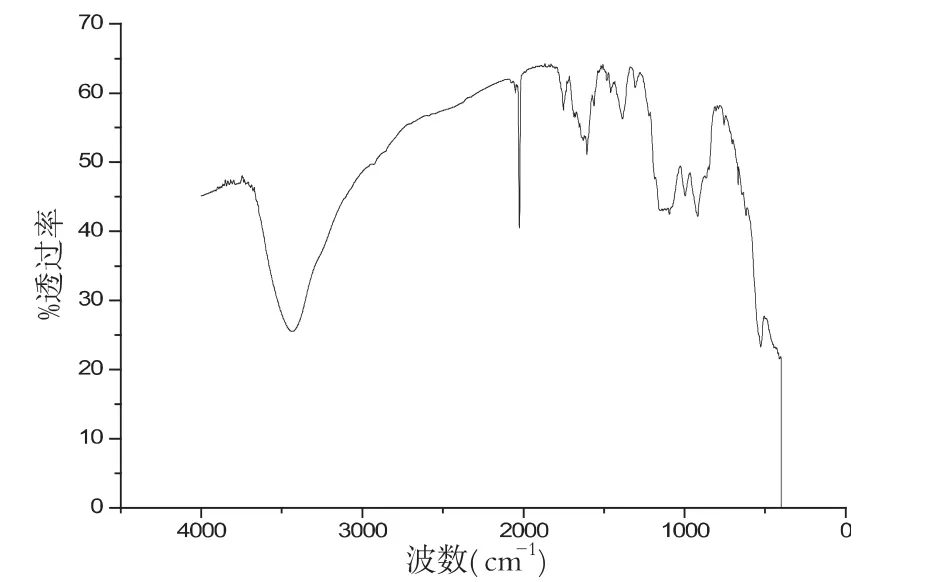
图6 pH值为8.57的红外谱图
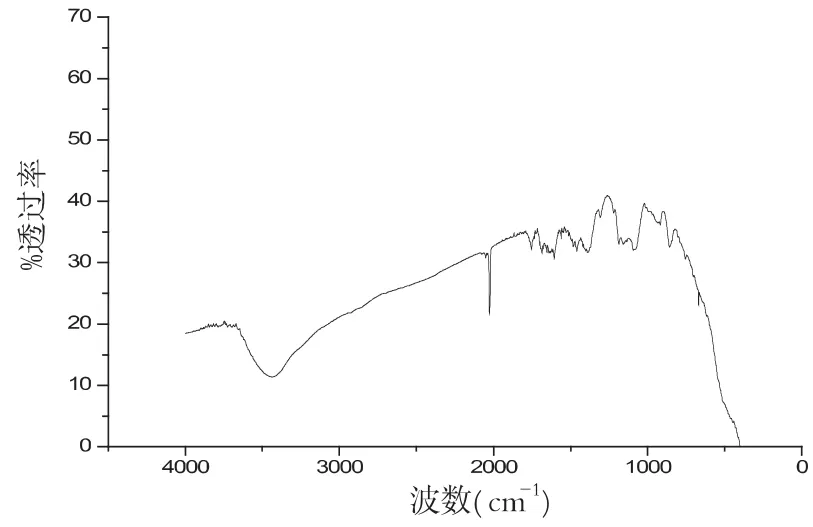
图8 pH值为10.01的红外谱图
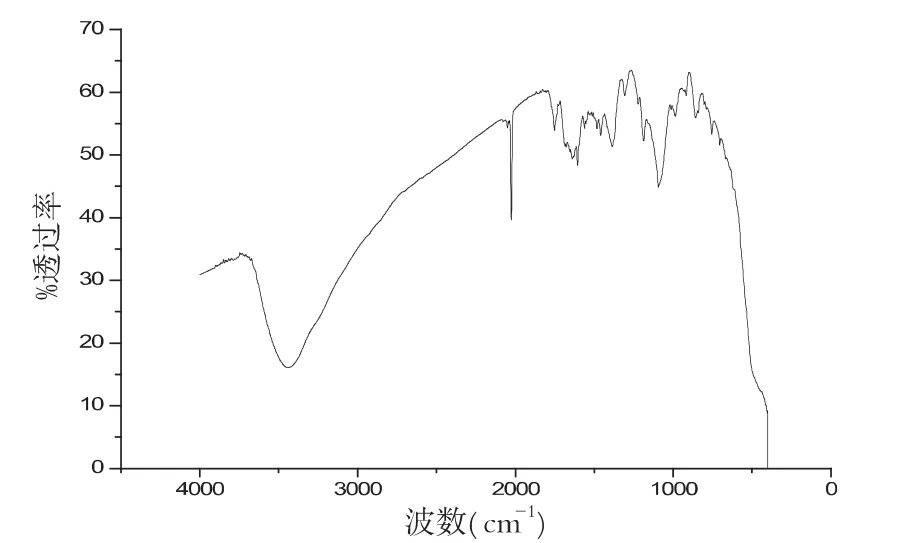
图9 pH值为10.45的红外谱图
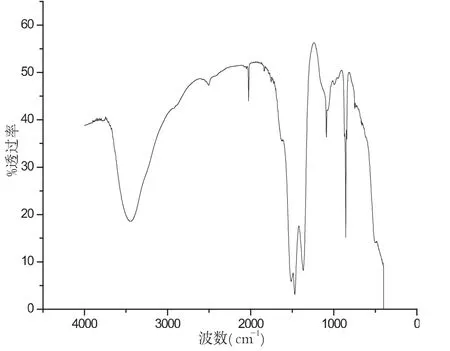
图10 温度为700℃红外谱图
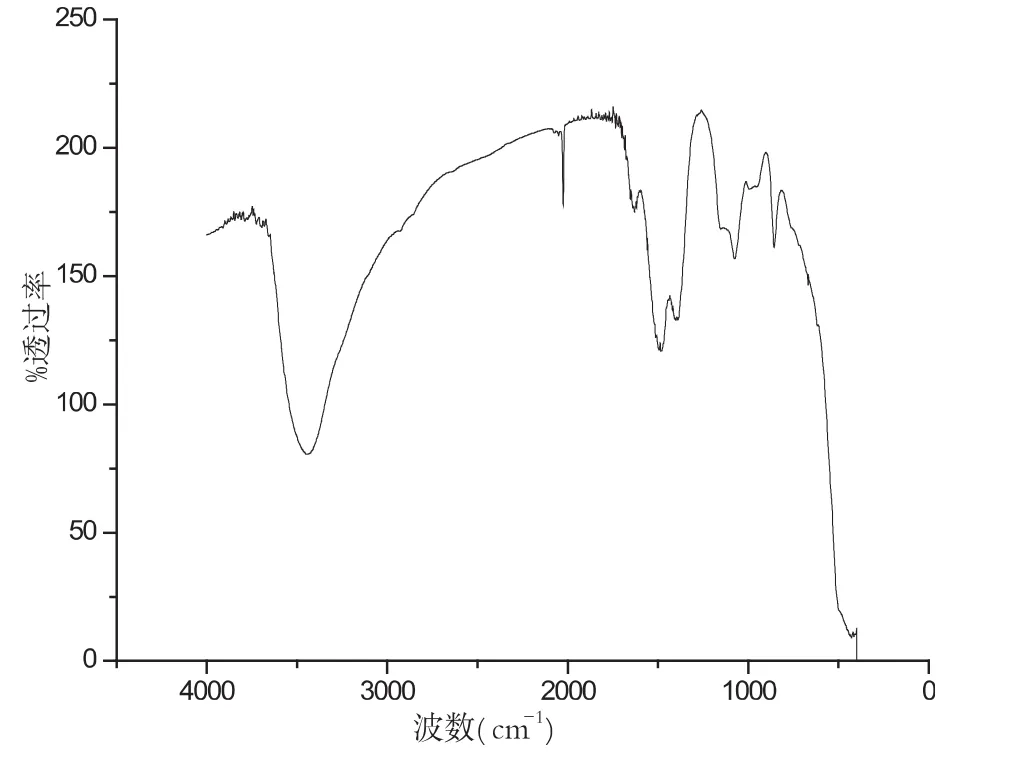
图11 温度为800℃红外谱图
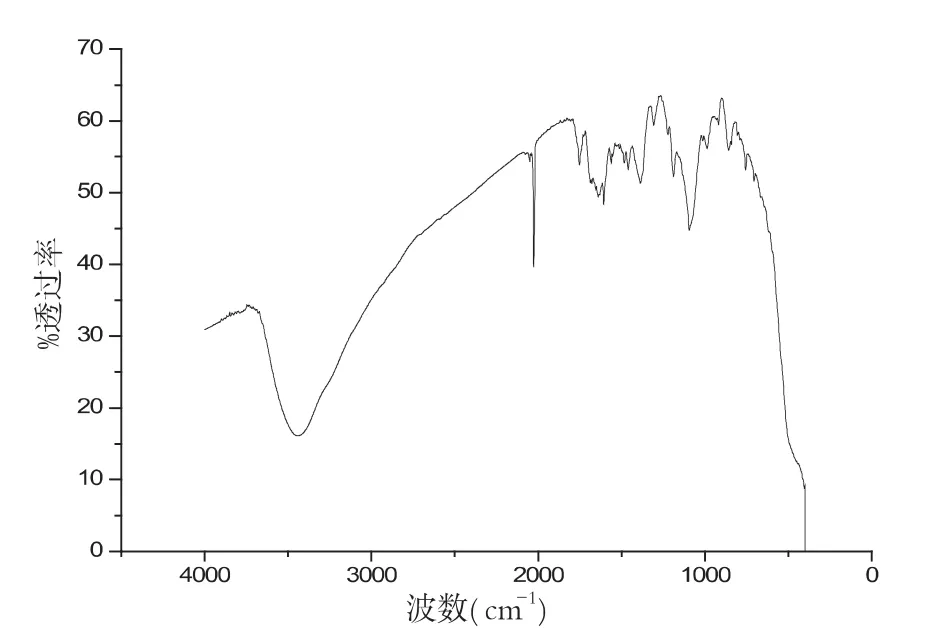
图12 温度为900℃红外谱图
3.1.3 不同温度的红外谱图
最后讨论不同温度对生成物的影响,图10-13分别是当温度为 700℃、800℃、900℃、1000℃时候的红外谱图.
样品在不同温度的条件下,其性质也不同,图10-13分别是在配比、pH值等其他实验参数保持不变的条件下,样品在不同温度条件下的红外谱图.对比几组红外谱图,可以分析波数在2000cm-1和3500cm-1左右处的峰值,我们可以清晰地看出样品在温度为900℃时候,峰型最好.
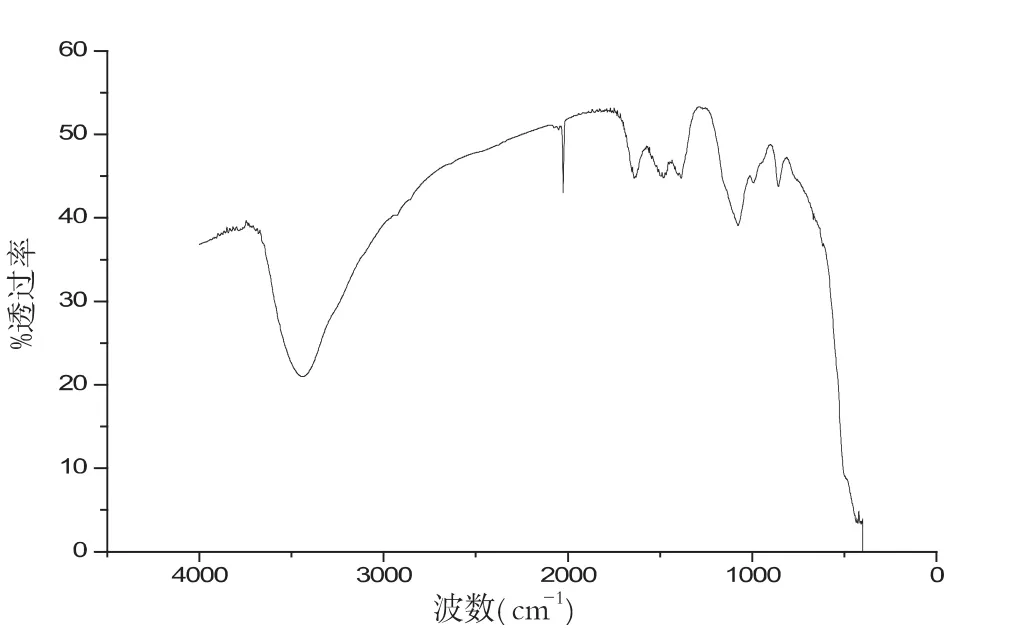
图13 温度为1000℃红外谱图
3.2 荧光光谱
在400-660nm波长范围内,对产物进行荧光谱图的分析结果如图14所示,可以发现产物La2O3:Eu是有荧光性的,并且在518nm处有明显的峰值.其发光源于Eu3+离子的4f电子能级间的跃迁.
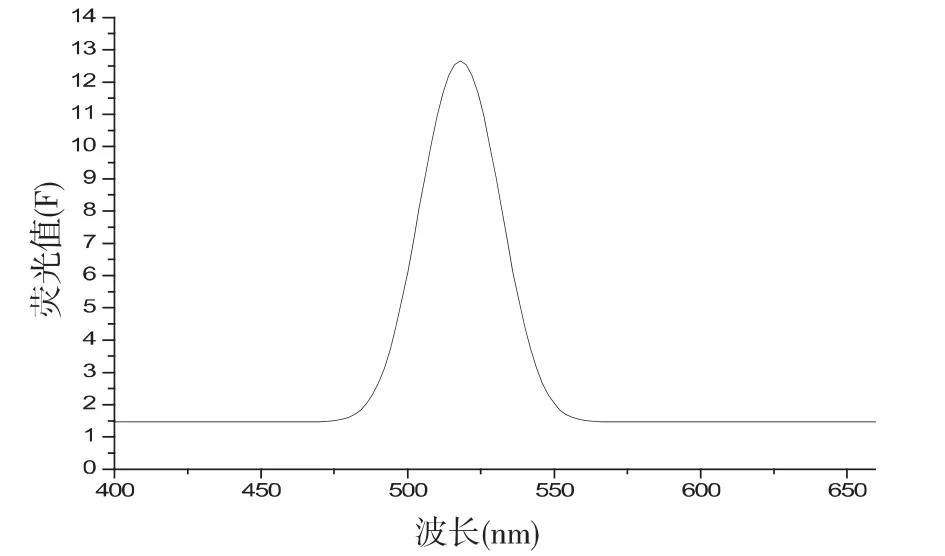
图14
4 实验结论
在制备La2O3:Eu的过程中,对实验条件进行探究.实验结果表明,反应物不同配比对产物有较大的影响,最终得出当硝酸镧和硝酸铕的配比为6:1、pH值为10.50、温度为900℃产品的红外光谱图最好.因此制备稀土化合物La2O3:Eu时候硝酸镧和硝酸铕的配比为6:1,pH值控制在10.50,温度控制在900℃所得产品最好.

