生物玻璃复合P-15多肽修复兔颅骨缺损的实验研究
王帅,李成库,周延民(.遵义医学院附属口腔医院科研科,贵州遵义563000;.吉林大学口腔医学院,吉林长春300)
大体积骨缺损仍是医学尚未解决的重大难题之一。自体骨移植仍被认为是修复骨缺损的“金标准”,然而其应用受到许多限制,如需开辟第二术区、手术时间长、引起供区损伤、可取骨量有限、植入后骨吸收等。近年来,异质移植材料及人工合成材料的研究应用取得了很大进展。已有许多生物活性蛋白与各类支架材料复合以提高人工骨替代材料成骨能力的文献报道[1-2];但蛋白与支架材料的吸附与缓释,以及重组蛋白的成本及活性问题等限制了其临床应用。而黏附肽类保留了相关蛋白中发挥生理作用的主要成分,参与了细胞生物力信号的传导,可促进细胞黏附、增殖、分化等,且空间构象相对固定,合成简单,P-15多肽就是其中的代表。
骨的有机成分中90%以上是由Ⅰ型胶原构成的,在其α1链上一段与间充质细胞结合且高度保守的15个氨基酸序列被称为P-15[3]。其能与各种前体细胞上的整合素受体结合,促进细胞黏附,释放生成因子,协同促进成骨细胞前体细胞的分化。携带P-15多肽的无机牛骨(PepGen P-15TM)在口腔上颌窦提升术[4]、牙周组织再生[5],以及同富血小板纤维蛋白合用于骨再生[6]多有文献报道,显示了这种骨替代材料一定的优越性。
生物玻璃是通过美国食品药品监督管理局认证的人工骨材料,其与体液接触后经一系列化学反应,在材料表面形成富含硅的凝胶层,在此表面磷酸钙聚集晶化形成碳酸羟基磷灰石,胶原和一些黏多糖也被吸附,新生的骨质层可与生物玻璃紧密结合在一起[7]。因此,本研究联合生物玻璃与P-15多肽各自的优点用于骨缺损动物模型的修复,为以仿生多肽为基础的生物材料的研究提供理论和实验基础。
1 材料与方法
1.1 材料
1.1.1 试剂 P-15序列为GTPGPQGIAGQRGVV,由生工生物工程(上海)股份有限公司合成;高效液相色谱法分析其纯度为96.28%,质谱图报告结果相对分子质量为1 393.58 D。生物玻璃购自北京国药前景公司,速眠新麻醉剂Ⅱ、陆醒宁通用名等由解放军军需大学提供,杜氏改良Eagle培养基购自美国Gibco公司,胎牛血清购自奥地利PAA公司,碱性磷酸酶(ALP)检测试剂盒购自南京建成生物工程研究所。
1.1.2 仪器 二氧化碳恒温细胞培养箱(日本三洋公司)、超净工作台(上海博讯医疗生物仪器股份有限公司)、倒置显微镜(OLYMPUS CKX41型)、GIOTTO钼靶软X线机(意大利IMS公司)、石蜡切片机(德国Letiz公司)、紫外分光光度仪U-2910(日本日立公司)等。
1.1.3 实验材料 选取Wistar大鼠10只(体重90.0~110.0 g)、5月龄雄性日本大耳白兔18只(体重2.1~2.8 kg),由吉林大学动物中心提供。
1.2 方法
1.2.1 细胞获取与培养 将Wistar大鼠采用速眠新麻醉剂Ⅱ进行局部麻醉,固定于木板上,放血处死。完整取下股骨至足部,去皮,于75%乙醇内浸泡5 min,全程保证大鼠骨骺段组织完整。在超净工作台上小心拧下股骨远心端,暴露干骺端,用20 mL注射器吸取约10 mL培养基,插入骨骺内抽取骨髓,边吸取边注入离心管内。胫骨给予相同处理。双下肢吸取完毕后用吹管吹打离心管内组织块,1 000 r/min离心5 min,轻轻吹打离心管底部沉淀制成细胞悬液,移至100 mm培养皿中,轻轻摇晃培养皿,使细胞及组织均匀分布,在倒置显微镜下观察细胞多层悬浮,置于37℃、含5%二氧化碳及饱和湿度细胞培养箱内。48 h后首次换液,去除血细胞及其他悬浮细胞。视野内可见圆形细胞、梭形多角细胞集簇分布。以后3 d更换1次培养液。每天用倒置显微镜观察细胞生长状况和形态变化。待细胞生长汇合达80%以上时消化传代。用第3代细胞接种材料。
1.2.2 材料与骨髓基质细胞共培养及ALP活性检测 用电子分析天平称取2 mg P-15多肽,溶于2 mL磷酸盐缓冲溶液中,用0.22 μm滤器抽滤,制成1 mg/mL的 P-15 多肽液。然后分别稀释成 100、200、400 μg/mL各200 μL。在超净工作台内用分析天平称取10 mg生物玻璃,置于24孔板的16孔内,均匀铺开,然后滴加40 μg/mL 的多肽液 100、200、400 μg/mL 各 4 孔作为实验组,另留4孔生物玻璃作为阴性对照组,4孔不加生物玻璃作为空白对照组。严密包扎孔板,置于150 r/min摇床中离心12 h,干燥后备用。第2代细胞生长汇合达80%以上时消化细胞,调整细胞悬液为2×105/mL-1,接种在已铺好复合材料(生物玻璃/P-15)的24孔板内。分别于1、3、7、10 d检测各组骨髓基质细胞ALP活性和考马斯亮蓝总蛋白含量,通过紫外分光光度仪检测光密度值。
1.2.3 兔颅骨缺损模型制备及材料植入 将18只5月龄健康雄性大耳白兔适应性饲养1周,肌内注射速眠新通用名0.7 mL麻醉后固定于实验台,颅顶区常规消毒备皮,沿颅顶中线自眼眶后缘向颈根部做一3 cm直线切口,用剥离子分离骨膜。在距眼眶后缘、颅中缝0.5 cm处用裂钻磨制1 cm×1 cm的全层骨缺损区[复合材料组(生物玻璃复合质量浓度为200μg/mL的P-15多肽)、阴性对照组(未复合P-15的生物玻璃)、空白对照组(不加生物玻璃)],全程使用生理盐水降温。将预先准备好的材料植入缺损区,拉拢缝合骨膜以固定材料,缝合皮肤。术后视动物状态酌情给予苏醒药物,并肌肉注射60万U青霉素。材料植入4、6、8周后麻醉、处死动物,迅速完整取下眶部以上的颅骨部分。立即放入预先配好的4%多聚甲醛中固定。
1.2.4 组织学标本制作及染色 标本于4%多聚甲醛中固定24~48 h后沿冠状面片切,用甲酸进行脱钙1周。常规石蜡包埋、切片、苏木精-伊红染色(HE染色),封片观察。改良Gomori染色:(1)常规脱蜡,天青石蓝染液5 min;(2)水洗,常规HE染色用明矾苏木精染液染细胞核,显蓝同HE染色;(3)用变色酸2R酸性复红染色5~10 min;(4)用0.2% 醋酸水溶液洗 2~3次,肉眼观察骨组织呈红色,其他部分无色即可;(5)用亮绿染液复染;(6)用95%至无水乙醇脱水,二甲苯透明,中性树胶封片。经此法染色后骨组织红染,胶原纤维等矿化程度较低的组织绿染。
1.2.5 软X射线检查 采用GIOTTO钼靶软X射线摄片,将所摄X线片用数码单反相机拍照,采用Image pro plus选取骨缺损区域,segmentation工具定义正常骨组织颜色,以排除未降解材料的影响,然后计算各组兔颅骨缺损X线片中骨缺损处成骨面积(area sum)。将4周空白对照组兔颅骨缺损area sum定义为1,对4、6、8周复合材料组兔颅骨缺损成骨面积与4周空白对照组的比值进行统计分析。
1.3 统计学处理 应用SPSS20.0统计软件进行数据分析,计量资料以表示,组间比较采用多样本均数单因素方差分析(one-wayANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 复合材料对骨髓基质细胞ALP活性的影响 复合材料与骨髓基质细胞共培养后细胞排列具有一定方向性,呈鱼群密集生长,材料周围可见细胞紧密排列,平行或垂直于材料接触面。实验组骨髓基质细胞培养1 d后ALP活性即高于对照组,且质量浓度为200 μg/mL的实验组骨髓基质细胞ALP活性培养1、4、7、10 d后均明显高于质量浓度为100、400 μg/mL的实验组及对照组,差异均有统计学意义(P<0.05)。见图1。
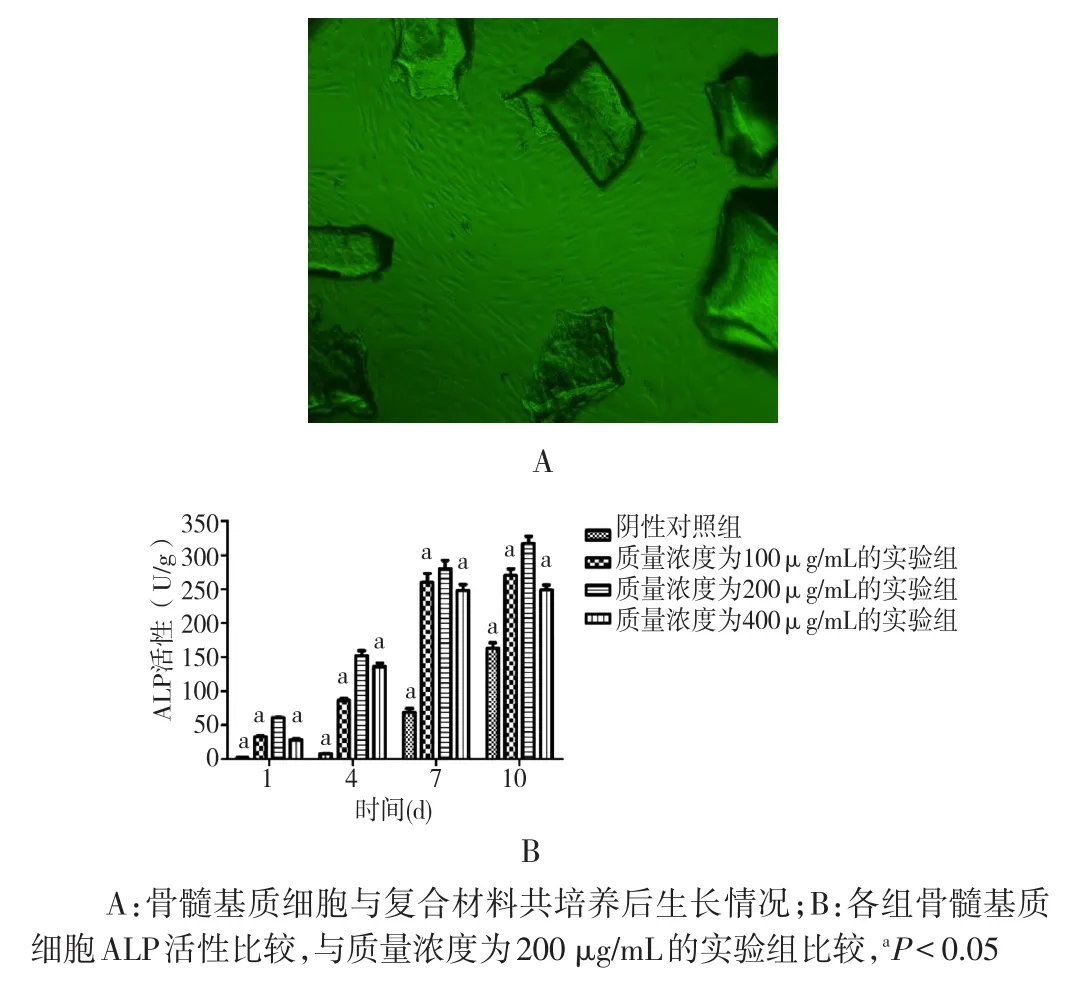
图1 复合材料对骨髓基质细胞ALP活性的影响
2.2 不同材料修复兔颅骨缺损的软X射线分析 4周时复合材料组兔颅骨缺损区局部X射线阻射影面积较阴性对照组大,射区域之间高密度影像连接较广泛,缺损处area sum明显高于阴性对照组,差异有统计学意义(P<0.05)。6周时复合材料组兔颅骨缺损区X射线阻射影密度较阴性对照组均匀,缺损处area sum明显高于阴性对照组,差异有统计学意义(P<0.05),但仍可见未降解的材料和少部分低密度区域。8周时复合材料组兔颅骨缺损区X射线阻射面积明显大于阴性对照组、空白对照组,差异均有统计学意义(P<0.05)。见图2。
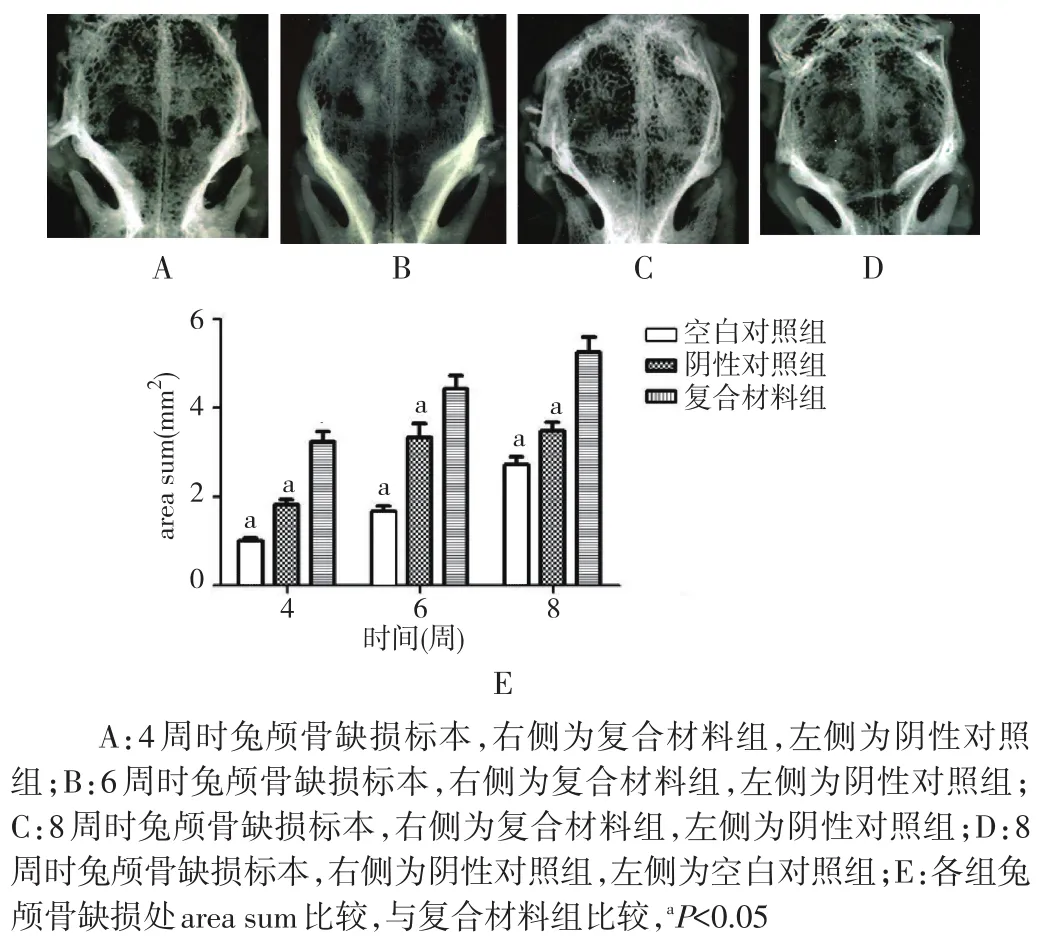
图2 不同材料修复兔颅骨缺损的软X射线分析
2.3 不同材料修复兔颅骨缺损的HE染色分析 4周时复合材料组兔颅骨缺损区复合材料周边有新生骨小梁和部分纤维组织,周围有少量炎症细胞,骨细胞陷窝较多;材料中心已可见到细胞及类骨基质成分;材料之间有骨小梁连接。阴性对照组兔颅骨缺损区在生物玻璃周围有薄层新骨形成,材料之间缺少骨组织的连接,由较多纤维组织包绕。6周时复合材料组兔颅骨缺损区复合材料中心骨基质沉积明显,有细胞与周围骨小梁相连接,但材料周围新生骨的基质成分排列较紊乱;阴性对照组兔颅骨缺损区生物玻璃中心很少能观察到细胞成分,但颗粒状材料之间的骨组织比4周时明显增多、增宽。8周时复合材料组兔颅骨缺损区复合材料中心有明显骨样组织沉积或可见梭形细胞呈网状,周围有成骨细胞紧密排列,形成的新骨可见板层样结构;阴性对照组兔颅骨缺损区生物玻璃中心可见细胞及基质,颗粒状材料之间新生骨组织较6周时继续增多,但结构紊乱。见图3。

图3 不同材料修复兔颅骨缺损的HE染色分析(HE染色,200×)
2.4 不同材料修复兔颅骨缺损的改良Gomori染色分析 4周时复合材料组兔颅骨缺损区复合材料(无色或绿染)周边有新生骨小梁形成,材料与颗粒之间及材料与正常骨组织之间紧密相连,但矿化程度不高;阴性对照组兔颅骨缺损区材料颗粒周围可见纤维组织,之间仅有薄层低矿化组织相连。6周时复合材料组兔颅骨缺损区复合材料颗粒之间连接广泛,有类似髓腔结构形成,部分材料中心可见矿化组织沉积明显;阴性对照组兔颅骨缺损区材料之间彼此连接,但矿化程度稍低。见图4。

图4 不同材料修复兔颅骨缺损的改良Gomeri染色分析(Gomori染色,100×)
3 讨 论
骨的有机成分中90%是由Ⅰ型胶原构成的,在其α1链上一段与间充质细胞结合且高度保守的15个氨基酸序列(766-GTPGPQGIAGQRGVV-780)被称为P-15。其促进成骨原理是这15个氨基酸残基组成的多肽能与成骨细胞前体细胞上的整合素受体结合,促进细胞黏附。因提供了更多的细胞结合位点,使整个修复过程从骨缺损灶内进行三维式的成骨,创造了一种有利于细胞各种生理活动和新骨生成的微环境,导致高度血管化的大量新骨生成。本研究结果显示,生物玻璃复合P-15多肽后在植入6周时即可形成大量新骨,且材料内部形成类髓腔样结构,提示有新生血管。
KÜBLER等[8]将人成骨细胞分别接种于Bio-base®、Bio-Oss®、PepGen P-15®等骨替代材料,6、9 d 后测定不同组细胞活力和增殖情况,结果显示,PepGen P-15组细胞线粒体脱氢酶活性最强。用相差倒置显微镜观察,PepGen P-15组成骨细胞围绕材料多层排列,且在颗粒之间形成桥连。扫描电镜也证实了其他材料表面的细胞数量和层次均不及PepGen P-15[8]。
国内学者在制备胎牛骨无机骨基质(FABM)上培养了人颌骨间充质干细胞,结果发现,P-15能更有效地促进细胞与牛骨无机骨基质之间的黏附;在P-15对人颌骨间充质干细胞的弹性模量研究中发现,P-15改变了细胞膜弹性模量,从而影响了细胞黏附,表明多肽P-15可作为有效的促成骨生长因子用于骨粉表面修饰[9]。
本研究结果显示,复合材料组骨髓基质细胞ALP活性较阴性对照组明显增加;当复合的P-15多肽质量浓度为200 μg/mL时与复合材料共培养的骨髓基质细胞ALP活性明显高于质量浓度为100、400 μg/mL的实验组及阴性对照组,差异均有统计学意义(P<0.05),这种差异在接种后的前4 d尤为明显,且细胞在复合材料周围生长良好,排列规则。
本研究采用复合材料的主体为生物玻璃。生物玻璃是由钠盐、钙盐、磷酸盐和二氧化硅组成的一类生物材料。当其与体液接触时会诱发3个阶段的反应,即扩散、溶出、凝集沉淀。最终通过缩聚反应和一系列重新排布形成了硅凝胶层[10]。该凝胶层具有较大的表面积,对蛋白多肽类具有一定吸附作用[11]。因此,本研究选择生物玻璃作为P-15多肽的载体。本研究软X射线结果显示,复合材料组与阴性对照组比较,新骨形成面积较多,密度较均匀;组织学切片结果显示,复合材料内部较早出现细胞成分,未降解颗粒之间有众多骨小梁相连,骨细胞陷窝多见,新骨形成速度及矿化程度均优于阴性对照组。
邓飞龙等[12]对P-15类材料的研究也证实了P-15多肽能将更多的细胞成分引入缺损处,从而加速新骨生成。另有动物实验研究表明,PepGen P-15的早期骨修复能力强于Bio-Oss及Cerasorb[13]。国外学者的2项多中心实验证明了PepGen P-15在治疗牙周病骨缺损中的成骨效果[14]。但因体外与体内环境具有差异,本研究中细胞与材料的体外共培养筛选出的多肽质量浓度对体内实验的指导意义具有局限性。
综上所述,本研究通过体外细胞培养筛选出适宜成骨的P-15多肽质量浓度,与生物玻璃复合后植入兔颅骨缺损模型中经软X射线分析和组织学检查结果证实,复合材料的骨修复能力得到了一定的提高。本研究采用胶原仿生多肽来提高原有材料的成骨活性,希望能为骨替代材料的研究开辟思路。

