食管癌根治术中采用腹腔镜辅助胃游离与传统两切口的优势比较
喻大军,钱 军(蚌埠医学院第一附属医院肿瘤外科,安徽蚌埠233000)
在我国,食管癌发病率居恶性肿瘤的第4位,是消化系统最常见的恶性肿瘤之一,患者预后较差[1]。目前,外科手术仍是食管癌首选的治疗方法[2]。而传统手术方式以开胸为主,创面大,患者术后恢复较慢,并发症发生率也较高[3]。目前,越来越多的微创技术已在食管外科开展并得到应用,腹腔镜辅助胃游离也逐渐代替了传统两切口手术方式,成为两切口食管癌的主流手术方式[4],且该项技术的可行性、安全性和有效性已得到临床广泛验证。本研究对本院肿瘤外科收治的80例食管癌根治术患者进行了相关探讨,旨在为该手术方式的临床推广应用提供参考,并为胸腹腔镜联合食管癌根治术的开展奠定基础。
1 资料与方法
1.1 资料
1.1.1 一般资料 选取2012年8月至2017年8月本院肿瘤外科收治的食管癌根治术患者80例,按随机双盲对照选择手术方式分为腔镜组和对照组,每组40例。腔镜组患者中男31例,女9例;年龄44~75岁,平均(60.54±6.89)岁;病变部位:上段 5例,中段 19例,下段16例;分期(按国际抗癌联盟第7版食管癌分期标准[5]):Ⅰ期12例,Ⅱ期19例,Ⅲ期9例。对照组患者中男 28例,女12例;年龄 43~76岁,平均(61.84±7.53)岁;病变部位:上段4例,中段20例,下段16例;分期:Ⅰ期10例,Ⅱ期22例,Ⅲ期8例。两组患者性别、年龄等一般资料比较,差异均无统计学意义(P>0.05)。本研究经患者及家属签字同意,并经医院伦理委员会批准。
1.1.2 纳入标准 (1)未侵犯食管壁全层的早、中期食管癌;(2)肿瘤直径小于 5.0 cm,无软组织阴影;(3)肿瘤直径大于5.0 cm,但以腔内生长为主;(4)局部无明显淋巴结肿大;(5)T1、T2及部分 T3期患者;(6)胸部 CT、超声内镜检查提示无明显邻近组织脏器浸润;(7)无食管床及胃小弯侧大块淋巴结转移;(8)术中能耐受左侧单肺通气;(9)无胸、腹部手术史。
1.1.3 排除标准 (1)术前影像学检查提示腹部淋巴结明显肿大;(2)有既往腹部手术史、腹腔广泛粘连及不能耐受二氧化碳气腹;(3)肥胖虽非手术禁忌证,但术中胃的暴露和游离较为困难,明显增加了手术难度;(4)肺功能差,不能耐受长时间单肺通气;(5)有胸部手术史或严重右胸腔粘连,肿瘤外侵气管、支气管及主动脉;(6)肿瘤已有远处转移;(7)合并严重胸膜或肺脏疾病、心脏疾病不适宜手术。
1.2 方法
1.2.1 手术方法 两组患者均采用静吸复合麻醉,双腔气管插管,非手术侧单肺通气。术中监测呼吸、脉搏、血压、动脉血氧饱和度等生命指标,必要时进行动脉血气分析。所有手术均由同一组手术人员完成。
1.2.1.1 腔镜组 采用腹腔镜辅助胃游离联合右侧开胸小切口食管癌根治术。患者先取平卧位,两腿分开,常规消毒铺单,取脐下切口,长1 cm,置入气腹针造气腹,套管针穿刺腹腔,插入腹腔镜进行探查,在腹腔镜明视下分别于双侧锁骨中线脐水平、平肋缘置入4枚穿刺套管,以超声刀分离胃大弯,切开胃结肠韧带,保留胃网膜右血管弓;向左侧切断、结扎胃网膜左血管,切开胃脾韧带,清扫肝总动脉、脾血管近端、腹腔干周围淋巴结,游离并以钛夹夹闭胃左血管,切开肝胃韧带,游离膈食管裂孔,切断迷走神经,向纵隔内充分游离下段食管。仔细止血后关腹。患者再取左侧卧位,于第5肋间腋下后外侧小切口进胸,在胸腔内游离食管,上至胸膜顶,下至贲门,清扫食管旁纵隔淋巴结,于肿瘤上方5 cm处离断食管,将胃提至胸腔制作管状胃,用吻合器在胸腔行胃食管端侧吻合。胸、腹腔常规留置引流管。
1.2.1.2 对照组 采用传统两切口手术方式。患者取左侧卧位,根据肿瘤位置,经右胸第5或6肋后外侧切口进胸,探查胸腔,游离食管,清扫相应节段淋巴结。胸部游离完成后患者改取水平卧位,于上腹正中15~20 cm切口进腹,探查腹腔有无转移及腹腔内脏器有无异常,打开胃结肠韧带后,分离、结扎胃大弯侧血管,保留胃网膜右血管弓,游离胃小弯,清扫周围组织淋巴结。离断并结扎胃左动脉,清扫腹腔干周围淋巴结,游离贲门和食管腹段,至此胃全部游离。制作管状胃,将胃提至胸腔行胃食管吻合。胸、腹腔常规留置引流管。
1.2.2 观察指标
1.2.2.1 术中、术后情况 术中记录两组患者手术时间、术中出血量等,术后记录两组患者术后第1天腹腔引流量、术后腹腔引流管拔管时间、重症监护病房(ICU)观察时间及术后住院时间。
1.2.2.2 术中淋巴结清扫数目及术后病理检查阳性淋巴结数目 记录两组患者术中淋巴结清扫数目并与术后病理检查证实的阳性淋巴结数目进行对比。
1.2.2.3 并发症发生情况 记录两组患者术后肺部感染、肺不张、腹腔感染、腹部切口感染、吻合口瘘、胃壁坏死、胃排空延迟等并发症发生情况。
1.2.2.4 术后疼痛评分 分别于术后12、24、48 h对两组患者进行疼痛评估。采用疼痛视觉模拟评分(VAS)对患者术后疼痛程度进行评价[6]。VAS评分标准是从无痛至剧烈疼痛分为10级,无痛为0分,剧烈疼痛为10分,采用统一的VAS评分卡由患者指出自己的疼痛评分。
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,计量资料以表示,组间比较采用t检验;计数资料以率或构成比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术中情况比较 腔镜组患者中无一例中转开腹手术,手术时间与对照组比较,差异无统计学意义(P>0.05);但术中出血量明显少于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者术中情况比较(±s)

表1 两组患者术中情况比较(±s)
注:-表示无此项
组别腔镜组对照组n 40 40 t P--手术时间(min)241.52±35.87 235.42±34.85-0.771 0.443术中失血量(mL)205.80±25.64 325.68±42.80 15.196 0.000
2.2 两组患者术后情况比较 腔镜组患者术后第1天腹腔引流量明显少于对照组,术后腹腔引流管拔管时间明显早于对照组,术后ICU观察时间、术后住院时间均明显短于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者术后情况比较(±s)

表2 两组患者术后情况比较(±s)
注:-表示无此项
n组别腔镜组对照组40 40 t P--术后第1天腹腔引流量(mL)245.26±33.58 355.48±45.68 12.296 0.000术后腹腔引流管拔管时间(d)4.15±0.52 6.75±0.88 16.087 0.000术后ICU观察时间(d)1.68±0.22 2.54±0.25 17.472 0.000术后住院时间(d)12.85±1.89 16.77±2.53 7.851 0.000
2.3 两组患者术中淋巴结清扫数目和术后病理检查阳性淋巴结数目比较 两组患者术中淋巴结清扫数目和术后病理检查阳性淋巴结数目比较,差异均无统计学意义(P>0.05)。见表 3。
表3 两组患者术中淋巴结清扫数目和术后病理检查阳性淋巴结数目比较(±s,枚)

表3 两组患者术中淋巴结清扫数目和术后病理检查阳性淋巴结数目比较(±s,枚)
注:-表示无此项
组别腔镜组对照组n 40 40 t P--术中清扫淋巴结数目胸腔13.25±1.48 13.52±1.52 0.805 0.423腹腔6.59±0.88 6.80±0.96 1.020 0.311术后病理检查阳性淋巴结数目5.66±0.64 5.83±0.77 1.074 0.286
2.4 两组患者术后并发症发生情况比较 腔镜组患者中术后出现肺部感染、肺不张1例,胃排空延迟2例,无腹腔感染和腹部伤口感染、吻合口瘘、胃壁坏死等,并发症发生率为7.5%。对照组患者中术后出现肺部感染、肺不张2例,腹腔感染1例,腹部伤口感染1例,吻合口瘘1例,胃壁坏死1例,胃排空延迟4例,并发症发生率为25.0%。腔镜组患者术后并发症发生率明显低于对照组,差异有统计学意义(P<0.05)。见表4。
2.5 两组患者术后VAS比较 腔镜组患者术后12 h VAS明显低于对照组,差异有统计学意义(P<0.05);两组患者术后24 h VAS均下降,且腔镜组患者仍明显低于对照组,差异有统计学意义(P<0.05);两组患者术后48 h VAS继续下降,且两组患者VAS比较,差异无统计学意义(P>0.05)。见表5。
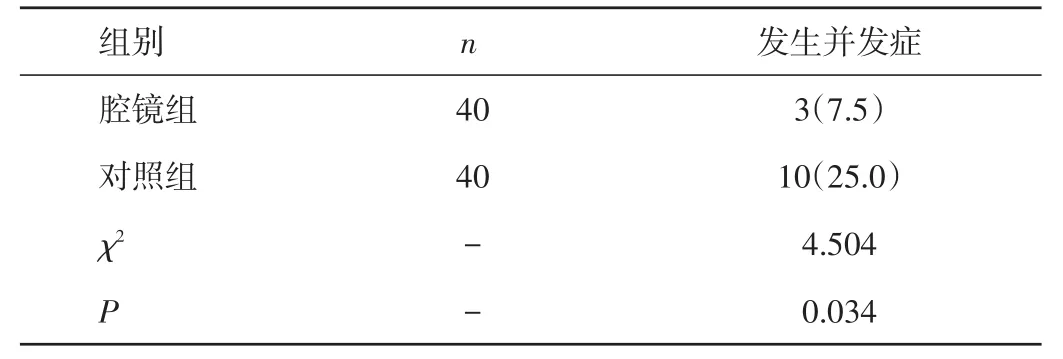
表4 两组患者术后并发症发生情况比较[n(%)]
表5 两组患者术后VAS比较(±s,分)

表5 两组患者术后VAS比较(±s,分)
注:-表示无此项
组别腔镜组对照组n VAS 40 40 t P--术后12 h 6.25±0.95 7.83±1.06 7.020 0.000术后24 h 4.52±0.61 6.29±0.85 10.700 0.000术后48 h 2.88±0.48 3.05±0.56 1.458 0.149
3 讨 论
在食管癌的治疗方法中传统开放式手术方式尽管已被临床外科医生广泛认可,但其在治疗过程中给患者带来的创伤却不可否认[7]。
微创外科的优势在于减少手术创伤的同时保证了手术的效果。以微创方式行食管癌根治术,不管采用哪种手术方法,腹腔镜辅助胃游离都是消化道微创重建的基础[8]。但由于腹腔镜辅助胃游离至今尚未成为食管癌根治术的常规方法,因而其有效性也存在一定的争议。
手术时间在一定程度上代表了术者对操作的熟练程度,术中出血量可间接反映术者的微创意识。有研究表明,腔镜手术时间长短与术者习惯和熟练程度相关[9]。腔镜操作的学习曲线显示,前期病例胃游离时间较长,后期病例胃游离时间逐渐缩短,直至与开腹手术胃游离无差异。而在本研究中,腔镜组患者手术时间与对照组比较,差异无统计学意义(P>0.05)。同时,腔镜组患者术中出血量明显少于对照组,差异有统计学意义(P<0.05),表明术中创伤较少,与国内相关文献报道大致相同[10]。究其原因可能是传统开放术式需离断肌肉,而腔镜下无须分离肌肉而减少了出血和创伤,同时,腔镜的局部放大作用可使术者清晰地看到食管周边的组织和血管,有助于术中游离,从而减少了术中出血[11]。
术后第1天腹腔引流量、术后腹腔引流管拔管时间、术后ICU观察时间、术后住院时间等指标可间接反映手术的创伤程度。本研究结果显示,腔镜组患者术后第1天腹腔引流量明显少于对照组,术后腹腔引流管拔管时间明显早于对照组,差异均有统计学意义(P<0.05),体现了腔镜手术创面小、恢复快等优点,显示出明显的微创效应。而腔镜组患者术后ICU观察时间、术后住院时间均明显短于对照组,差异均有统计学意义(P<0.05),说明腔镜手术恢复快,也同样符合微创理念。
腔镜食管癌根治术不仅要符合微创,更要确保根治。食管癌的根治历来强调对淋巴结的清扫,淋巴结清扫是根治术的关键步骤,对患者术后生存率具有极大的影响[12]。本研究结果显示,腔镜组患者腹部淋巴结清扫数目与对照组比较,差异无统计学意义(P>0.05),说明腹腔镜清扫淋巴结完全可达到开腹手术的效果;腔镜组患者术后病理检查阳性淋巴结数目与对照组比较,差异也无统计学意义(P>0.05),说明腔镜操作完全能达到与开腹手术相同的根治效应。在腹腔镜帮助下,可有效放大手术视野,增强了手术医生对淋巴结的识别能力,可能是淋巴清扫高效的原因。近年来,国内外也有腹腔镜淋巴结清扫的报道,其结果与本研究结果相似[13]。
手术的安全性主要体现在并发症发生率方面。本研究发现,腔镜组患者术后并发症发生率明显低于对照组,差异有统计学意义(P<0.05),说明其安全性较好。临床数据已证实,食管癌根治术后肺不张、肺部感染的发生与手术伤口引起的疼痛关系密切,伤口疼痛对咳嗽、咳痰带来困难,腹腔镜联合腋下小切口较常规后外侧切口创伤小,对术后早期咳嗽、咳痰有利,能促使肺复张[14]。另外,胃壁坏死与吻合口瘘是食管癌根治术最严重的并发症[15]。无论是腹腔镜辅助胃游离还是开腹手术胃游离均有可能对胃壁组织造成牵拉,以及过多裁剪胃小弯侧影响了胸胃供血,可能是造成该类并发症的主要原因。本研究结果显示,腔镜组患者中无一例出现胃壁坏死,对照组患者中出现吻合口瘘1例,胃壁坏死1例,说明腹腔镜操作并未增加胃壁坏死与吻合口瘘发生率。
手术创伤程度和恢复快慢的另一项指标是对患者术后疼痛的评估。本研究发现,腔镜组患者术后12、24 h VAS均明显低于对照组,差异均有统计学意义(P<0.05),且腔镜组患者VAS下降较快;两组患者术后48 h VAS比较,差异无统计学意义(P>0.05)。非常直观地反映了腔镜操作创伤小、恢复快,符合微创理念。
总之,在食管癌根治术中采用腹腔镜辅助胃游离的手术方式较传统两切口大大减少了手术创伤,其安全性与有效性均得到了验证,具有微创效应。

