EGCG体外抗氧化性能及其对酪蛋白乳化性能的影响
董新玲
(陕西省产品质量监督检验研究院,陕西 西安 710000)
0 引言
食品在加工和储藏过程中的脂肪氧化是导致其品质下降的重要原因,合成抗氧化剂,如丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)和叔丁基对苯二酚(TBHQ)等,长期以来被用于食品中以抑制脂肪氧化.然而已有研究表明人工合成抗氧化剂的长期摄入对人体健康具有潜在危害,因而天然抗氧化剂越来越受到消费者的欢迎和食品领域科学家的关注[1].
茶多酚是目前应用最广泛的天然抗氧化剂之一,其在植物油脂中的抗氧化效果是BHT的1.5倍左右,是BHA的2~3倍,是VE的3~4倍[2].茶多酚的主要活性成分是儿茶素类化合物,主要包括:表儿茶素(EC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)和表没食子儿茶素没食子酸酯(EGCG),其中 EGCG含量最高(约占到儿茶素总含量的50%)[3],是茶多酚中最有效的抗氧化活性多酚,其抗氧化活性最少是维生素C的100倍,是维生素E的25倍[4].
酪蛋白约占牛奶中总蛋白的80%左右,具有较高的营养价值(含有人体必需的8种氨基酸)和多种功能性质(乳化性和凝胶性等)而被广泛应用于食品工业中[5].例如,作为大分子乳化剂,酪蛋白及其钠盐经常被用于乳化香肠的生产中.众所周知,富含酚类的植物提取物,如茶多酚,作为天然抗氧化剂已被广泛应用于肉制品生产加工以抑制脂肪氧化[1].已有研究表明,植物多酚与蛋白相互作用可以改变蛋白质的功能特性(发泡性、乳化性、凝胶性等)[6-8].因而,茶多酚的添加是否会影响酪蛋白的乳化能力值得关注.
因此,本课题首先采用六种方法探究EGCG的体外抗氧化性能,其次采用经典方法研究EGCG添加对酪蛋白乳化活性及乳化稳定性的影响,以期为合理使用EGCG及酪蛋白提供理论依据和参考.
1 材料与方法
1.1 材料与仪器
(1)主要材料与试剂:大豆油,益海嘉里食品工业有限公司;EGCG(>98%),上海纯优生物科技有限公司;酪蛋白、菲啰嗪、邻苯二酚紫,上海瑞永生物科技有限公司;吡啶、硫酸亚铁、硫酸铜、DPPH、水杨酸、过氧化氢、ABTS、过硫酸钾、乙酸盐、三氯化铁、TPTZ、脱氧核糖、EDTA、抗坏血酸、TBA、TCA等,天津市科密欧化学试剂有限公司.
(2)主要仪器设备:JM-B20001型电子天平,余姚市纪铭称重校验设备有限公司;BP211D电子天平,赛多利斯科学仪器有限公司;微量移液器,德国Eppendorf公司;UV-1240紫外可见分光光度计,日本SHIMADZU公司;JBZ-14H型磁力搅拌器,上海大浦仪器有限公司;FJ200-S型高速分散均质机,陕西环宇仪器设备有限公司;MIX-25P型迷你混合仪,杭州米欧仪器有限公司;PHS-25型数显pH计,上海仪电科学仪器股份有限公司.
1.2 实验方法
1.2.1 EGCG抗氧化活性的测定
(1)总抗氧化能力的测定[9]—亚铁离子还原能力(FRAP)
标准曲线制作:用移液枪分别准确吸取不同浓度的硫酸亚铁标准溶液(0.20、0.40、0.60、0.80、1.00 mmol/L)各0.10 mL,加入0.30 mL去离子水和3 mL FRAP工作液,摇匀后在37 ℃水浴4 min,于593 nm处测定其吸光度,每个样品平行测定三次,根据所得吸光度的平均值制作标准曲线.
不同浓度EGCG总抗氧化能力的测定:实验组用0.10 mL不同浓度EGCG溶液(50、100、150、200、300、400、500μg/mL)替代硫酸亚铁标准溶液,空白对照组以0.10 mL去离子水替代硫酸亚铁标准溶,其余操作同上.由实验所得的标准曲线查得相同吸光值处对应的FeSO4浓度,样品/空白组还原能力用对应的FeSO4浓度(mmol/L)表示.总抗氧化能力通过以下方程式计算:
样品抗氧化能力(mmol/L FeSO4)=
样品还原能力-空白还原能力
(1)
(2)DPPH自由基清除能力的测定[10]用移液枪准确吸取50μL不同浓度待测样品溶液,分别与3 mL 60μmol/L的DPPH溶液混合,充分摇匀之后置于暗室避光反应30 min,反应结束后,于516 nm处测定其吸光值A1,以不加EGCG的试剂做空白测定其吸光度值A0,每个样品平行测定三次.
DPPH自由基清除率按照以下公式计算:
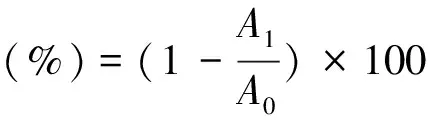
(2)
(3)ABTS自由基清除能力的测定[11]
准确吸取30μL不同浓度的EGCG溶液,与2.97 mL ABTS工作液混合,摇匀,准确反应10 min后,于734 nm处测定吸光度值A1,以去离子水做空白测定其吸光度值A0,每个样品平行测定三次.ABTS自由基清除率计算公式同公式(2).
(4)羟自由基(OH)清除能力的测定[10]
于10 mL试管中按顺序加入250μL不同浓度的EGCG溶液、100μL 28 mmol/L脱氧核糖溶液(DR)、100μL 1 mmol/L过氧化氢溶液,250μL 100 mmol/L磷酸盐缓冲液(pH7.4),100μL 100μmol/L三氯化铁溶液,100μL 104μmol/L乙二胺四乙酸溶液(EDTA)和100μL 1 mmol/L抗坏血酸溶液,充分混匀后于50 ℃条件下水浴20 min,再分别加入1%硫代巴比妥酸(TBA)溶液和2.8%的三氯乙酸(TCA)溶液各1 mL,再次混匀后,于沸水浴中反应20 min,之此后置于冰水浴冷却以终止反应,此后加入3.5 mL正丁醇提取显色团,3 300 g离心10 min后,吸取有机相于532 nm处测定吸光度值A1.空白对照组以去离子水代替EGCG样品溶液,吸光度值表示为A0,样品空白组以去离子水代替过氧化氢,吸光度值表示为A2.每个样品平行测定三次.
清除率通过以下公式计算:
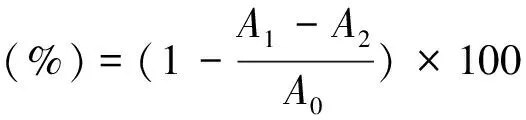
(3)
(5)金属离子螯合能力测定
Fe2+螯合能力[12]:分别准确吸取100μL 2 mmol/L FeCl2溶液、3.7 mL去离子水于10 mL 玻璃试管内,加入1 mL待测EGCG样品溶液混匀.准确反应3 min 后,加入200μL 5 mmol/L 菲咯嗪试剂终止反应,混匀,静置10 min后,于562 nm处测定吸光度值A1.空白对照组以去离子水代替EGCG样品溶液,吸光度值表示为A0,样品空白组以去离子水代替菲啰嗪,吸光度值表示为A2.每个样品平行测定三次.
Fe2+螯合能力通过以下公式计算:
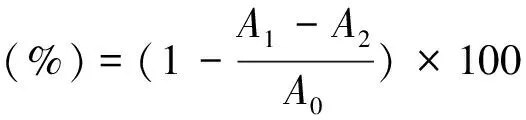
(4)
Cu2+螯合能力[13]:在通风橱下,佩戴一次性橡胶手套,用移液枪准确移取1 mL吡啶(10%)试剂于带螺纹玻璃试管中,加入20μL 邻苯二酚紫试剂(0.1%),混匀,再加入1 mL CuSO4溶液(2 mmol/L)充分混匀.然后加入1 mL不同浓度EGCG样品溶液混匀,于632 nm处测定吸光度值A1.以去离子水对照,测定其吸光度值A0,每个样品平行测定三次.
Cu2+螯合能力通过以下公式计算:
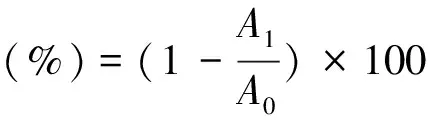
(5)
1.2.2 EGCG结合对酪蛋白乳化性能的影响
氧化EGCG溶液的配置:参考Balange和Benjakul的描述并做适当修改[14],用天平准确称取0.025 g EGCG溶于40 mL去离子水中,用6 N NaOH调节溶液pH至8.0,放置于磁力搅拌器上搅拌8 h,使得溶液颜色变为黑红色,再用6 N HCl将溶液pH调回7.0,补加去离子水定容至50 mL,则完全氧化的EGCG中浓度为500μg/mL.通过计算进行不同程度稀释,得到不同浓度的氧化EGCG溶液.
用移液枪分别吸取不同浓度的未氧化或氧化EGCG溶液和0.2%酪蛋白溶液各9 mL于50 mL离心管中,加入大豆色拉油2 g,然后用高速均质机以10 000 r/min 高速均质 1 min之后立即用移液枪从底部吸取乳状液10μL,然后与 5 mL 0.1%(m/v)SDS溶液混合,以相同浓度的SDS溶液做为空白对照,用紫外可见分光光度计在500 nm波长处测其吸光度A0,10 min后再次测量吸光度值A10,每个样品独立测定三次.
乳化活性(EAI)和乳化稳定性(ESI)采用如下公式[15]进行计算:
(6)
(7)
式(6)~(7)中:T为2.303;c为乳化前蛋白质溶液中蛋白质量浓度/(g/mL);φ为乳化液中油的体积分数;A0为均质后迅速被稀释的乳化液的吸光度;A10为乳化液在静止10 min后的吸光度.
2 结果与讨论
2.1 EGCG的抗氧化活性
2.1.1 总抗氧化活性
以不同浓度FeSO4为标准溶液,根据反应后样品溶液在593 nm处的吸光度值A593绘制标准曲线,如图1(a)所示.以FeSO4浓度x(mmol/L)与其反应后相应吸光度值y(A593)进行线性回归,所得方程为:y=0.550 4x+0.03,相关系数R2=0.997 2,表明FeSO4浓度在0~1 mmol/L范围内与A593具有良好的线性关系.
采用相同的实验方法,依照标准曲线求得不同浓度EGCG的总抗氧化能力,如图1(b)所示.从图中可以看出,EGCG的总抗氧化能力具有浓度依赖性:总体来说,随着EGCG浓度增大,其总抗氧化能力进一步增强;当EGCG浓度为50μg/mL时,其总抗氧化能力约为0.38 mmol/L Fe2+,当EGCG浓度增大到500μg/mL时,其总抗氧化能力达到0.71 mmol/L Fe2+,约为初始浓度(50μg/mL)总抗氧化能力的两倍.Rice研究发现 EGCG抗氧化效果至少是维生素E的25倍,是维生素C的100多倍[16];臧鹏等研究发现EGCG 在压缩饼干中的抗氧化能力是维生素E的2.8倍[17];这可能与实验条件及实验方法的选择等有关.
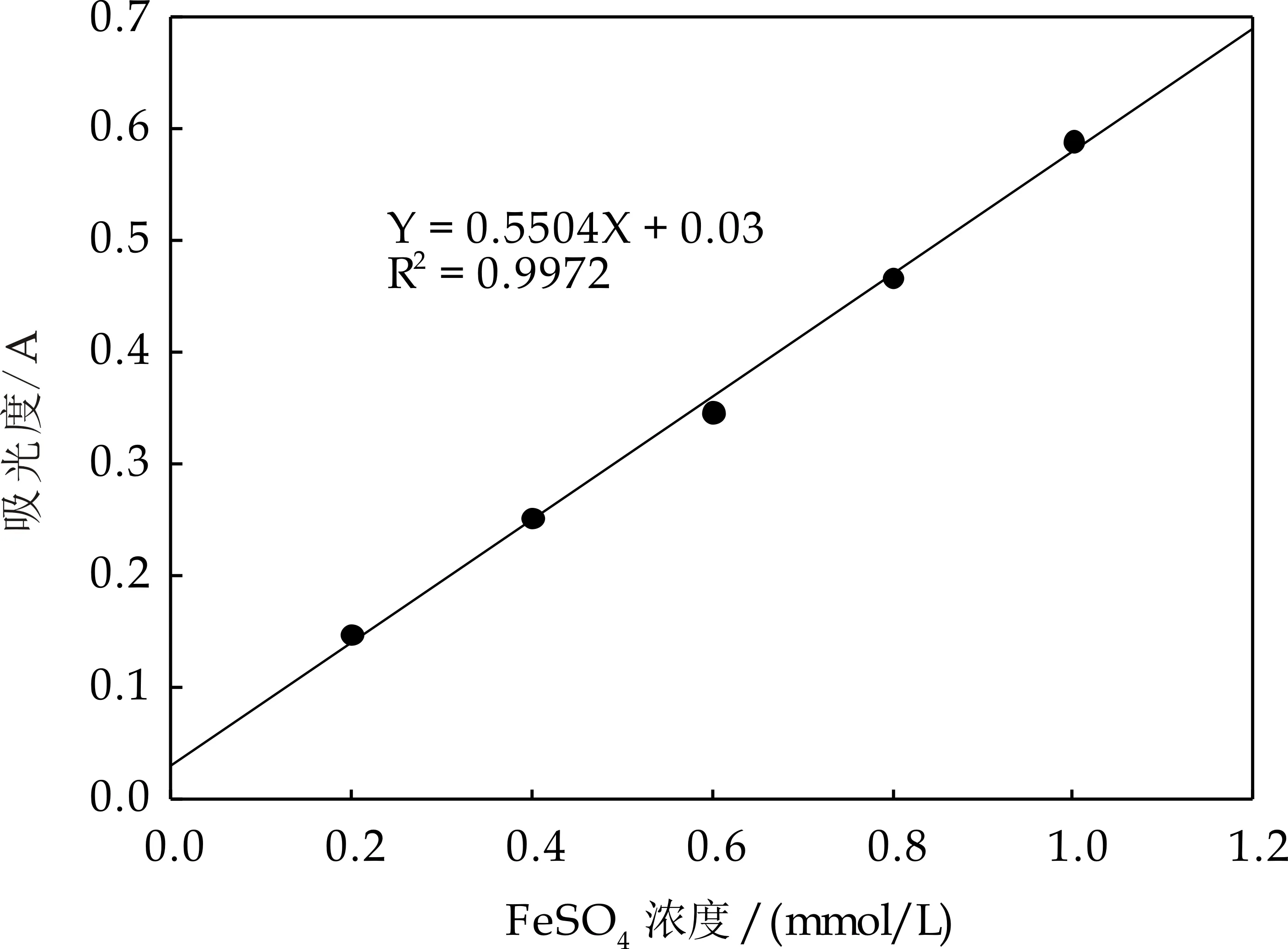
(a)亚铁离子还原能力标准曲线
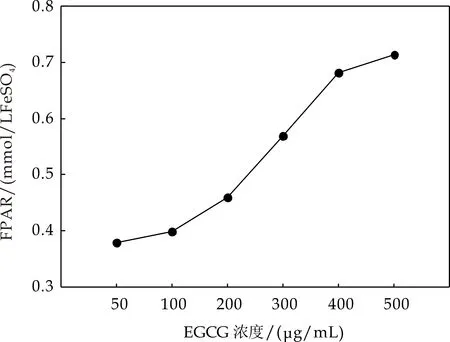
(b)EGCG总抗氧化能力随浓度变化曲线图1 不同浓度EGCG总抗氧化能力
2.1.2 自由基清除能力
不同浓度EGCG的DPPH/ABTS/OH自由基清除能力如图2所示.从图2可知,EGCG对三种自由基的清除效果均具有浓度依赖性,且清除率随浓度变化的趋势一致.整体来说,当EGCG浓度在50~200μg/mL范围时,其三种自由基清除能力随浓度增大显著增强,且对三种自由基清除能力为DPPH>OH>ABTS;当EGCG浓度为200μg/mL时,其自由基清除率已经接近峰值,且对三种自由基清除率为ABTS(92.1%)>DPPH(87.1%)>OH(82.5%);此后随ECGC浓度增大,其自由基清除能力无显著变化.由此可见,当EGCG浓度为200μg/mL时,对三种自由基的清除率几乎达到最佳.朱松研究发现:在100~800μg/mL浓度范围内,EGCG对OH自由基的清除效果与浓度之间呈正相关;当浓度为200μg/mL时,EGCG对DPPH自由基的清除率约为88.3%[18].
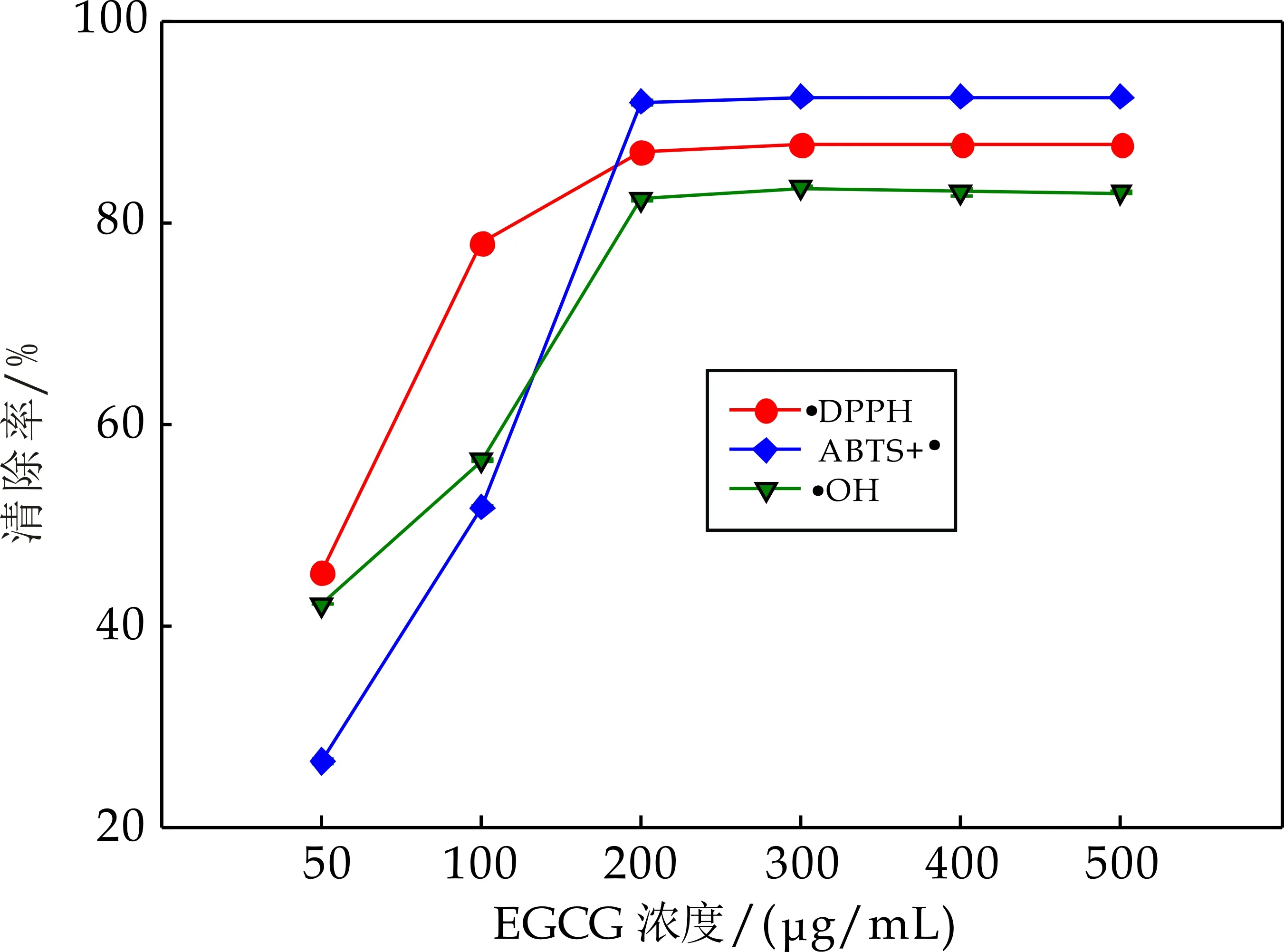
图2 不同浓度EGCG对三种自由基的清除能力
2.1.3 金属离子螯合能力
(1)Fe2+螯合能力
不同浓度EGCG对Fe2+的螯合能力如图3(a)所示.在50~500μg/mL范围内,EGCG对Fe2+的螯合能力基本保持在15%左右,与EGCG自身浓度关系不大.与本实验结果类似,Zhong等[19]研究发现,20μg/mL的EGCG对亚铁离子的螯合能力约为8%,说明EGCG对亚铁离子的螯合能力较弱.
(2)Cu2+螯合能力
不同浓度EGCG对Cu2+的鳌合能力如图3(b)所示.整体来说,随着EGCG浓度增大,其对二价铜离子的螯合能力增强,当EGCG浓度在50~100μg/mL之间时,其对Cu2+的螯合能力约为16%,当EGCG浓度上升到200μg/mL时,其对二价铜离子的螯合能力达到了29.6%,此后随EGCG浓度上升,其对Cu2+鳌合能力较缓增强,当EGCG浓度上升到在400~500μg/mL之间时,其对Cu2+鳌合能力约为35%左右.由此可见,EGCG的Cu2+的螯合能力明显高于其Fe2+的螯合能力,且具有较明显的浓度依赖性.

(a)不同浓度EGCG对亚铁离子的鳌合能力
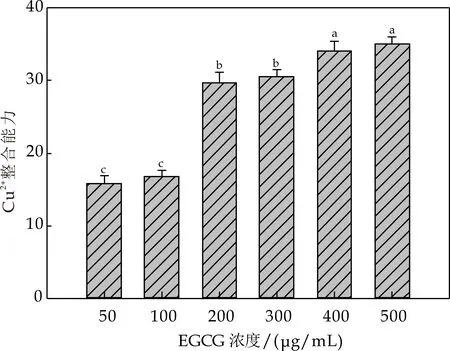
(b)不同浓度EGCG对铜离子的鳌合能力图3 不同浓度EGCG对金属离子的鳌合能力
2.2 EGCG结合对酪蛋白乳化性能的影响
2.2.1 EGCG对酪蛋白乳化性能的影响
不同浓度EGCG添加对酪蛋白乳化活性的影响如图4(a)所示.随着EGCG添加量的增大,酪蛋白的乳化活性呈下降趋势.未添加EGCG的酪蛋白(空白样品)乳化活性最好,约为23%,当EGCG添加量为500 mg/mL时,酪蛋白的乳化活性下降为17%.与本实验结果类似,Cao等人研究发现当EGCG的添加量在0~200 mg/mL时,肌原纤维蛋白的乳化活性无显著变化,当EGCG的浓度进一步增大时,肌原纤维蛋白的乳化活性呈现下降趋势,原因可能是高浓度EGCG的添加导致蛋白质表面疏水性降低并引起蛋白聚集,因而在乳化过程中难以伸展并包裹于油滴表面形成蛋白膜界面膜[7].因此高浓度 EGCG 添加导致酪蛋白乳化活性降低可能与其引起的蛋白表面疏水性降低及蛋白聚集有关.
不同浓度EGCG添加对酪蛋白乳化稳定性的影响如图4(b)所示.未添加EGCG的酪蛋白乳化稳定性最差,约为78%.随着EGCG添加量的增大,酪蛋白的乳化稳定性呈上升趋势.EGCG添加量在100~300μg/mL时,酪蛋白的乳化稳定性上升趋势较为明显,而后趋于稳定,当EGCG浓度上升到500μg/mL时,其乳化稳定性达到了98%.池海波[20]研究发现茶多酚添加会导致玉米醇溶蛋白的乳化性和乳化稳定性降低;郭兴凤[21]等研究认为茶多酚对大豆分离蛋白体系乳化性和乳化稳定性影响不大,但对其起泡性和泡沫稳定性影响较为显著.可见,植物多酚对蛋白功能特性的影响非常复杂,与多酚的浓度及种类、蛋白的种类、实验条件等有关.
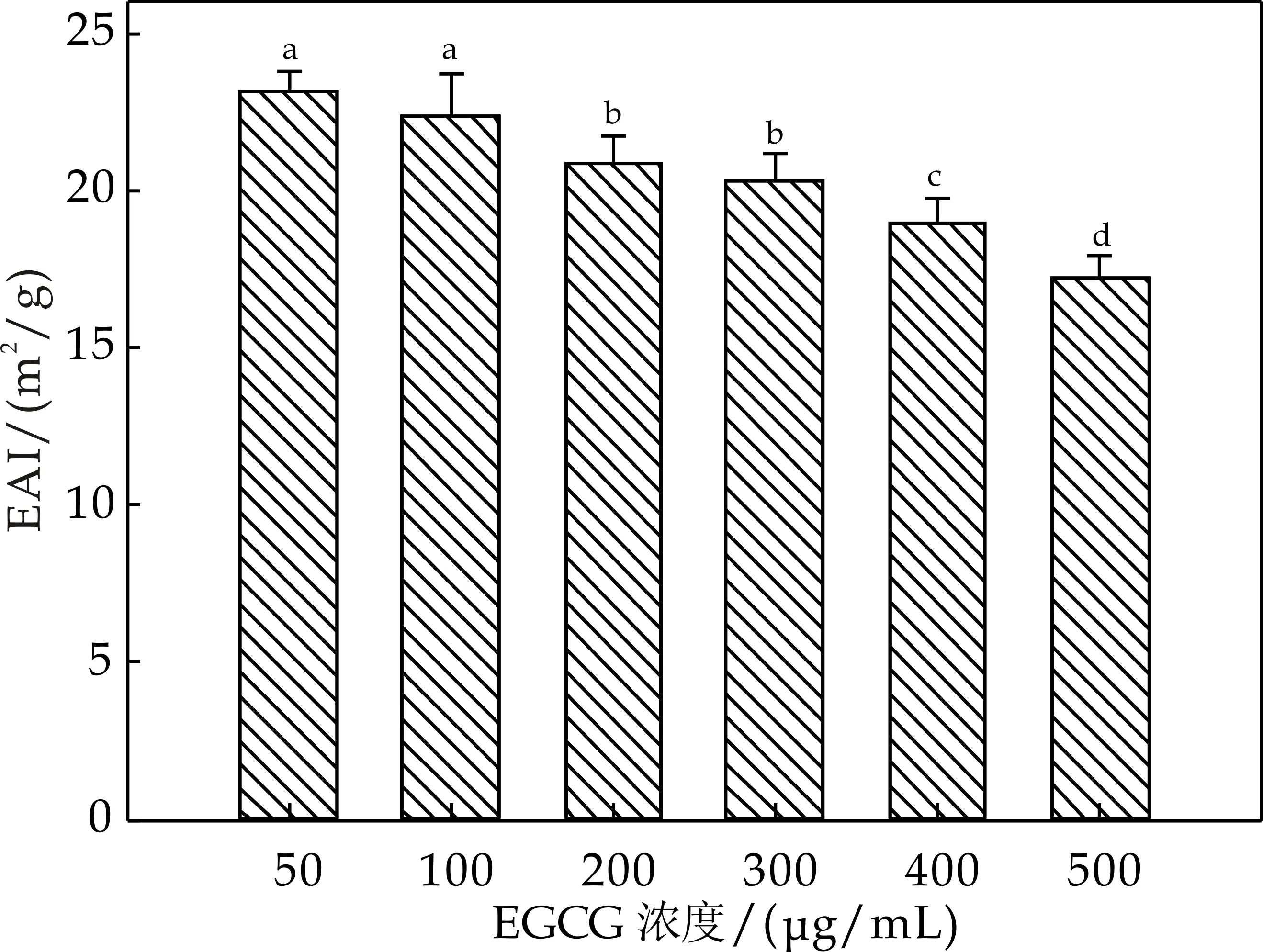
(a)不同浓度EGCG对酪蛋白乳化活性的影响
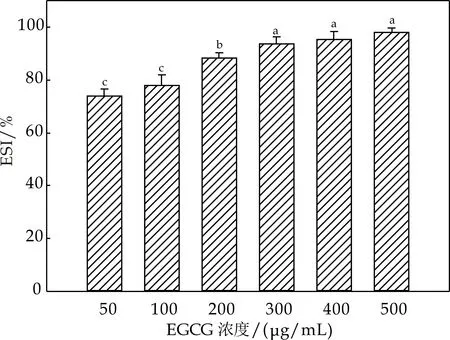
(b)不同浓度EGCG对酪蛋白乳化稳定性的影响图4 不同浓度EGCG对酪蛋白乳化性能的影响
2.2.2 氧化EGCG结合对酪蛋白乳化性能的影响
EGCG作为抗氧化剂自身易于被氧化,实验中发现,配置好的EGCG溶液放置一段时间后由于氧化作用导致溶液颜色发生变化.由于氧化后的EGCG与蛋白质结合行为会发生变化,因此进一步探究了氧化的EGCG添加对酪蛋白乳化性能的影响.
如图5(a)所示,氧化EGCG对酪蛋白乳化活性的影响具有浓度依赖性,当浓度在0~200μg/mL范围时,氧化EGCG添加几乎不影响酪蛋白乳化活性,但在400~500μg/mL范围时,会明显降低乳化活性.
氧化EGCG对酪蛋白乳化稳定性的影响如图5(b)所示.随着氧化EGCG添加量的增大,酪蛋白的乳化稳定性呈现上升趋势.氧化EGCG添加量在0~100μg/mL之间,酪蛋白的乳化稳定性上升趋势比较明显,而后上升趋势较为平缓,当EGCG添加量为500μg/mL时,酪蛋白的乳化活性约为98%.这与未氧化的EGCG对酪蛋白乳化稳定性的影响趋势基本一致.
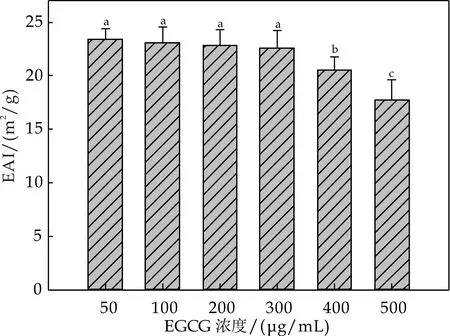
(a)氧化EGCG对酪蛋白乳化活性的影响
3 结论
采用六种方法测定了EGCG的抗氧化活性,实验结果表明,在浓度为50~500μg/mL范围内,EGCG的总抗氧化能力随浓度增大而迅速增强;EGCG的DPPH、ABTS及羟自由基清除能力趋势大体一致:在浓度为50~200μg/mL范围内,三种自由基清除能力均随浓度增大而快速增强,当浓度达到200μg/mL时,各自由基清除能力基本达到峰值(DPPH自由基88%,ABTS自由基91%,羟自由基83%),此后随浓度增大自由基清除能力无明显提升;整体来讲,EGCG的Fe2+螯合能力基本保持在15%左右,几乎不受EGCG浓度的影响;Cu2+螯合能力随浓度增大而增强,当浓度为500μg/mL时,Cu2+螯合能力约为35%,可见EGCG对Cu2+的螯合能力较Fe2+强.因此,EGCG的抗氧化能力主要源于其高效的自由基清除能力,其次是金属离子螯合能力.因而在富含金属离子的食品体系中,建议EGCG与高性能的金属离子螯合剂复配使用.
乳化实验结果表明,未氧化和氧化EGCG的添加均具有降低酪蛋白的乳化活性、提高了乳化稳定性的趋势,且均表现出了一定的浓度依赖性.当EGCG/氧化EGCG浓度在200~300μg/mL时,酪蛋白兼具较好的乳化活性和乳化稳定性.结合EGCG抗氧化活性实验结果,推荐在富含酪蛋白的食品体系中EGCG的添加量在200~300μg/mL.

