空燃比对离子电流信号的影响机理
朱登豪, 李 超, 董光宇, 邓 俊, 胡宗杰, 李理光,2
(1. 同济大学 汽车学院, 上海 201804; 2. 同济大学 中德学院, 上海 200092)
世界范围内汽车保有量的增加给能源供给和环境污染治理造成了巨大压力,各国的油耗和排放法规日趋严格,发动机行业面临严峻挑战.缸内燃烧质量对发动机的动力性、经济性和排放产生直接影响.离子电流信号能够反映缸内燃烧状态,是一种有效的缸内燃烧诊断与控制手段.与缸压传感器的高额成本和长期使用的信号漂移问题相比,离子电流检测技术成本较低,并且以火花塞为传感器,无可靠性问题,近年来离子电流信号在发动机燃烧诊断与控制方面表现突出.利用离子电流信号可以对HCCI(homogeneous charge compression ignition)发动机的燃烧相位进行闭环控制[1-2],并且可以准确诊断出失火、早燃和爆震等非正常燃烧现象,实现基于离子电流信号的发动机当前循环内失火和爆震控制[3].
相比于耦合了复杂边界条件的发动机,定容燃烧弹具有可视化和边界条件简单可控的优点,是替代发动机进行基础研究的理想装置.高忠权等[6-9]对甲烷预混燃烧离子电流信号与层流火焰速度、火焰厚度、电极间隙和电极结构的相关性做了细致的研究,研究结果表明,离子电流信号可用于计算平均层流火焰速度及火焰厚度,减小电极间隙或增大电极面积均能增强离子电流信号强度.Rao等[10]建立了简化的甲烷离子反应机理模型,基于该模型对不同当量比及初始压力下的离子电流信号进行数值模拟,其中离子电流信号相位与试验结果吻合较好,但离子电流信号幅值与试验结果有所差距.Alquaity等[11]利用高精度质谱仪对不同当量比下甲烷-纯氧-氩气火焰中的阳离子进行了详细的测量,发现不同当量比下火焰中的主要离子产物有所差异,但是浓度最高的阳离子均为H3O+.
空燃比作为影响发动机燃烧最重要的因素之一,其对离子电流信号同样会产生影响.研究表明,随着空燃比的增大,离子电流信号减弱,基于空燃比与离子电流信号的对应关系,可以利用离子电流信号来对空燃比进行闭环控制[12-13].然而已有试验通常在发动机上进行,边界条件复杂,对离子电流信号影响因素众多,并且尚未对空燃比影响离子电流信号的机理开展研究与分析.
本文在一台高压定容燃烧弹上,以甲烷为燃料,研究了空燃比对离子电流信号的影响.通过建立甲烷预混燃烧离子反应机理模型,对离子形成过程、浓度及分布情况进行了数值模拟,并对关键离子产物的化学反应路径和反应速率进行了分析,从化学反应机理层面解释了空燃比对离子电流信号影响的机理.
1 试验台架及离子电流信号检测系统
试验台架由定容燃烧弹、恒温控制系统、配气系统、点火系统、采集系统、纹影及高速摄影系统组成,如图1所示.定容燃烧弹视窗直径80 mm,恒温控制系统用于对弹体进行加热和保温,防止壁面过冷导致燃烧后的废气迅速冷凝在视窗表面.进气过程由粗调阀和微调阀精密控制,试验中同时对点火信号、压力信号和离子电流信号进行采集.高速摄影机的分辨率为256像素×256像素,拍摄频率为10 000帧·s-1,曝光时间5 μs.
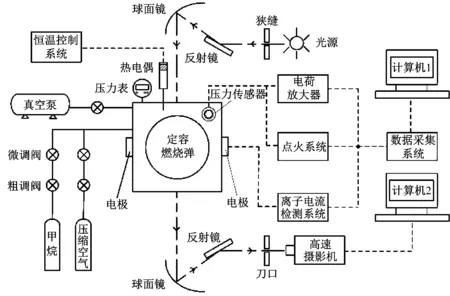
图1 定容燃烧弹试验台架[14]
离子电流信号检测系统如图2所示,利用位于燃烧弹顶部的火花塞进行点火,与发动机实际点火位置更为接近,在中心对置电极上施加直流电压,将测得的离子电流通过采样电阻转化为电压信号输出.偏置电源的调节范围为20~200 V,采样电阻的调节范围为0.1~2.0 MΩ.中心电极的材料为不锈钢,直径为0.8 mm,电极间隙为0.5 mm,电极负极与燃烧弹共同接地.
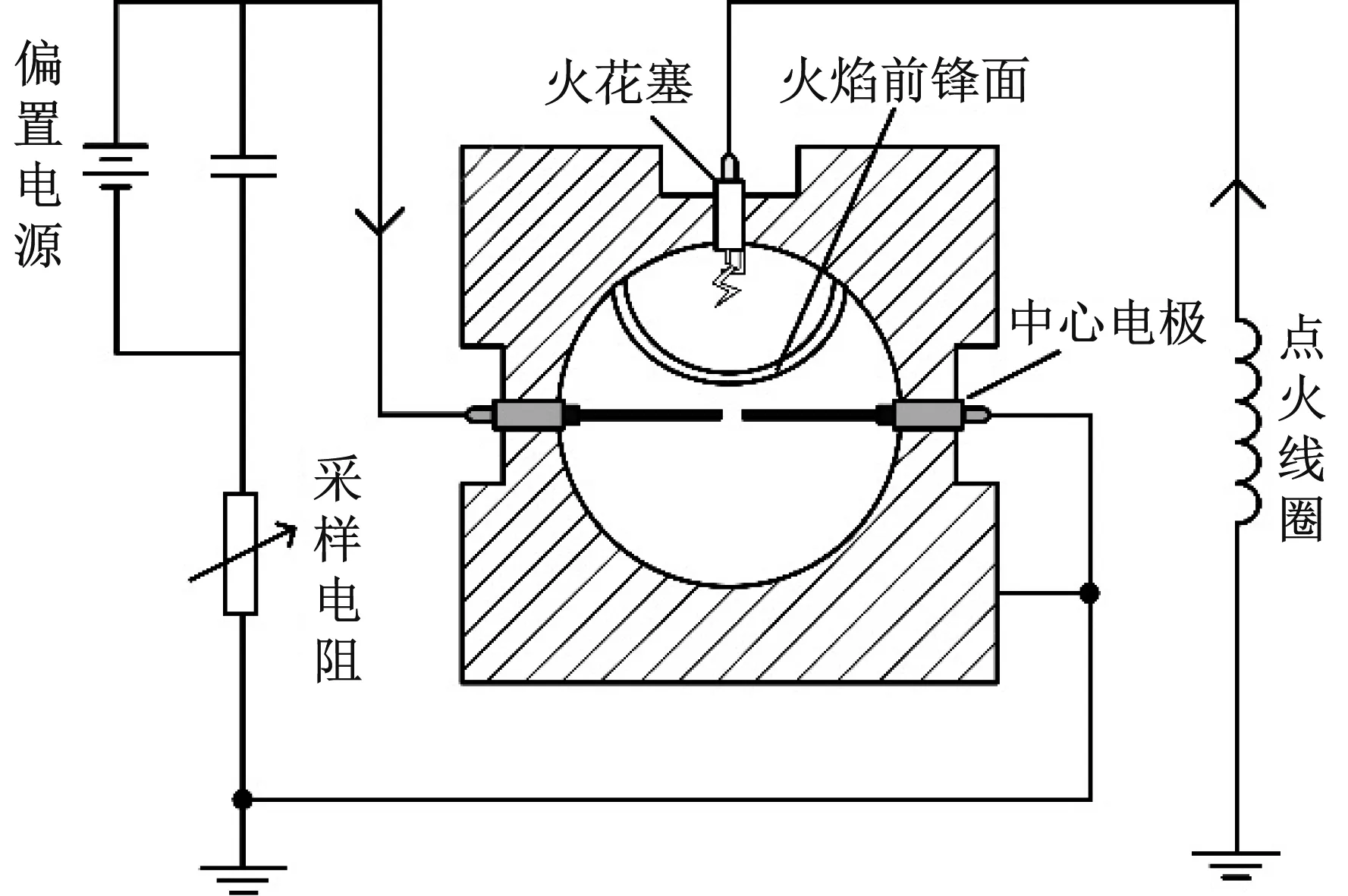
图2 离子电流信号检测系统
2 离子反应机理介绍
碳氢燃料燃烧生成离子和电子是离子电流检测技术的基础.研究表明,燃烧过程的离子反应可以分为化学电离和热电离,化学电离是由于化学重组释放的能量引起产物的电离,当电荷的生成、转移和重组结束后,系统达到平衡,此时高温使得部分燃烧产物发生热电离.由于甲烷-空气燃烧时的峰值温度超过2 000 K,化学电离和热电离过程均较为强烈,因此模拟过程中采用的离子反应机理需同时包括化学电离机理和热电离反应机理.Dibble教授提出的包含9种离子组分(CHO+、H3O+、N+、N2+、NO+、O+、O2+、OH+、e)的离子反应机理在众多关于离子电流信号的试验与仿真结果对比中得到了验证[15-18],并且包含了主要的化学电离产物及热电离产物,其中化学电离共有5步反应步骤,如表1所示,表中A为Arrhenius方程中的指前因子,b为温度指数,E为活化能.热电离共有42步.
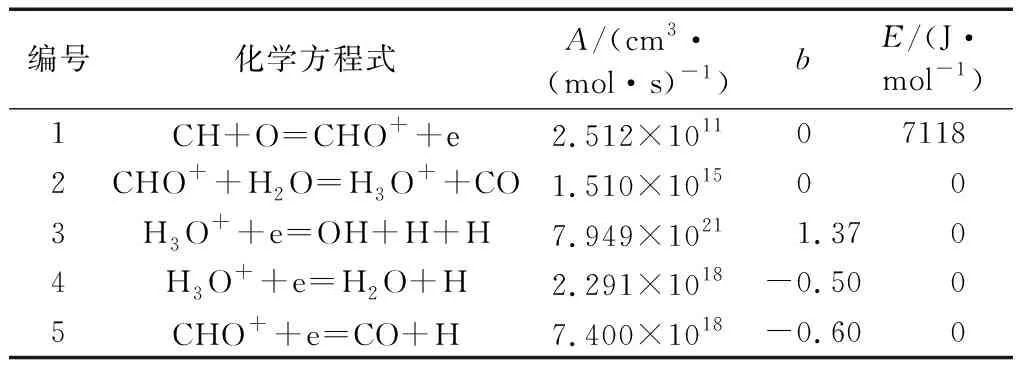
表1 化学电离反应式
GRI-Mech3.0是应用最为广泛的甲烷燃烧反应机理,适用条件为:燃烧温度1 000~2 500 K、压力0.001~1 MPa、混合气当量比0.1~5.0[19],本文试验工况满足其适用条件.将GRI-Mech3.0与离子反应机理结合,组成了包含62种组分、372个基元反应的甲烷离子反应机理.
3 试验结果分析
试验初始压力为0.3 MPa,混合气初始温度为293 K,燃烧弹内壁温度控制在328 K,点火蓄能时间为5 ms,偏置电压为100 V,采样电阻为100 kΩ.混合气的配制遵循道尔顿分压定律.式(1)为CH4充气压力计算公式,式(2)为空气充气压力计算公式.表2为不同过量空气系数下的甲烷和空气分压.
(1)
(2)
式中:pCH4为CH4分压;pair为空气分压;p0为混合气初始压力;λ为过量空气系数;RA/F为化学计量比下的空气与燃料质量比;Mair为空气的摩尔质量;MCH4为CH4摩尔质量.
表2不同过量空气系数下甲烷和空气分压
Tab.2Methaneandairpartialpressureatdifferentexcessaircoefficient
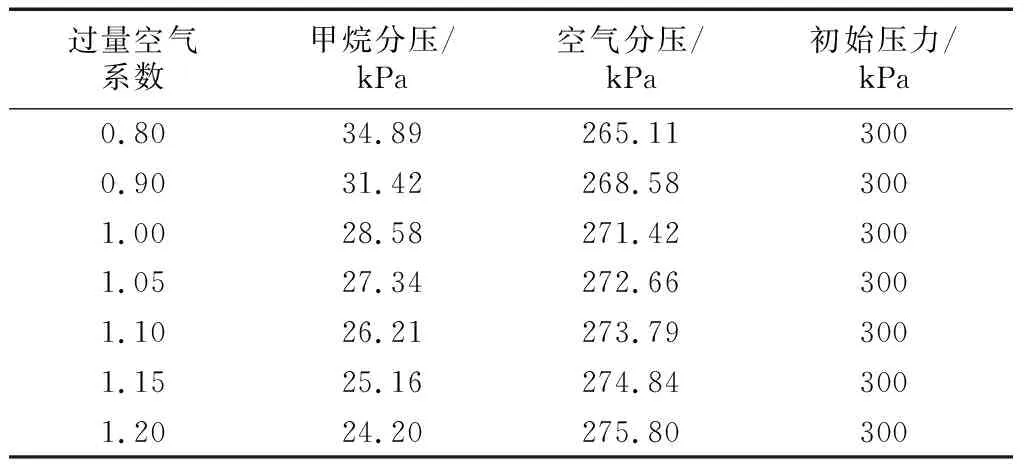
过量空气系数甲烷分压/kPa空气分压/kPa初始压力/kPa0.8034.89265.113000.9031.42268.583001.0028.58271.423001.0527.34272.663001.1026.21273.793001.1525.16274.843001.2024.20275.80300
将采集到的离子电流信号和燃烧压力与火焰发展的纹影图片一一对应,结果如图3所示.点火线圈蓄能5 ms后,火花塞放电击穿空气引燃混合气,在T0时刻,火焰前锋面与中心电极接触形成了离子电流信号第1峰,并在T1时刻达到最大值,随后火焰前锋面远离电极向下传播,离子电流信号下降.到T2时刻离子电流信号产生了第2个峰.从纹影图片可知此时火焰已经完全碰壁,燃烧压力接近最大值.为了便于后续分析,定义离子电流信号第1峰值时刻为T1,第1峰值为I1;第2峰值时刻为T2,第2峰值为I2;燃烧压力峰值时刻为Tp,燃烧压力峰值为pmax.对过量空气系数为0.80、0.90、1.00、1.05、1.10、1.15和1.20的离子电流信号和燃烧压力进行测量.取过量空气系数为0.80、1.00和1.20分别代表浓混合气、化学当量比混合气和稀混合气,对应的离子电流信号和燃烧压力如图4所示.由图4可知,过量空气系数会影响离子电流信号的幅值及相位,但不会影响离子电流信号的形态.
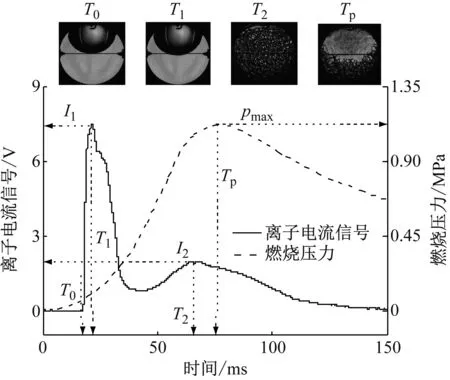
图3 离子电流信号和燃烧压力与对应的火焰发展
Fig.3Ioncurrentsignalandcombustionpressurewithcorrespondingflamedevelopmentimages
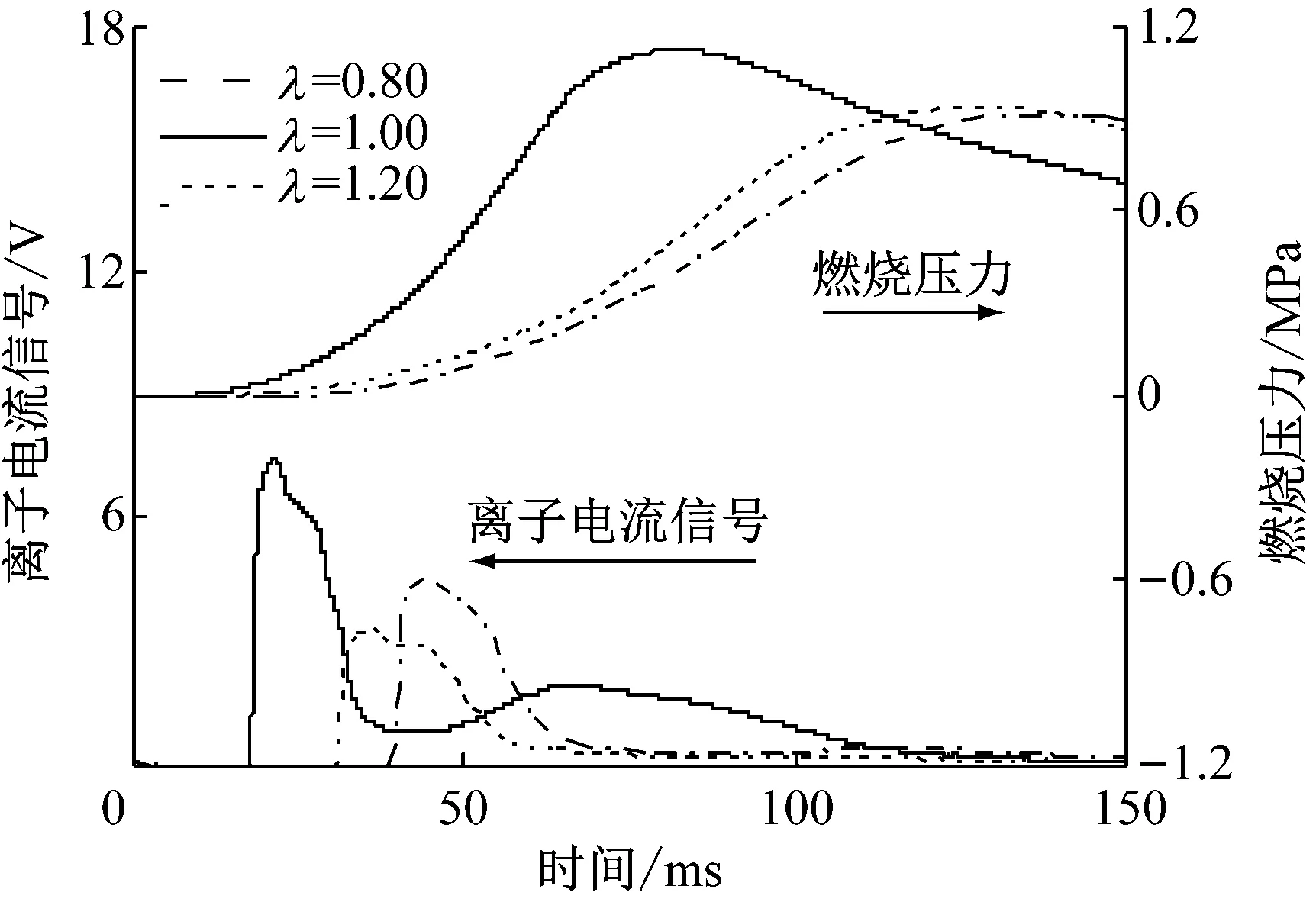
图4 不同过量空气系数下离子电流信号与燃烧压力
利用前文定义的离子电流信号特征值对试验结果进行定量分析,结果如图5、6所示.无论是离子电流信号第1峰、第2峰还是燃烧压力峰,均在过量空气系数为0.90时取得最大值,峰值时刻最为提前,混合气过浓或过稀会导致离子电流信号幅值下降,峰值时刻推迟.
从图6可知,离子电流信号第2峰与燃烧压力峰在幅值和相位上具有高度相关性,利用式(3)对两者之间的相关系数进行计算,结果如图7所示.其中离子电流信号第2峰值与燃烧压力峰值的相关系数为0.90,离子电流信号第二峰值时刻与燃烧压力峰值时刻的相关系数为0.98,均为高度相关.

图5 过量空气系数对离子电流信号第1峰值的影响
Fig.5Effectofexcessairratioonthefirstpeakofioncurrentsignal
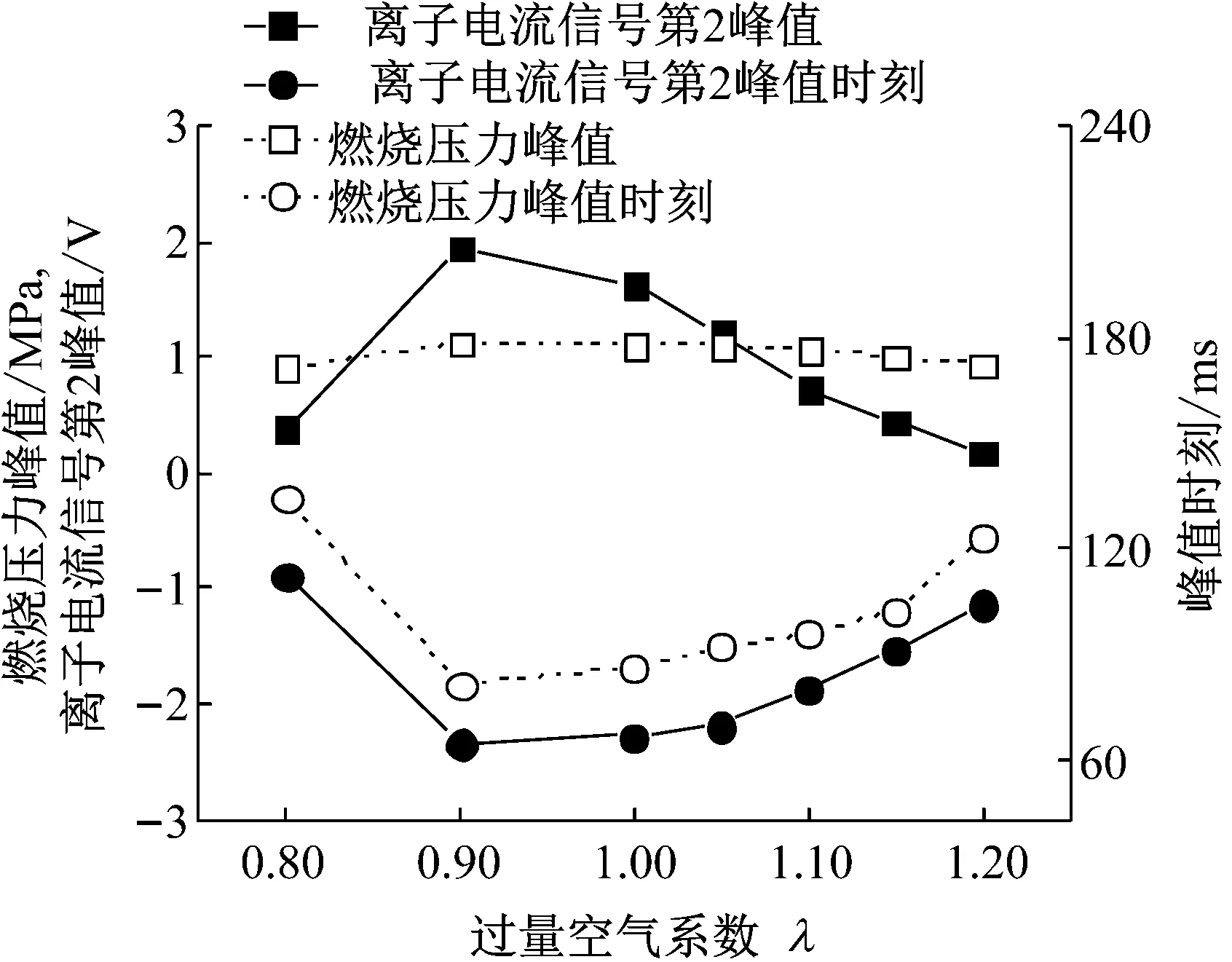
图6 过量空气系数对离子电流信号第2峰值及燃烧压力的影响
Fig.6Effectofexcessairratioonthesecondpeakofioncurrentsignalandpressure
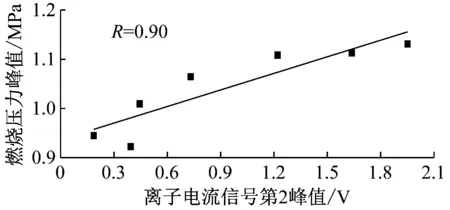

图7 离子电流第2峰值与燃烧压力相关性

(3)
式中:Cov(X,Y)为X与Y的协方差;Var[X]为X的方差;Var[Y]为Y的方差.
4 模拟结果分析
4.1 离子形成过程、浓度及分布
本文试验条件为甲烷预混定容燃烧,利用化学动力学软件Chemkin-Pro内的闭式均质反应器模型(Closed Homogeneous Batch Reactor)进行模拟.根据燃烧弹内腔尺寸设定反应容积为8.84×10-4m3,根据试验测得的离子电流信号及纹影图片,设定反应终了时间为0.1 s,此时火焰已经完全碰壁,燃烧过程结束,燃烧产物的浓度趋于稳定.对初始压力为0.3 MPa、化学当量比下的甲烷-空气预混燃烧进行模拟,对离子形成过程及浓度进行分析,结果如图8所示.

图8 离子浓度、甲烷浓度和燃烧温度变化情况
在燃烧过程前期,温度较低,甲烷经过一系列链式反应生成CH,CH与O结合生成初级离子产物CHO+,随后通过反应2,CHO+被迅速消耗生成H3O+,由于反应1中电子的生成速率和反应2中H3O+的生成速率十分接近,因此两者几乎是同步变化.当H3O+达到浓度峰值时,甲烷已经完全反应,不能再继续生成CH,H3O+浓度开始下降,而燃烧温度持续升高超过2 000 K,NO+、O2+、OH+等热电离产物的浓度逐渐达到峰值,其中NO+的浓度明显高于其他热电离产物,原因在于此时离子反应N+O=NO++e的正向反应速率远大于其他离子反应,通过该反应生成的电子弥补了由于化学电离作用减弱造成的电子浓度下降,因此电子浓度一直保持在较高的水平.
从图8可知,离子相比于其他燃烧产物的浓度要低很多,不同离子间的浓度差异较大,浓度最高的电子e和浓度最低的N+之间相差13个数量级.化学电离产物中H3O+的浓度最高,热电离产物中NO+的浓度最高,因此H3O+和NO+分别为化学电离和热电离最主要的离子产物.
进一步地,利用Fluent软件耦合甲烷离子反应机理,对离子分布情况进行数值模拟.由于定容燃烧弹为Φ80 mm×176 mm的圆柱体,因此在火焰碰壁之前,火焰从燃烧弹顶部以近似球形向下传播,可以利用二维平面代替三维模型减少计算时间.为了模拟壁面的传热损失,将壁面温度设置成与试验时相同的338 K.此外,从纹影图片可知,火焰前锋面光滑,没有明显的不规则脉动,通过计算得到不同过量空气系数下从点火到火焰前锋面碰壁时的平均火焰传播速度为1.98 m·s-1,与文献16测得的层流火焰传播速度接近,因此选用层流黏性模型.
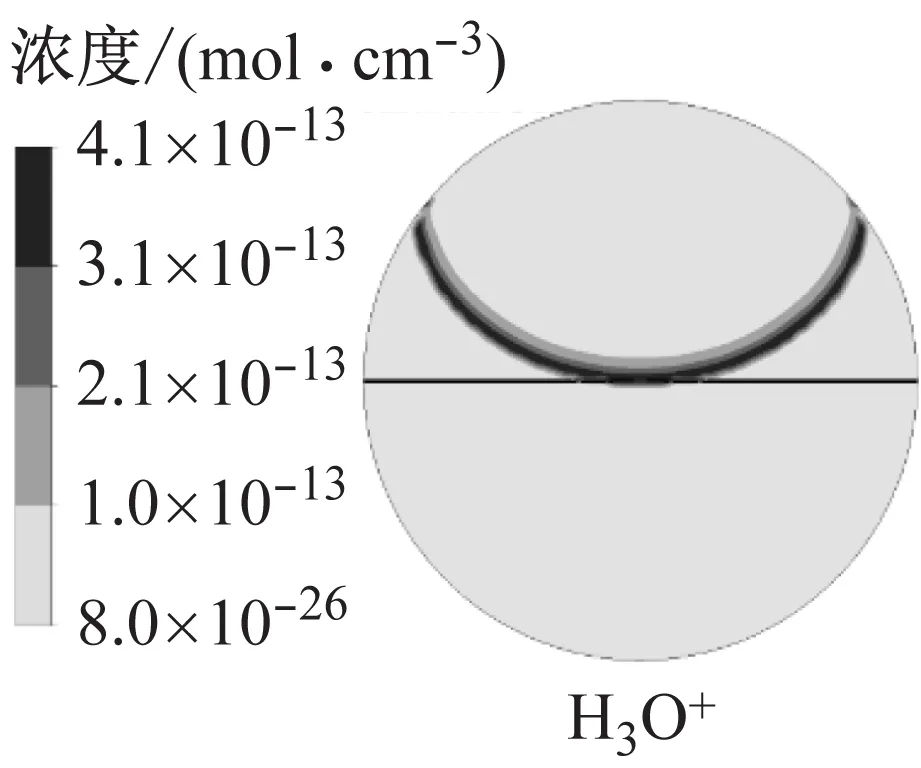
图9为模拟得到的火核形成及火焰前锋面接触中心电极时的燃烧温度以及H3O+、e和NO+的浓度.火核形成初期,燃烧温度和离子浓度很低,随着火焰向下传播,火焰前锋面与未燃混合气的接触面积增大,燃烧温度逐渐升高,当火焰与中心电极接触时,燃烧温度约为2 500 K,此时H3O+和e的浓度相比于火核形成初期提高了10个数量级,NO+的浓度提高了14个数量级.其中化学电离产物分布在火焰前锋面,而热电离产物则分布在焰后高温区,该结果与文献11的模拟结果相近,不同在于本文采用详细离子反应机理模型,并且考虑了热电离过程,因此得到的电子呈带状分布而非条状分布.
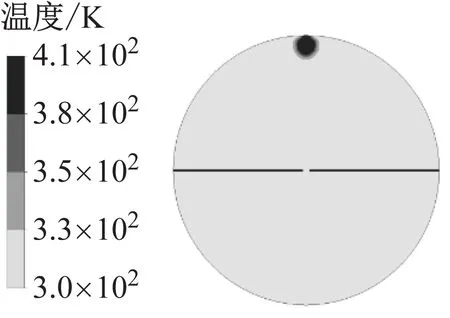

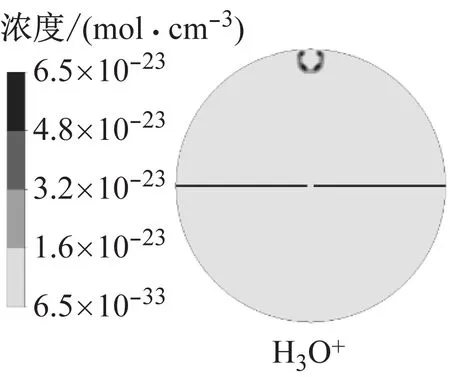
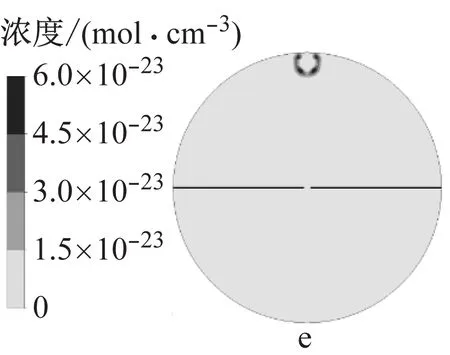
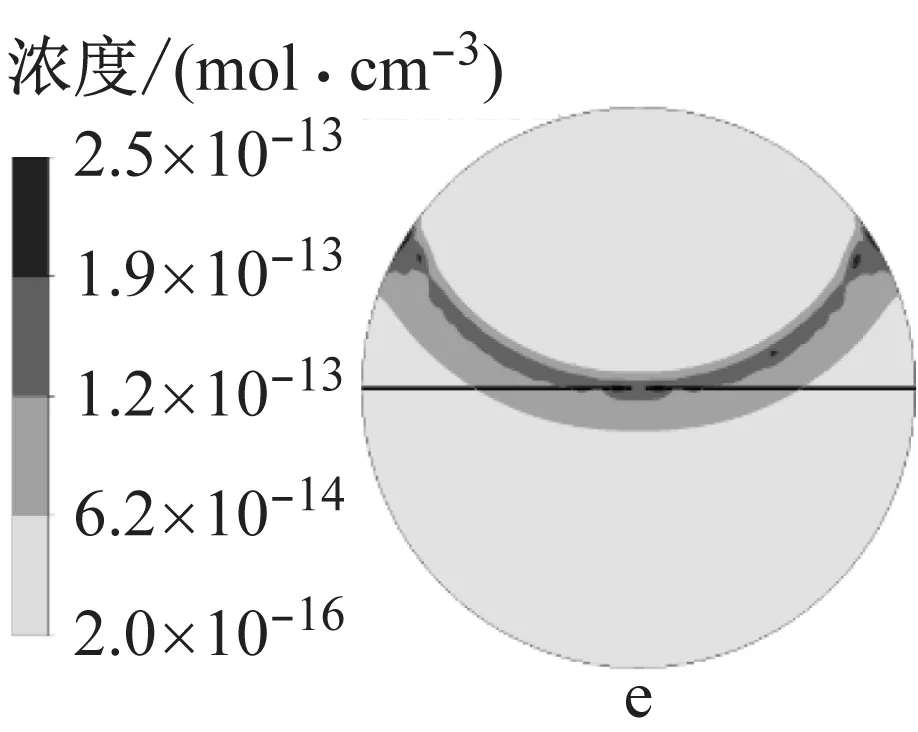
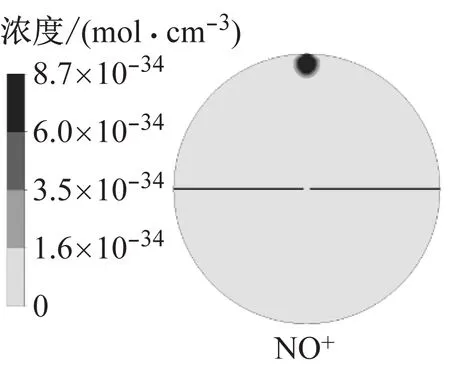
a 火核形成
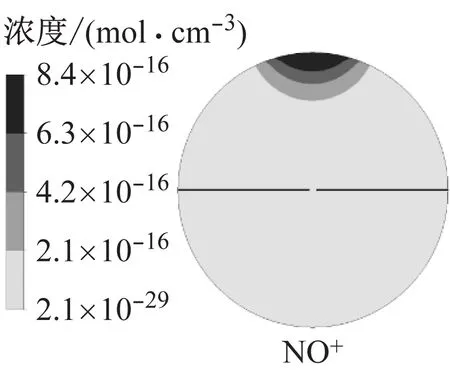
b 火焰接触中心电极
在本文试验中测得的离子电流第1峰起始时刻为火焰前锋面接触中心电极时刻,因此可以确定离子电流第1峰为化学电离峰,而离子电流第2峰出现时刻略早于缸压峰值,此时火焰已经碰壁,燃料被完全消耗,燃烧过程结束,无法再进行化学电离过程,而是通过高温使得燃烧产物发生热电离,因此离子电流第2峰为热电离峰.
4.2 空燃比对离子电流信号影响的机理分析
不同过量空气系数下H3O+峰值浓度、NO+峰值浓度及层流火焰速度如图10所示.当过量空气系数为0.90时,H3O+和NO+峰值浓度最大,因此化学电离峰值和热电离峰值最高.此外,该过量空气系数下层流火焰速度最快,因此火焰最先与中心电极接触形成化学电离峰,并且燃烧温度上升速率最快,热电离峰也最早到来.
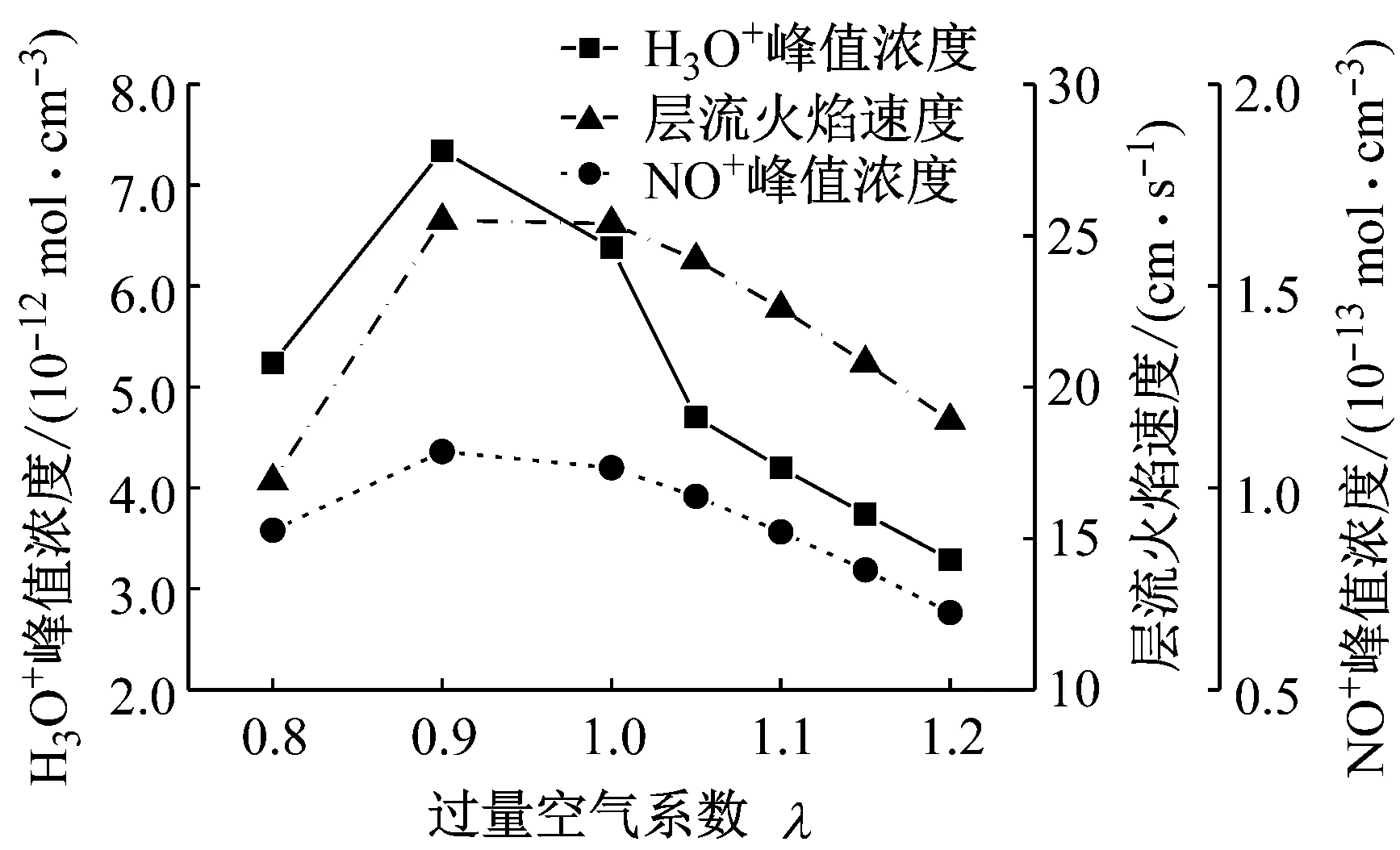
图10不同过量空气系数下H3O+峰值浓度、NO+峰值浓度与层流火焰速度
Fig.10PeakconcentrationofH3O+andNO+andlaminarflamespeedatdifferentexcessairratios
为了研究离子浓度随过量空气系数变化的机理,对离子浓度随反应时间变化求一阶导数,得到离子反应速率,计算方法如式(4)所示.
(4)
式中:[X]t+1为t+1时刻的离子浓度;[X]t为t时刻的离子浓度;Δt为从t+1时刻到t时刻的时间间隔;v代表离子反应速率.
定义H3O+反应速率峰值时刻为“C”时刻,NO+反应速率峰值时刻为“T”时刻,用于表征化学电离和热电离反应最为剧烈的时刻,如图11、12所示.从图11可知,“C”时刻与放热率峰值时刻为同一时刻,这也验证了化学电离发生在燃烧反应最为剧烈的火焰前锋面这一结论.

图11 “C”时刻定义

图12 “T”时刻定义
由于产物的生成和消耗涉及众多基元反应,每个基元反应具有不同的反应速率,因此要分析离子反应速率随过量空气系数的变化情况,首先需要对离子的反应路径进行分析,找出决定反应速率的关键反应路径.
以化学当量比工况为例,“C”时刻H3O+反应路径如图13所示,与H3O+直接相关的离子反应为表1中的反应2、3、4,反应2 的正向反应速率大于逆向反应速率,因此该反应生成H3O+,生成速率为1.34×10-5;反应3、4的正向反应速率大于逆向反应速率,所以这两个反应消耗H3O+,其中反应3的H3O+消耗速率为2.51×10-7,反应4的H3O+消耗速率为9.95×10-7,因此H3O+的总消耗速率为1.246×10-6.由于H3O+的生成速率大于消耗速率,因此H3O+的浓度是增加的.
对于不同的过量空气系数,模拟结果表明“C”时刻H3O+的反应路径都相同,且均为反应2生成H3O+,反应3和4消耗H3O+,但是H3O+的生成速率和消耗速率受过量空气系数的影响,结果如图14所示,其中H3O+的消耗速率为反应3和反应4的消耗速率之和,H3O+的净生成速率为生成速率减去消耗速率.当过量空气系数为0.90时,H3O+净生成速率取得最大值.
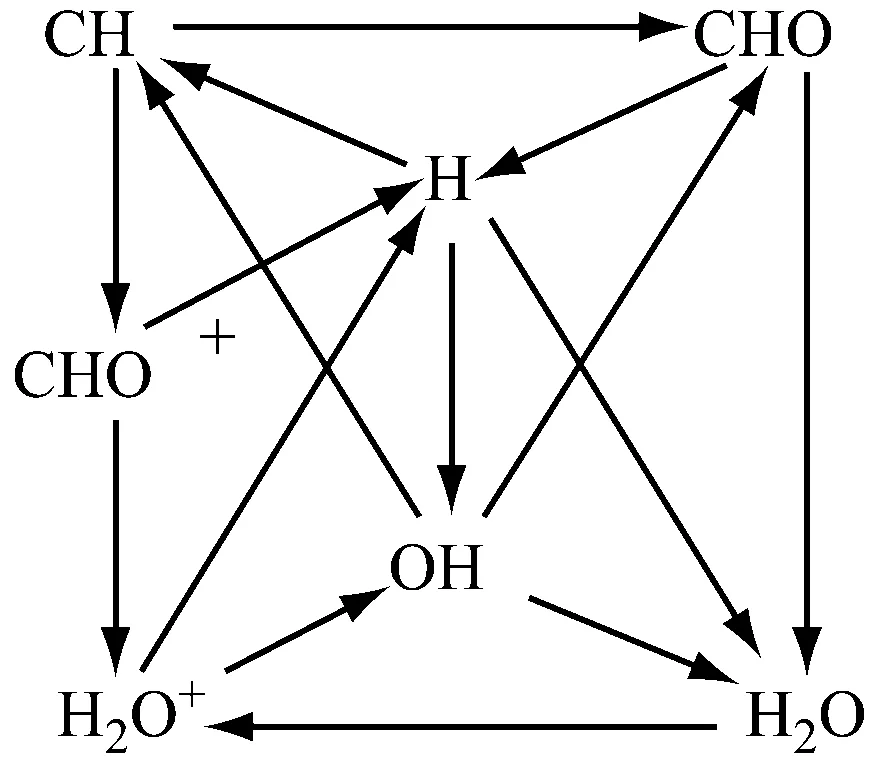

图13 “C”时刻H3O+反应路径

图14 不同过量空气系数下H3O+的反应速率与燃烧温度
Fig.14ReactionrateofH3O+andcombustiontemperatureatdifferentexcessairratios
在化学反应过程中,反应速率受反应速率常数和反应物浓度控制,如式(5)所示.对式(5)中的温度T求偏导得到式(6).
(5)
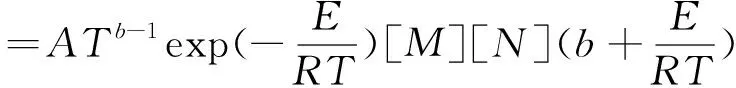
(6)
式中:A为指前因子;T为温度;b为温度因子;E为活化能;R为通用气体常数;[M]、[N]为反应物浓度.
反应1中b为0,A和E均大于0,因此反应1的反应速率与温度正相关,过量空气系数为0.90时“C”时刻的燃烧温度最高,反应1的反应速率最快,CHO+浓度最高.对于反应2,温度因子b和活化能E均为0,指前因子A大于0,反应速率只受反应物浓度的影响,因此CHO+浓度越高,反应2的反应速率越快,H3O+浓度越高.对于反应3和4,A大于0,b小于0,E等于0,反应速率同时受温度和反应物浓度的控制,并与温度呈负相关,与反应物浓度呈正相关.对于反应3和4,反应物浓度增大对反应速率的促进作用大于温度升高带来的抑制作用,因此反应3和4中H3O+的消耗速率在过量空气系数为0.90时同样取得最大值.
整体来看,过量空气系数为0.90时,H3O+的生成速率最大,消耗速率也最大,但由于消耗速率远小于生成速率,对净生成速率的影响不大,因此在该过量空气系数下H3O+的净生成速率最大,浓度最高.
对于热电离过程,“T”时刻NO+反应路径如图15所示.与NO+相关的反应共有11个,但是不同反应间的反应速率相差较大,对NO+反应速率起决定作用的只有N+O=NO++e,该反应的正向反应速率为7.82×10-10,逆向反应速率为2.22×10-10,NO+的净生成速率为5.6×10-10.由于该反应的A大于0,b等于0,E大于0,反应速率与温度呈正相关,当过量空气系数为0.90时,“T”时刻燃烧温度最高,因此NO+净生成速率最大,浓度最高.


图15 “T”时刻NO+反应路径
目前对发动机离子反应机理的研究通常针对HCCI工况,燃烧温度较低,热电离过程不明显,主要研究对象为化学电离过程;而在燃烧器或者燃烧弹上对离子反应进行研究时,通常利用纯氧加氩气来代替空气,没有引入氮元素,因此对于热电离过程的普遍理解为低电离能的NO电离生成了NO+,而从本文对NO+的化学反应路径及反应速率分析可知,由NO电离生成NO+这一反应路径的反应速率非常低,由该反应生成的NO+的浓度十分有限,生成NO+的主要路径为N2→N→NO+.
5 结论
本文在一台高压定容燃烧弹上,以甲烷为燃料,试验研究了空燃比对离子电流信号的影响.通过建立甲烷预混燃烧离子反应机理模型,对离子形成过程、浓度和分布情况进行了数值模拟,并对关键离子产物的化学反应路径和反应速率进行了分析,从化学反应机理层面解释了空燃比对离子电流信号影响的原因.主要结论如下:
(1)空燃比会影响离子电流信号的幅值和相位,但不会影响离子电流信号的形态.当过量空气系数为0.90时,离子电流信号幅值最大,相位最为提前.
(2)不同离子之间的浓度差异较大,浓度最高的e和浓度最低的N+相差13个数量级.化学电离发生在燃烧反应最为剧烈的火焰前锋面,最主要的离子产物为H3O+.热电离发生在焰后区,最主要的离子产物为NO+.热电离峰与燃烧压力具有高度相关性,其中热电离峰值与燃烧压力峰值的相关系数为0.773,热电离峰值时刻与燃烧压力峰值时刻的相关系数为0.953.
(3)空燃比不会影响H3O+和NO+的化学反应路径,H3O+的主要生成路径为CH→CHO+→H3O+,NO+的主要生成路径为N2→N→NO+.
(4)反应物浓度和燃烧温度共同控制反应速率,当过量空气系数为0.90时,H3O+和NO+的净生成速率最大,浓度最高.

