结晶葡萄糖母液对赖氨酸发酵过程的影响
,,
(长春大成实业集团有限公司,吉林 长春 130062)
结晶葡萄糖母液,经济价值较低,怎样合理处理利用是结晶葡萄糖企业面临的一大难题.目前,采用膜分离技术除去母液中的杂糖,不仅设备投资大,而且操作工艺复杂,难以用于大规模生产;而直接用于酒精、柠檬酸发酵生产则因其产品附加值低,成本难以控制.因此,有效地利用结晶葡萄糖母液,既能解决结晶葡萄糖的生产成本,又能为企业生产其他产品开发出新的原料资源.通过对结晶葡萄糖母液和L-赖氨酸发酵糖(以下简称发酵糖)的理化指标进行比较,各项指标虽然存在一定的差别,但都含有大量葡萄糖,如在L-赖氨酸生产中用部分结晶葡萄糖母液替代发酵糖制成混合发酵糖进行发酵,并用此和发酵糖发酵过程进行一一对比、分析,研究混合发酵糖在产酸、各时段耗糖、赖氨酸增加量、糖酸转化率以及发酵末期残糖情况.
1 材料与方法
1.1 材 料
1.1.1 菌 种
L-赖氨酸菌,由长春大成实业集团有限公司研发中心提供.
1.1.2 原 料
结晶葡萄糖母液由长春帝豪结晶糖开发实业有限公司提供,发酵糖由长春宝成生化工程有限公司自产.
1) 结晶葡萄糖母液
结晶葡萄糖提纯采取降温结晶工艺,淀粉乳(波美度18~20,pH 5.8~6.1)通过调浆、液化、糖化后,经活性炭脱色、树脂离交分离等工序净化处理,经四效蒸发浓缩得到精制葡萄糖(固形物质量分数≥69.8%、pH 3.5~4.5、葡萄糖质量分数≥95.5%、电导率<50 μs/cm、透光率≥92.0%)通过搅拌降温,形成晶浆混合体,经过离心机分离出晶体后的剩余部分成为结晶葡萄糖母液[1],母液除了含有糖,还有灰分、蛋白质和羟甲基糠醛等杂质,见表1.糖分由葡萄糖、二糖和多糖组成,见表2[2].

表1 结晶葡萄糖母液的化学组成Table 1 Chemical composition of crystalline glucose mother liquor
表2结晶葡萄糖母液中糖分的组成
Table2Thecompositionofsugarincrystallineglucosemotherliquor

糖分组成质量分数/%葡萄糖54.5~55.5二糖25.5多糖6.5~7.5
一次结晶葡萄糖母液经四效蒸发浓缩后,固形物质量分数63%;葡萄糖质量分数≥90.0%;pH≥3.5.
2) 赖氨酸发酵糖(以下简称发酵糖)
淀粉乳(波美度18~20,pH 5.8~6.1)经调浆,在α-淀粉酶作用下将淀粉乳液化,经过液化的混合液直接加入糖化酶进入糖化阶段,液化过程中除了加淀粉酶还要加氯化钙,pH 6.0~6.2,喷射温度106~108 ℃,特别注意糊化时间不少于3 min,碘试为棕红色为宜,不能液化过头[3],降温至95~98 ℃维持1.5~2 h;淀粉乳液化后,通过冷却器降温至60 ℃进入糖化罐,加入糖化酶进行糖化.糖化温度控制在60 ℃左右,pH 4.5,糖化周期30~35 h,对发酵水平最合适糖化周期过长或过短,均可造成糖化副反应的增加[4].经液化、糖化(DE值≥97.0%,葡萄糖质量分数≥95.0%),不经活性炭脱色、树脂离子交换直接经真空转鼓过滤粗蛋白,再蒸发浓缩至(固形物质量分数59%~61%),见表3.

表3 发酵糖的化学组成Table 3 The chemical composition of fermented sugar
1.2 方 法
1.2.1 混合发酵糖的配制
以20%结晶葡萄糖母液和80%发酵糖混合形成的混合发酵糖.
1.2.2 发酵培养基和发酵罐培养条件
MgSO40.136 g/dL, KCl 0.027 g/dL,甜菜碱0.182 g/dL,泡敌0.005 g/dL, H3PO40.009 6 g/dL,糖71.06 g/dL,生物素0.000 05 g/dL,苏氨酸0.91%(体积分数),玉米浆1.82%(体积分数).
发酵罐体积500 m3,最大装液量270 m3,按接种量10%,使用风量120~180 m3/min,pH 6.8~7.0,罐压1.0~1.2 kg/cm2,培养温度36~37 ℃,培养时间51 h.
1.2.3 补糖方法
糖71.06 g/dL,经过110 ℃连消灭菌,降温至60~70 ℃到达封闭储罐中,保压2.5~2.6 kg/cm2.
1.2.4 分析方法
赖氨酸测定方法:茚三酮显色法.
糖的检测方法:斐林试剂法.
pH测定:pH电极法.
2 结果与分析
L-赖氨酸生产中,发酵基础培养基或发酵过程中间补加混合发酵糖,跟以发酵糖配制基础培养基或发酵过程中间补加发酵糖发酵进行对比,每种糖发酵任意抽取10个罐批次,在各时间段L-赖氨酸的产生量、发酵中间过程补糖量、赖氨酸增加量、糖酸转化率以及发酵末期残糖进行比较.
采用连续补料分批发酵的方式进行对比,连续补料分批发酵是低浓度发酵,即发酵培养基初糖分浓度较低,这样就解除了基质浓度过高而形成的阻遏效应,避免了由于代谢产物积累过度而形成的反馈抑制作用[5],当发酵培养一定时间后,连续补加新鲜培养基,每隔一段时间排放出一定体积的发酵液,这样适时合理地调节营养物质浓度解决了阻遏效应[6],发酵过程中发酵液体积在不影响搅拌和泡沫可控的情况下,保证发酵罐内物料糖分及其它营养成分满足菌种的需要.
2.1 发酵过程中各时间段赖氨酸产酸情况比较
在同一发酵工艺,即相同菌种、使用风量、pH、压力和温度的情况下,两种糖在配置基础培养基和补加糖浓度上相同,发酵方式是连续补料分批发酵,发酵时间为51 h,每间隔3 h检测罐内料液糖分、OD值(透光率)的变化,在保证发酵罐内糖分1.0 g/dL左右,向罐内补加糖、硫酸铵和总氮等营养基质,发酵罐内物料体积不断增加;发酵培养12 h后,每间隔6 h对发酵罐内发酵液取样检测;发酵后期由于菌种进入衰退期,监测频率增加,每间隔3 h对发酵罐内发酵液赖氨酸含量进行检测;发酵48 h后,补料和连续放料基本结束.48 h和51 h视为最后放罐样,取一个检测样,测赖氨酸含量,其他糖检测和糖酸转化率的计算都是按这个时间段标注,根据发酵罐内料液的体积及产酸情况,采用间接式或连续式放料的方法,保证发酵罐内体积不影响搅拌和泡沫可控,每种糖发酵各抽取10个批次,对10个罐批次不同发酵时间段(12,18,24,30,42,45,51 h)的L-赖氨酸质量浓度进行比较,见图1.

图1 发酵糖和混合发酵糖在发酵过程中产酸的变化曲线对比Fig.1 Comparison of the variation curves of acid in fermentation process between fermented sugar and mixed fermented sugar
在发酵末期产酸,混合发酵糖为16.17 g/dL,发酵糖为17.19 g/dL,低1.02 g/dL.
2.2 发酵糖和混合发酵糖发酵各时间段补加糖量对比
赖氨酸发酵是微生物经过一个复杂生长的过程,赖氨酸菌种不断摄取原料的营养,消耗碳源、氮源,发酵罐不断补加糖、硫酸铵和总氮等以维持菌种的营养需求,达到多产酸的目的.在发酵过程中每间隔3 h取样检测罐内发酵液糖分含量,在保证发酵罐内菌种用糖的情况下,向罐内补加糖,见图2(发酵12 h后,间隔6 h;发酵42 h后间隔3 h各时段的耗糖量).
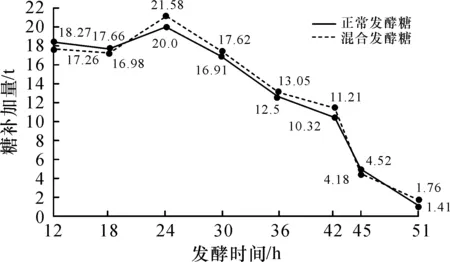
图2 发酵糖和混合发酵糖各发酵时段的糖补加量曲线对比Fig.2 Comparison of sugar supplementation curves between fermented sugar and mixed fermented sugar
2.3 发酵糖和混合发酵糖发酵各时间段赖氨酸增加量对比
根据赖氨酸连续补料分批发酵菌种的生化代谢特点,在发酵过程中加入一定量的生物素,在生物素限量的情况下,由于菌体细胞合成不完整,谷氨酸能够从细胞内渗透到细胞外,使细胞内谷氨酸含量降低,谷氨酸对谷氨酸脱氢酶的反馈控制失控,谷氨酸不断被优先合成[7],这一现象同样在赖氨酸生化反应中表现出来,发酵培养过程中,不同时间段赖氨酸菌种产酸量不同,发酵12 h后,每6 h检测一次发酵罐内赖氨酸含量,计算12,18,24,30,42,45,51 h各时间段赖氨酸增加量,结果见图3.
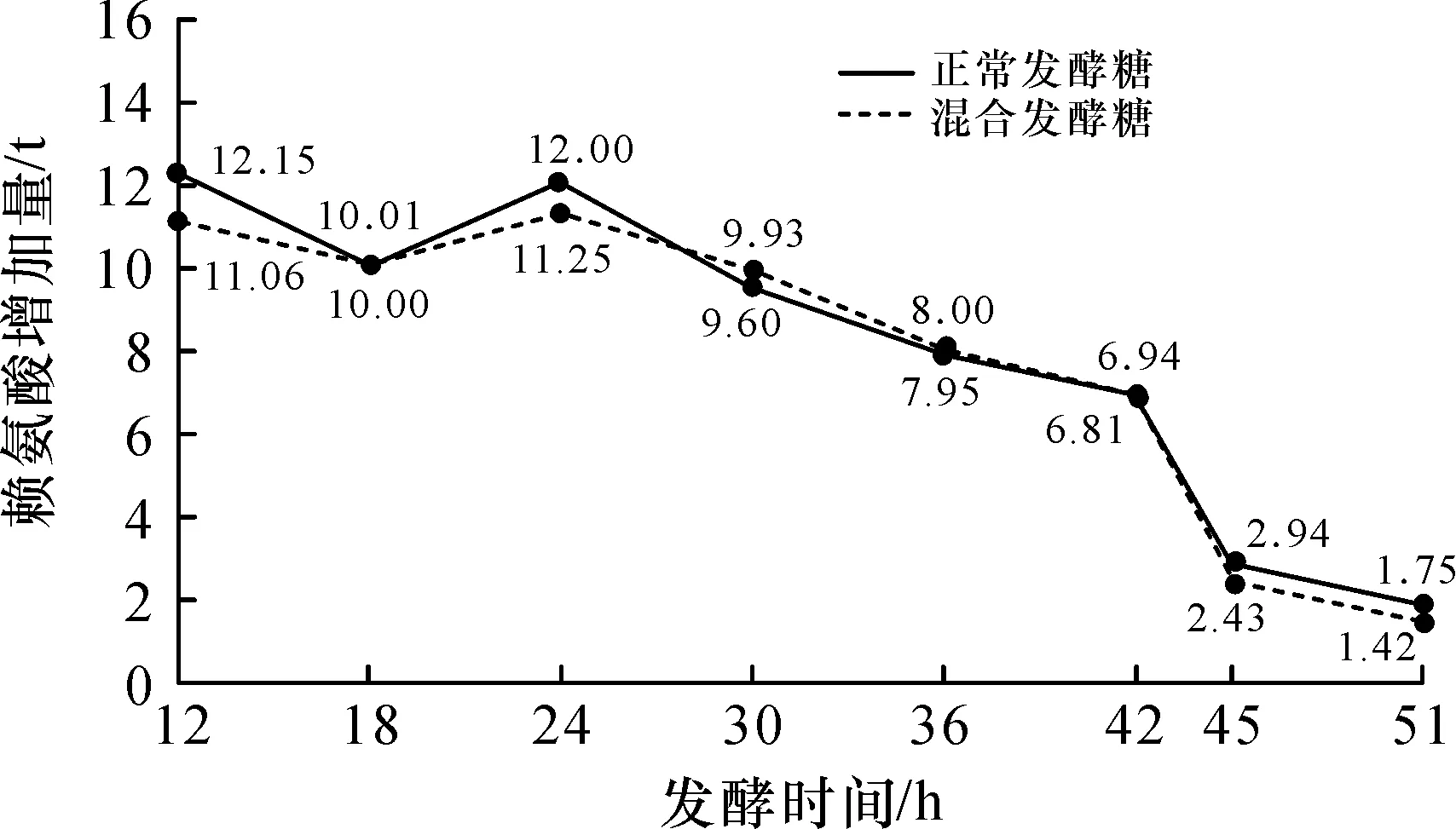
图3 发酵糖和混合发酵糖在各发酵时间段赖氨酸的增加量曲线对比Fig.3 Comparison curve of the increase of lysine between fermented sugar and mixed fermented sugar
2.4 发酵过程中发酵罐补料总体积、连续放料体积及糖酸转化率的比较
在连续补料分批发酵中,发酵罐进料定容体积+种子接种量体积=发酵罐初始发酵体积.
向发酵罐内补加糖、硫酸铵和总氮等,发酵罐内料液体积不断增加,液位不断升高,产生的泡沫已经无法通过添加消泡剂除掉,对发酵罐的搅拌动力系统产生极大的威胁,发酵初糖和补加糖的总体积占发酵液的总体积的60%,其质量对发酵液的产酸和转化率影响很大[8],需要定期从发酵罐底部排除部分发酵液,以保证发酵罐继续工作,维持一个发酵周期结束.采用连续补料分批发酵的方法,由于基质的不断补入,既满足了微生物生长和产物合成的需要,又避免了由于基质过量引起的各种调控反应,从而使产率获得很大提高.通过少次多量—少量多次—补加—微机控制流加,整个发酵过程中不断地调节补料,维持各项营养物质的供需平衡,保证发酵罐内总体积小于270 m3.发酵糖和混合发酵糖补料总体积及连续放料体积对比,见表4.
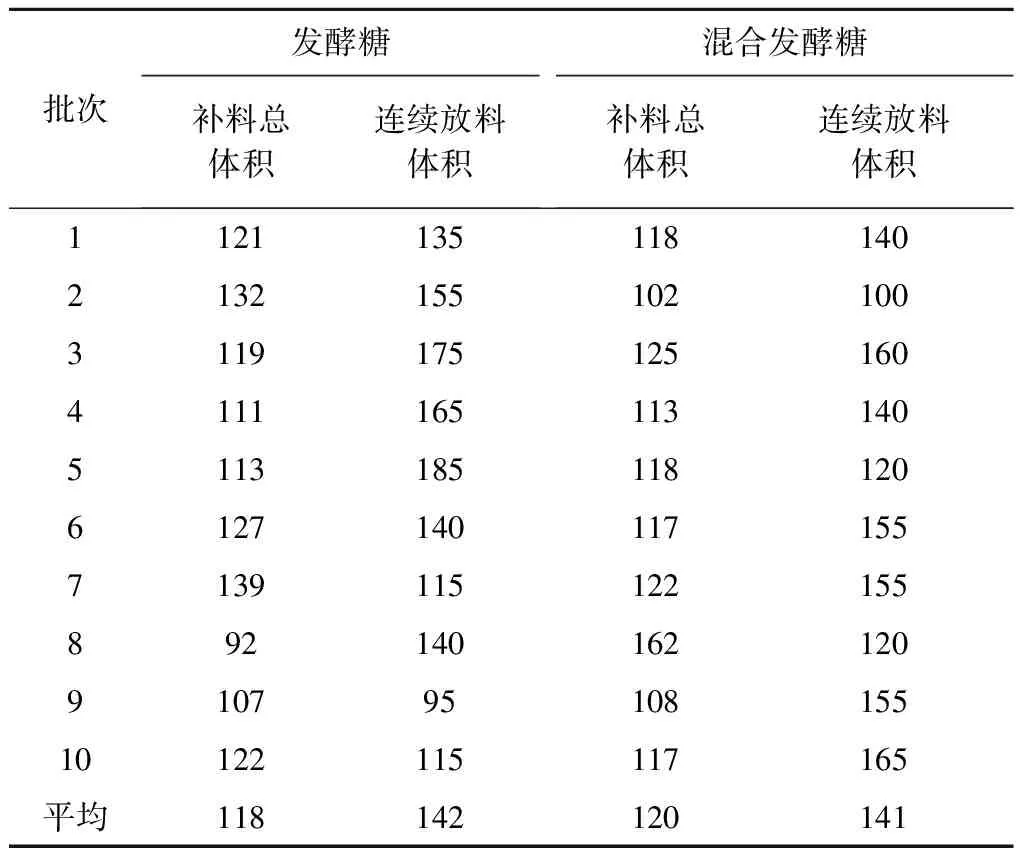
表4 发酵糖和混合发酵糖补料总体积及连续放料体积对比表
发酵糖和混合发酵糖各时间段糖酸转化率(只计算发酵罐糖酸转化率,相对应的种子罐耗糖没有计算在内),见表5.
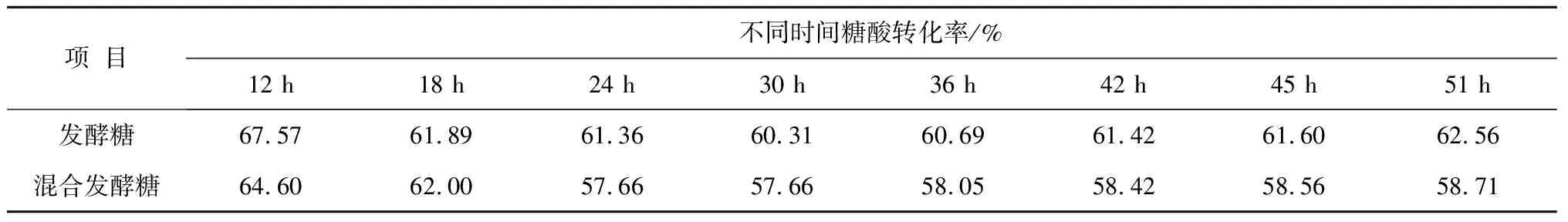
表5 发酵糖和混合发酵糖各时间段糖酸转化率对比表
混合发酵糖对应赖氨酸转化率58.71%,与之相应的单耗为
1/58.71%/63%=2.70 t
发酵糖对应赖氨酸转化率62.56%,与之相应的单耗为
1/62.56%/63%=2.54 t
可见,每吨L-赖氨酸,混合发酵糖比发酵糖多消耗0.16 t.
2.5 发酵糖和混合发酵糖各批次总放罐体积及残余糖分对比
每个批次总放罐体积=发酵结束后放罐体积+连续放料体积.
每种糖发酵的10个批次的发酵罐发酵结束后,总放罐体积及残余糖分数值,见表6.
表6发酵糖和混合发酵糖各批次总放罐体积及残余糖分对比表
Table6Comparisontableoftotalvolumeandresidualsugaroffermentationsugarandmixedfermentationsugarineachbatch
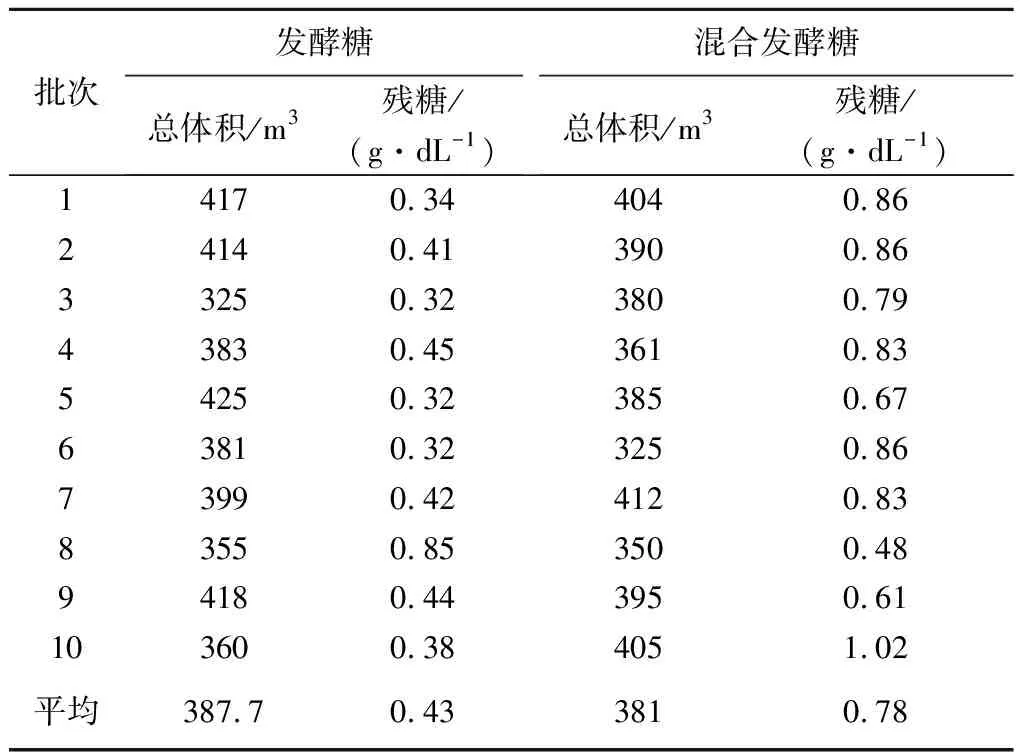
批次发酵糖总体积/m3残糖/(g·dL-1)混合发酵糖总体积/m3残糖/(g·dL-1)14170.344040.8624140.413900.8633250.323800.7943830.453610.8354250.323850.6763810.323250.8673990.424120.8383550.853500.4894180.443950.61103600.384051.02平均387.70.433810.78
发酵末期混合发酵糖发酵残糖分0.78 g/dL高于发酵糖残糖0.43 g/dL,高81.4%.
发酵糖发酵末期500 m3发酵罐内残糖为
387.7×104(dL)×0.43(g/dL)/106=1.67 t
混合发酵糖发酵末期500 m3发酵罐内残糖为
381×104(dL)×0.78(g/dL)/106=2.97 t
可见,每个发酵周期,混合发酵糖发酵要比发酵糖发酵损失糖1.3 t.
在基础培养基和流加糖相同浓度,采用混合糖发酵,产品质量都能达到合格标准,混合发酵糖发酵无论在各时间段产酸量、耗糖量、赖氨酸增加量以及糖酸转化率上都比用发酵糖直接发酵略低,最终也会使混合发酵糖发酵残余糖分高于纯发酵糖,发酵后期残余糖分要高81.4%.
3 结 论
以20%结晶葡萄糖母液和80%发酵糖混合形成的混合发酵糖进行赖氨酸发酵,跟发酵糖直接用于赖氨酸发酵相比,无论在各时间段产酸、糖的补加量、赖氨酸增长量、糖酸转化率和残糖都有所变化,但在同一菌种,同一培养基的情况下,这一变化并没有实质上的不同.因此,从发酵控制工艺上看,以混合糖发酵生产L-赖氨酸是完全可行的.谷氨酸棒杆菌,不但能够利用淀粉水解中的葡萄糖,糖蜜中的蔗糖和果糖,还能利用麦芽糖和核糖进行发酵[9],同属于棒杆菌的赖氨酸菌种也具有这一特点,但在发酵末期这部分不能为赖氨酸菌种所利用的糖,是残留于母液中的还原性物质,这部分物质使残糖升高[10].从表面上看提高了L-赖氨酸的生产成本,而结晶葡萄糖母液的充分利用,大大降低了结晶葡萄糖的生产成本,如果母液不加以利用,不仅污染环境,而且使生产造成极大的浪费.因此,从经济与环保角度考虑,结晶葡萄糖生产和L-赖氨酸生产有效协调、配合,是集约式综合利用,使生产向深度和广度发展的大势所趋,为结晶葡萄糖和L-赖氨酸生产开拓了广阔的发展前景.

