裂殖酵母醛酮还原酶基因的克隆与诱导表达条件优化
,,, , ,
(浙江工业大学 生物工程学院,浙江 杭州 310014)
微生物醛酮还原酶(Aldo-keto reductase, AKR)是醛酮还原酶家族的主要组成,通常为NADP(H)专一性依赖型,含有高度保守的(α/β)8桶状结构[1].微生物醛酮还原酶具有来源的丰富性和催化底物的多样性等特性,其作为生物催化剂在酶法合成手性醇方面已有成功的应用.例如,王亚军等[2]通过理性设计对源自Kluyveromyceslactis的醛酮还原酶进行了分子改造,该突变酶与源自Exiguobacteriumsibiricum的葡萄糖脱氢酶进行共表达构建整细胞催化剂,并应用于制备光学纯6-氰基-(3R,5R)-二羟基己酸叔丁酯,生产效率达到了243.2 kg/(m3·d).
D-泛解酸内酯作为一种典型的手性醇化合物,是用于D-泛酸及D-泛醇合成的重要手性中间体[3].目前,在工业规模上通过内酯水解酶催化混旋泛解酸内酯的选择性拆分来制备D-泛解酸内酯,而基于酮基泛解酸内酯还原酶和泛解酸内酯脱氢酶的氧化还原酶法在酶法合成D-泛解酸内酯方面已展现出了巨大的应用潜力[4].本课题组前期研究已从酿酒酵母中克隆表达了2 个酮基泛解酸内酯还原酶SceCPR1[5]和SceAKR3C1[6],其中SceAKR3C1属于醛酮还原酶家族.本研究从裂殖酵母(Schizosaccharomycespombe)基因组克隆表达了一个具有酮基泛解酸内酯还原酶活力的醛酮还原酶.在此基础上,对该重组酶的诱导条件进行优化,确定了其最适诱导温度、转速、时间、接种量以及最适诱导剂浓度等,为该酶在不对称还原酮基泛解酸内酯上的应用奠定了基础.
1 材料与方法
1.1 材 料
1.1.1 菌株与载体
裂殖酵母(Schizosaccharomycespombe)菌种由本实验室保藏,表达宿主菌EscherichiacoliBL21(DE3)、E.coliTrans-T1克隆宿主菌和载体pEASY-Blunt E1购自北京全式金(TransGen Biotech)生物技术有限公司.
1.1.2 试 剂
FastPfuFly DNA Polymerase及配套材料购自北京全式金生物技术有限公司;用于质粒提取和DNA片段纯化的试剂盒均购自大连宝生物工程(TaKaRa)有限公司;酵母基因组提取试剂盒、辅酶NADPH、蛋白标准溶液BSA和异丙基-β-D-硫代半乳糖吡喃糖苷(Isopropyl-β-D-1-thiogalactopyranoside,IPTG)等购自上海生工生物工程股份有限公司;其余试剂均为国产分析纯.
1.1.3 引 物
利用BLAST软件根据S.pombe基因组中吲哚-3-乙醛还原酶基因(GenBank: NM_001019853.2)进行同源分析,设计PCR扩增醛酮还原酶基因引物如下:上游引物SpoAKR3C2 F为5′-ATGCTTATCGCTGCTATG-3′,下游引物SpoAKR3C2 R为5′-CTCATCCATGTGCTTCAT-3′.引物由杭州擎科梓熙生物技术有限公司合成.
1.1.4 培养基
YPD培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L.固体培养基中添加质量分数为2.0%的琼脂粉.培养基于0.1 MPa,115 ℃高压蒸汽灭菌30 min.
LB(Luria-Bertani)培养基:蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L,调节pH至7.0.固体培养基中添加质量分数为2.0%的琼脂粉.培养基于0.1 MPa,121 ℃高压蒸汽灭菌20 min.
LB/Amp培养基:在LB培养基加入氨苄青霉素(Ampicillin, Amp)至终质量浓度为100 μg/mL.
LB/Kan培养基:在LB培养基加入卡那霉素(Kanamycin, Kan)至终质量浓度为100 μg/mL.
1.2 方 法
1.2.1 醛酮还原酶SpoAKR3C2的基因克隆
以S.pombe基因组为DNA模版,进行聚合酶链式反应以获得目的片段,PCR扩增参数:95 ℃预变性2 min,95 ℃变性20 s,55 ℃复性20 s,72 ℃延伸20 s,反应循环数为35,72 ℃复延伸5 min.PCR扩增产物用质量分数为1.0%的琼脂糖凝胶电泳检测,并利用DNA片段纯化试剂盒进行回收.纯化后PCR产物与载体pEASY-Blunt E1连接,并将连接产物转入50 μLE.coliTrans-T1感受态细胞中.采用菌落PCR筛选阳性克隆子,送至上海桑尼生物科技有限公司进行测序以进一步检测.将测序所得的基因序列与NCBI数据库中已有的基因序列进行比对、分析,含有目的片段的质粒命名为pEASY-Blunt E1-SpoAKR3C2.
1.2.2 密码子优化与重组菌的构建
目的基因通过密码子优化软件(http://www.jcat.de/)进行密码子优化,由上海捷瑞生物工程有限公司合成密码子优化后的目的基因,并插入在pET28b表达载体上,插入位点为NdeI与BamH I,所得的质粒命名为pET28b-SpoAKR3C2.重组质粒pET28b-SpoAKR3C2转入50 μL刚解冻的感受态细胞E.coliBL21(DE3)中,孵育1 h后将其涂布于LB/Kan固体平板上,37 ℃恒温培养箱中倒置过夜培养.挑取阳性克隆子,接种于含Kan抗性的LB液体培养基中,于37 ℃和200 r/min下摇瓶培养10 h,作为种子液,即重组菌E.coliBL21(DE3)/pET28b-SpoAKR3C2.按2%接种量扩大培养至Kan抗性的150 mL LB液体培养基中,在37 ℃和200 r/min下摇瓶培养至菌体浓度OD600为0.6~0.8时,添加诱导剂0.1 mol/L IPTG.然后在22 ℃,150 r/min条件下诱导10 h.诱导完成后,所得培养物利用12% SDS-PAGE进行检测分析.
1.2.3 生长曲线测定
将新鲜的种子液接种至含有相性抗生素(Kan)的LB液体培养基中,在37 ℃,200 r/min条件下摇瓶培养.以未接种的LB液体培养基作为空白对照进行零点校正及零时测定,间隔一定的时间取样,选用600 nm波长进行光电比浊测定其光密度值.
1.2.4 诱导条件优化
以1.2.2中所述的诱导流程为标准的诱导流程,分别考察种子液接种量、诱导时间、温度、转速以及诱导剂浓度等对产醛酮还原酶SpoAKR3C2的影响.其中,诱导温度为16,19,22,25,28,31,34 ℃;诱导时间为6,8,10,12,14,16 h;诱导转速为120,130,140,150,160,170 r/min;诱导剂终浓度为0.5,1.0,1.5,2.0,2.5,3 mmol/L;种子液接种量(体积分数)为0.5%,1.0%,1.5%,2.0%,2.5%,3.0%.
1.2.5 粗酶液制备及酶活力测定
诱导完成后,4 ℃条件下6 000 r/min离心15 min收集菌体沉淀,并用超纯水反复重悬清洗,再离心收集菌体.在50 mmol/L Tris-HCl缓冲液(pH 8.0)重悬菌体至终质量浓度为50 g/L,充分混悬后吸取菌悬液10 mL,然后在冰浴条件下超声波破碎细胞.超声破碎参数:工作时间1 s,间歇时间1 s,总工作时间为3 min.细胞裂解液4 ℃,6 000 r/min离心15 min,收集上清即为含醛酮还原酶SpoAKR3C2粗酶液.
实验选取酮基泛解酸内酯为底物,利用紫外分光光度计测定酶活力,结合菌体浓度确定最佳诱导条件.标准酶活测定体积为2.5 mL,包括:10 mmol/L酮基泛解酸内酯、10 μL醛酮还原酶SpoAKR3C2细胞破碎上清液和0.1 mmol/L NADPH,用0.2 mol/L PBS缓冲液(pH 6.0)补至2.5 mL,反应温度35 ℃.上述反应通过最后加入NADPH和底物启动反应,通过检测1 min内NADPH在340 nm波长下的降低来确定酶活.NADPH的摩尔消光系数为6.22×103L/(mol·cm),酶活力单位(U)定义为每分钟内消耗1 μmol NADPH所需的酶量.
2 结果与讨论
2.1 醛酮还原酶SpoAKR3C2的克隆表达
以S.pombe基因组为DNA模板,经PCR扩增后获得目的基因,经质量分数为1.0%琼脂糖凝胶电泳检测(图1)以及测序验证,发现其大小为852 bp,与目的序列大小相符.通过软件BLAST比对,发现其与S.pombe中吲哚-3-乙醛还原酶基因(GenBank: NM_001019853.2)序列一致.目的基因经密码子优化后构建获得重组菌E.coliBL21(DE3)/pET28b-SpoAKR3C2.诱导表达的SpoAKR3C2在SDS-PAGE上对应于大小约为36 kD的条带(图2),相比于未经诱导的对照,诱导后菌体在大小约36 kD处出现明显的加粗条带,与预期相符.诱导所得的粗酶液经标准酶活力检测,其比活力约为2 U/mg.进一步对其进行催化反应验证,在2 mL反应体系中添加质量分数为1%的冻干菌粉为生物催化剂,以100 mmol/L酮基泛解酸内酯为底物,偶联葡萄糖脱氢酶催化100 mmol/L葡萄糖脱氢提供辅酶循环,以0.3 mmol/L NADP+为辅酶,在pH 6.0,45 ℃和200 r/min下反应7 h,D-泛解酸内酯得率约为80%,光学纯度高达99%以上.鉴于该酶的工业应用前景,笔者针对目的菌株E.coliBL21 (DE3)/pET 28b-SpoAKR3C2进行了诱导条件优化实验.
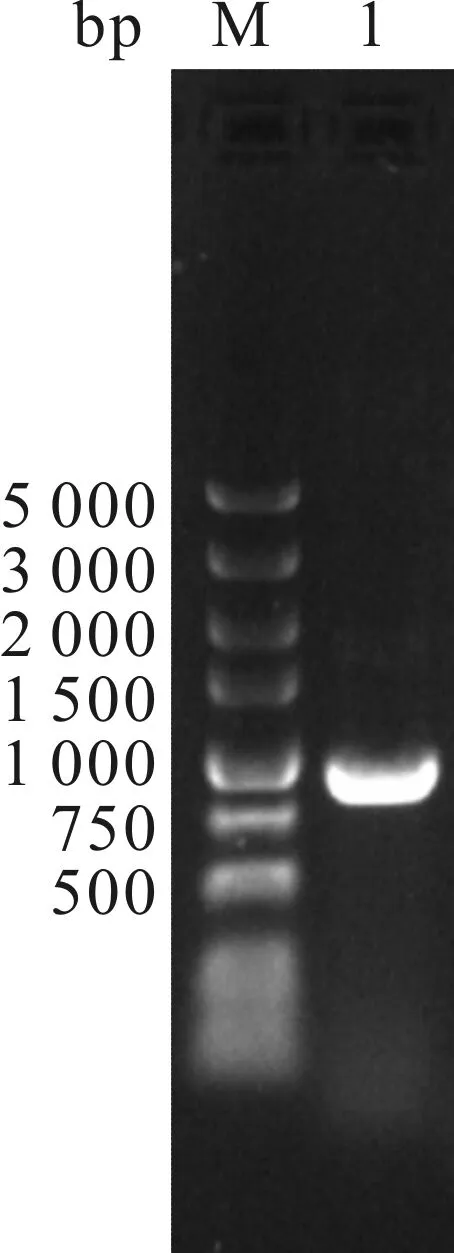
M—DL5000 DNA Marker;1—PCR扩增产物图1 PCR扩增产物琼脂糖凝胶电泳验证胶图Fig.1 The agarose gel electrophoresis of PCR amplification product
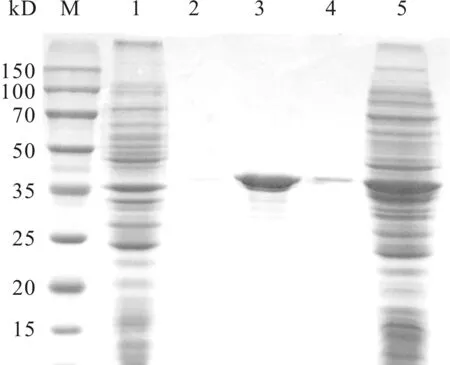
M—Protein Marker;1—未诱导菌液;2—40 mmol/L咪唑洗脱液洗脱的酶液;3—100 mmol/L咪唑洗脱液洗脱的酶液;4—250 mmol/L咪唑洗脱液洗脱的酶液;5—诱导后菌液图2 醛酮还原酶SpoAKR3C2 SDS-PAGE分析Fig.2 SDS-PAGE analysis of an aldo-keto reductase SpoAKR3C2
2.2 细胞生长曲线
以培养时间为横坐标,以不同时间细菌培养液的OD600值为纵坐标,绘制重组菌E.coliBL21 (DE3)/pET28b-SpoAKR3C2菌体浓度随时间的变化曲线(图3).研究发现:重组菌在0~1.5 h内生长缓慢;1.5 h后,菌体浓度直线上升,以稳定的几何级数快速增长,并在8 h后菌液OD600径直达到了4.408,此后曲线变化幅度不大,重组菌进入稳定生长期.
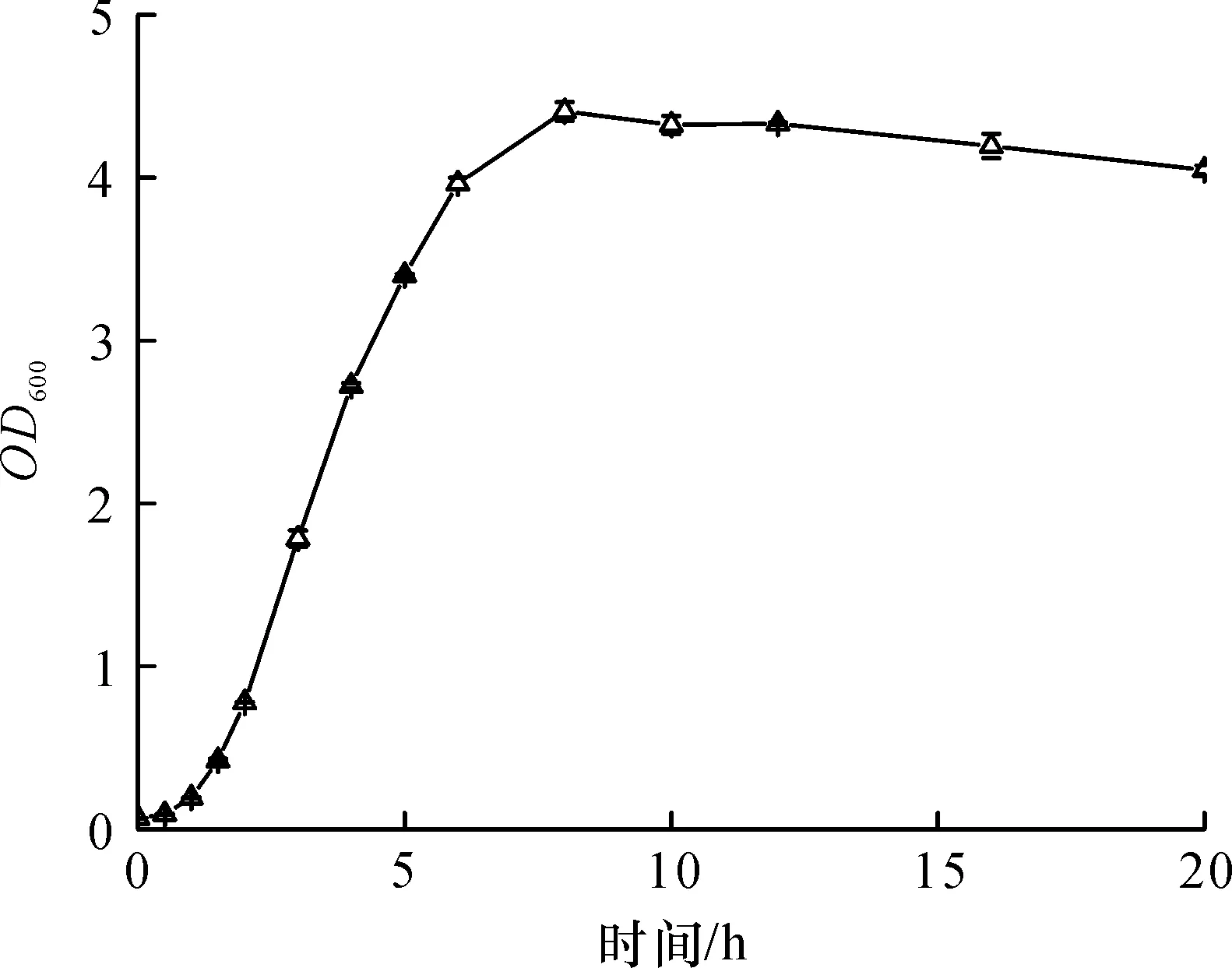
图3 E.coli BL21 (DE3)/pET 28b-SpoAKR3C2细胞生长曲线Fig.3 Growth curve of E.coli BL21(DE3)/pET 28b-SpoAKR3C2
2.3 最适诱导温度
诱导温度是重组蛋白表达调控的关键因素之一,它对菌体生长速率及蛋白的可溶性表达等有着重要影响[7].重组菌E.coliBL21(DE3)/pET 28b-SpoAKR3C2表达外源目的蛋白采用二阶段发酵模式,即菌体生长阶段和外源基因表达阶段.由图4可知:生物量在外源基因表达阶段随着诱导温度的升高逐步增加,当诱导温度高于31 ℃后,其菌体浓度的变化趋势趋缓;另一方面,在温度16~34 ℃范围内,均有一定量的外源蛋白表达,但低温条件明显有利于目的蛋白的正确折叠表达,当温度降低至19 ℃时,酶活达到了3.143 U/mg.大肠杆菌的最适生长温度为37 ℃,因此低温(19 ℃)虽然使得溶解性蛋白的体积酶活力达到峰值,但不利于菌体的正常生长代谢.综合菌体量及其酶活力,确定醛酮还原酶SpoAKR3C2的最适诱导温度为19 ℃.
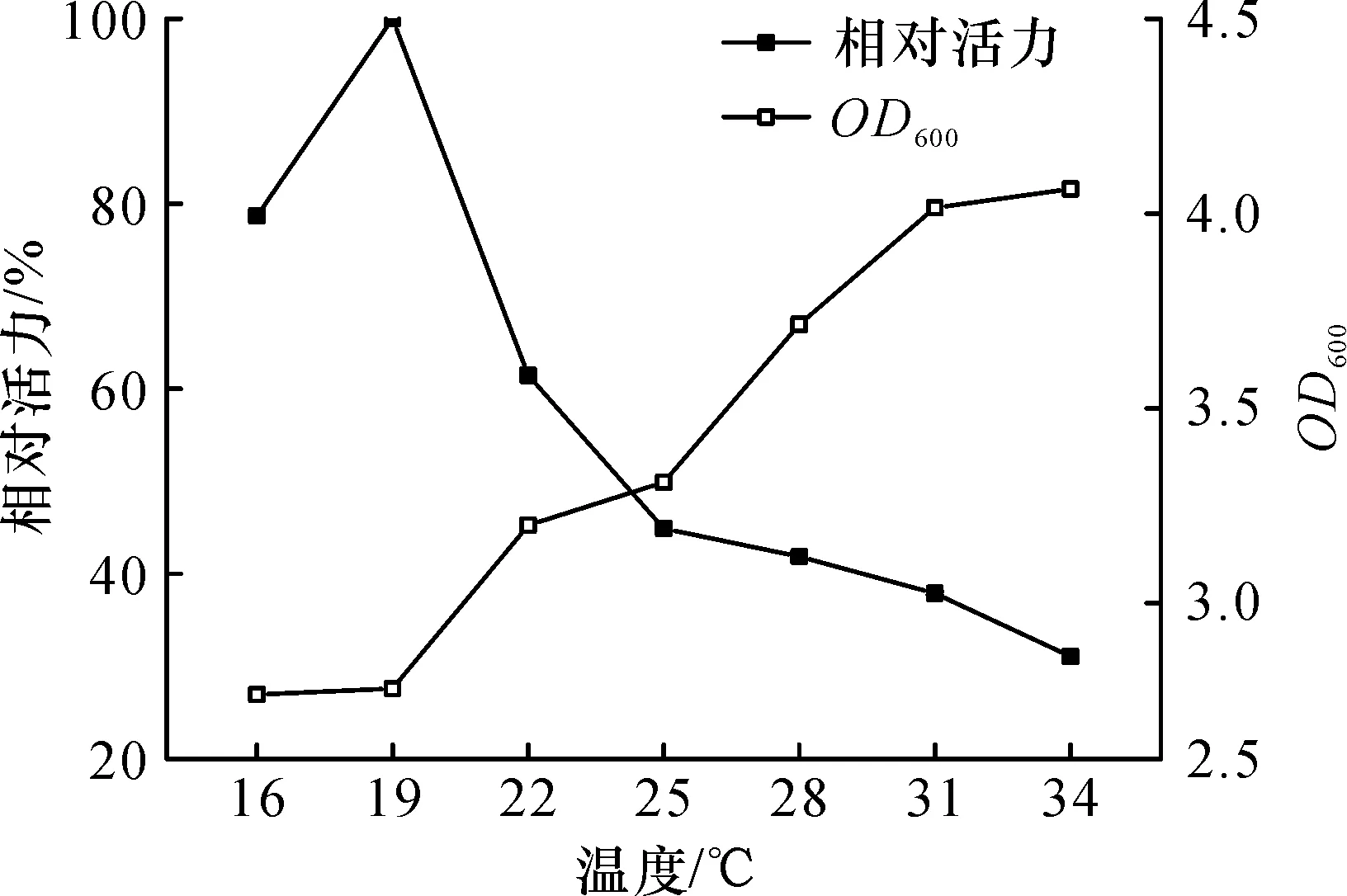
图4 温度对醛酮还原酶SpoAKR3C2诱导表达的影响Fig.4 Effect of temperature on the inducible expression of aldo-keto reductase SpoAKR3C2
2.4 最适诱导时间
在发酵过程中,随着诱导剂作用时间的增加,培养液OD600稳步上升,而目的蛋白活力在诱导14 h后达到峰值,延长至16 h酶活力却有所下降(图5).总体而言,实验发现诱导时间对产醛酮还原酶SpoAKR3C2影响显著,随着时间的适当延长,目的蛋白表达量增加并且不断累积.因而,确定最佳诱导时间为14 h.
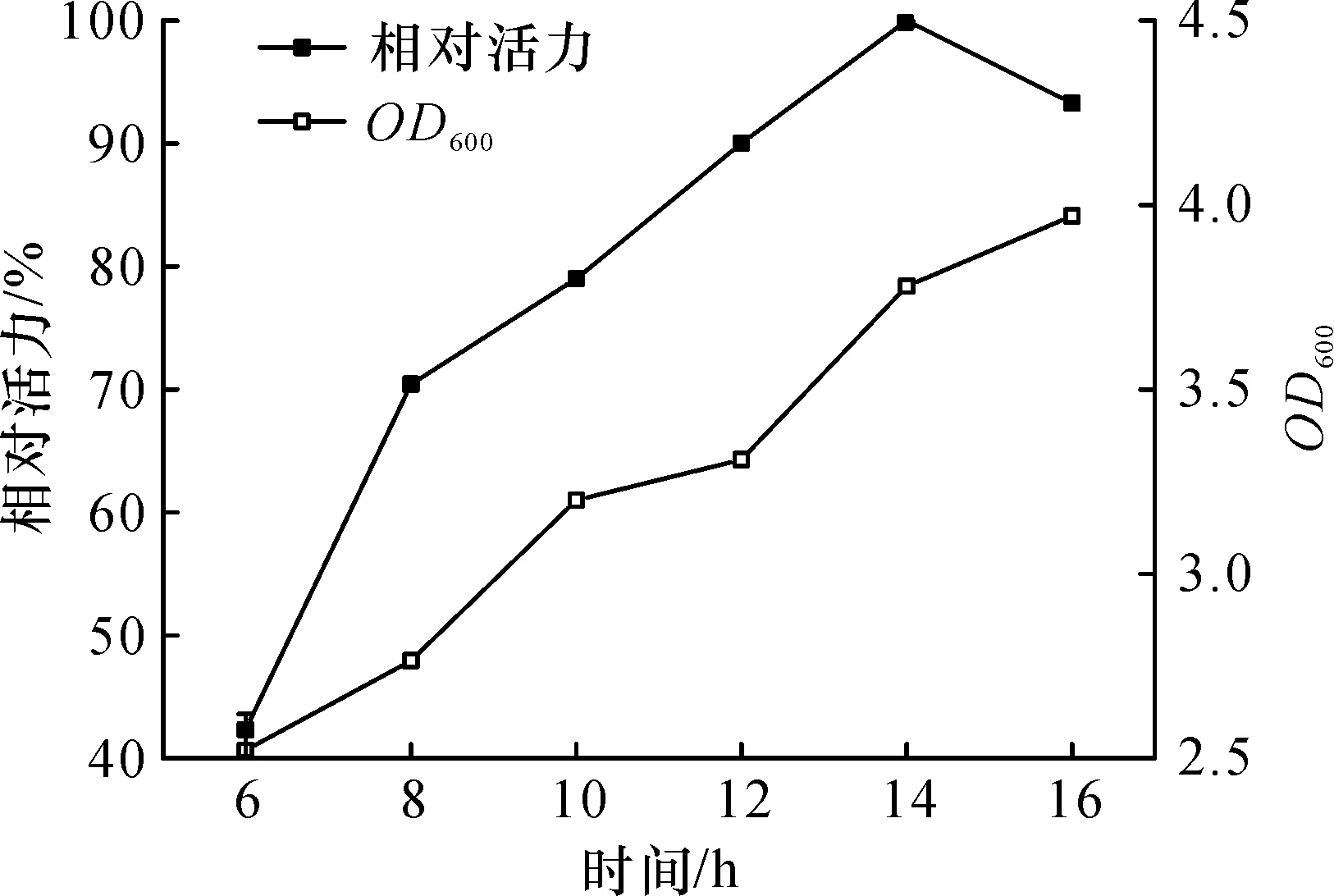
图5 时间对醛酮还原酶SpoAKR3C2诱导表达的影响Fig.5 Effect of time on the inducible expression of aldo-keto reductase SpoAKR3C2
2.5 最适诱导转速
宿主菌为E.coliBL21 (DE3)属于异养兼性厌氧型,研究考察了120~170 r/min范围内转速对产醛酮还原酶SpoAKR3C2影响.在发酵过程中,随着诱导转速的增加,培养液OD600呈现先上升后下降的趋势,这与宿主菌的代谢性质相符(图6).另一原因可能是因为转速增大,使得溶氧供给过多促使细胞在早期过快生长,进而过多地消耗了培养基中的营养物质导致后期营养不足,从而细胞生物量较低.而较低的振荡频率给菌体提供了一个低氧的环境,且其受到的剪切力明显减少,从而更加有利于目的蛋白的正确折叠、表达.综合菌体量及其酶活力,确定最佳诱导转速为140 r/min.
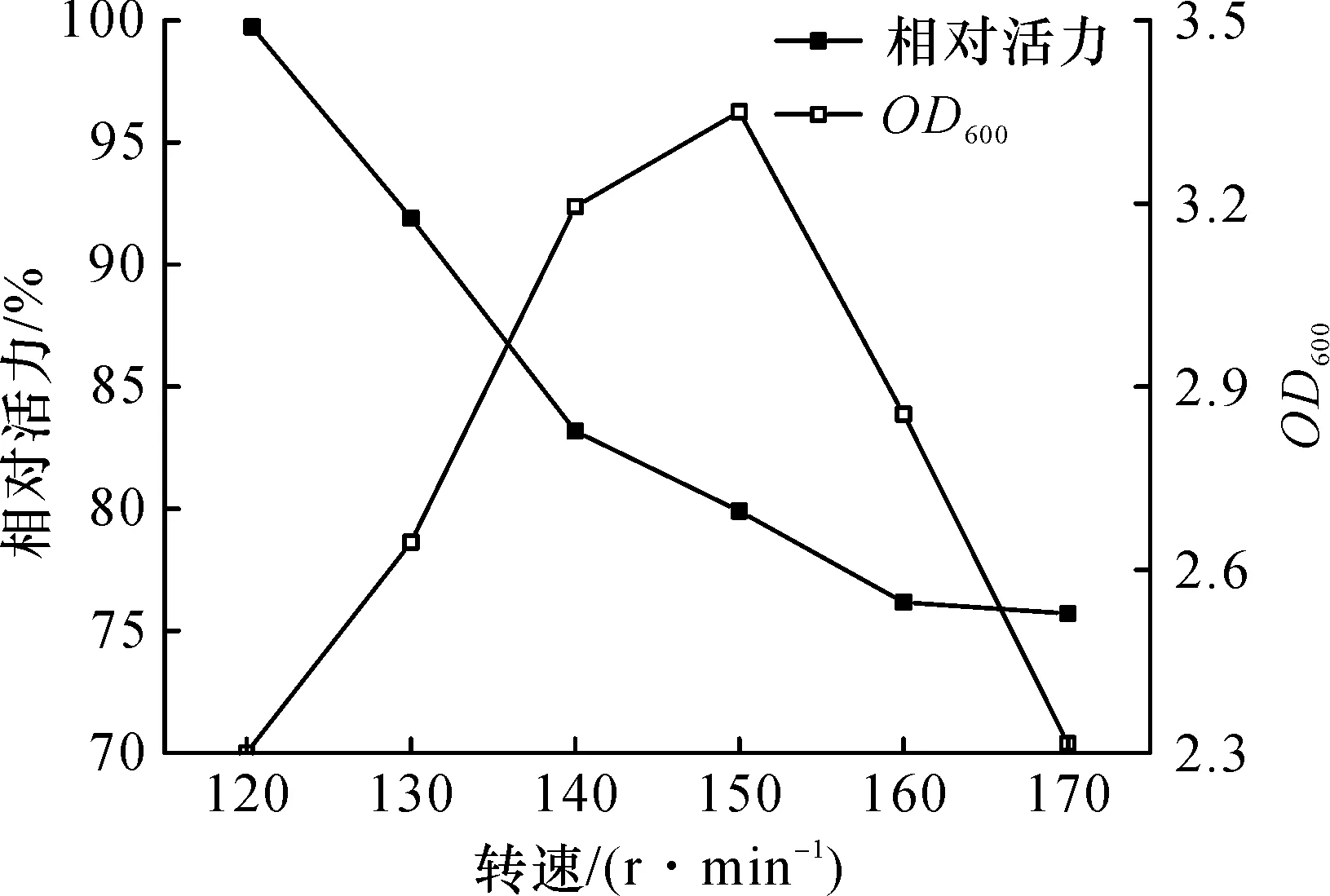
图6 转速对醛酮还原酶SpoAKR3C2诱导表达的影响Fig.6 Effect of rotating speed on the inducible expression of aldo-keto reductase SpoAKR3C2
2.6 最适诱导剂浓度
IPTG诱导剂浓度太低,不利于诱导物与阻遏蛋白结合,从而影响外源蛋白表达.诱导剂浓度过高菌体活力下降,比生长速率降低,也会导致目的蛋白的表达量下降[8].本研究考察了诱导剂IPTG浓度对产醛酮还原酶SpoAKR3C2诱导表达的影响.相较于诱导温度、诱导时间这两个因素,IPTG浓度对外源基因的表达影响略小.当IPTG终浓度0.1 mmol/L时,粗酶液的比活力最高,并且生物量也处于较高的水平(图7).
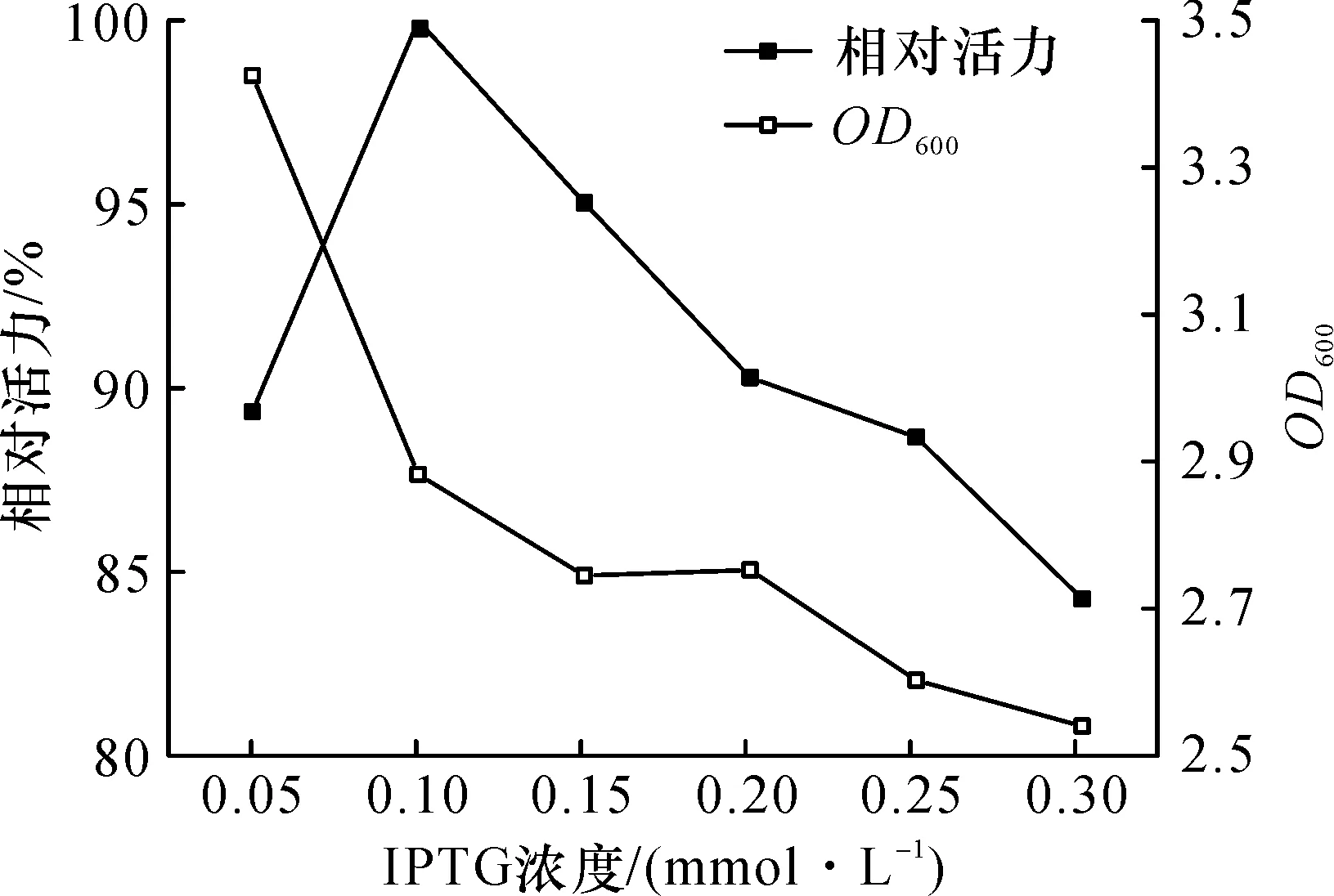
图7 IPTG浓度对醛酮还原酶SpoAKR3C2诱导表达的影响Fig.7 Effect of IPTG concentration on the inducible expression of aldo-keto reductase SpoAKR3C2
2.7 最适接种量
采用适合的接种量,在合理地缩短发酵周期的同时,又能得到较高的发酵水平[9].就目的蛋白活力而言,随着接种量增加呈现上升趋势,在1.5%达到峰值,随后逐渐降低(图8).因而,最适接种量确定为1.5%(体积分数).
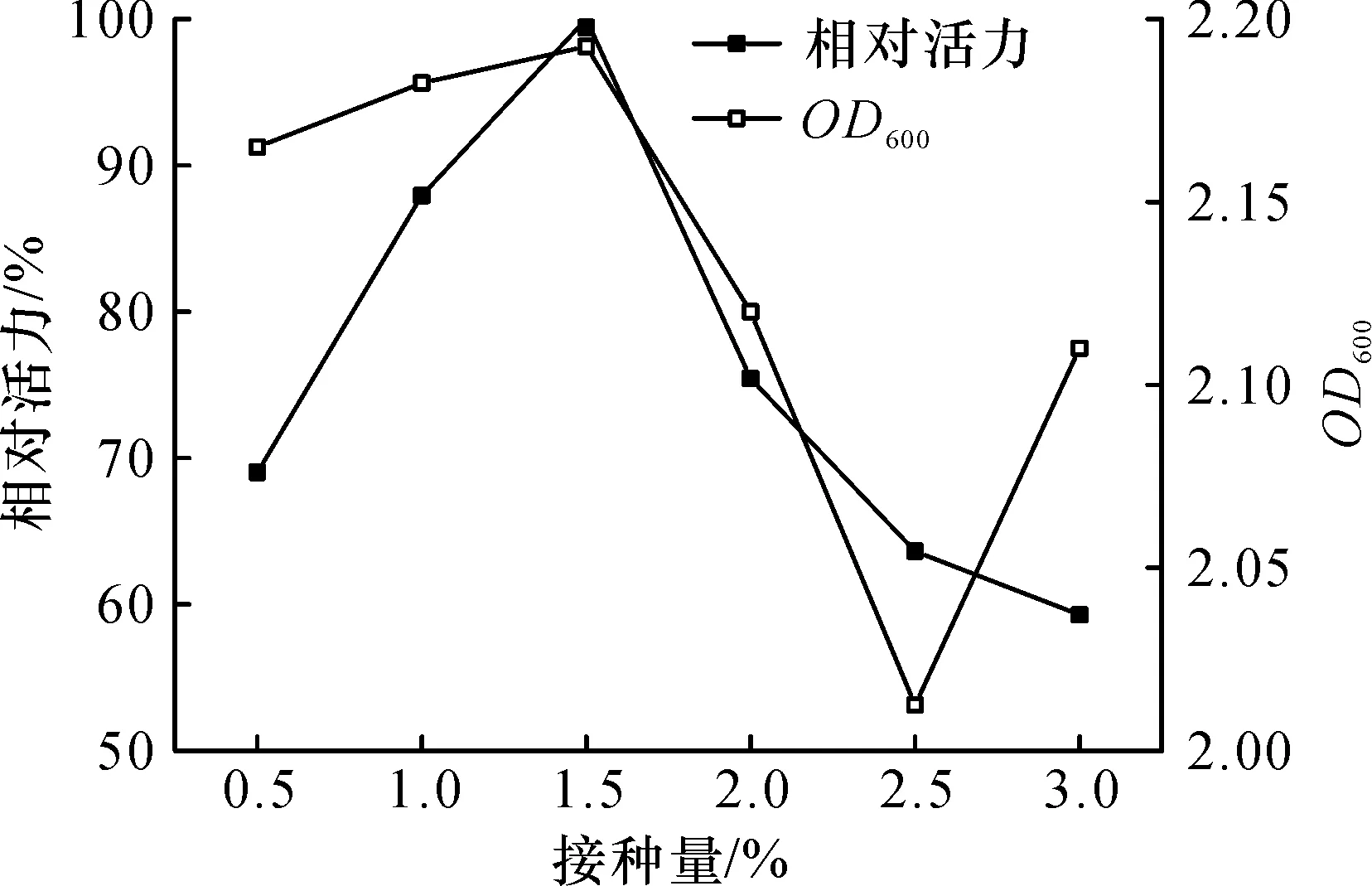
图8 接种量对醛酮还原酶SpoAKR3C2诱导表达的影响Fig.8 Effect of inoculation amount on the inducible expression of aldo-keto reductase SpoAKR3C2
3 结 论
醛酮还原酶SpoAKR3C2具有酮基泛解酸内酯还原酶活力,能催化D-泛解酸内酯的不对称合成.对重组菌E.coliBL21(DE3)/pET28b-SpoAKR3C2的诱导表达条件进行了优化,确定了最佳诱导条件:以1.5%接种量进行接种,在37 ℃,200 r/min条件下培养至菌液OD600为0.6~0.8时,加入0.1 mmol/L诱导剂IPTG,随后在19 ℃,140 r/min条件下诱导14 h,可进一步实现重组菌过量表达目的蛋白.在各影响因素中,诱导温度及时间是影响产醛酮还原酶SpoAKR3C2的主要因素.在优化的条件下,所得诱导培养物相较于未优化前活力提高了约3.4 倍,为该醛酮还原酶在不对称合成D-泛解酸内酯的进一步工业应用奠定了基础.

