N-亚硝基苯胲铵在金红石表面的吸附特性研究
刘明宝,樊 兴,魏 锐,强旭旭,印万忠
(1.陕西省尾矿资源综合利用重点实验室,陕西 商洛 726000;2.商洛学院 化学工程与现代材料学院,陕西 商洛 726000;3.东北大学 资源与土木工程学院,辽宁 沈阳 110004)
金红石中TiO2质量分数高达90%~99%,钛含量高、杂质少,所以是生产金红石型钛白粉的最佳原料及高档电焊条的必需原料之一,同时也是生产四氯化钛、金属钛和钛合金及搪瓷制品的优质原料。近年来,钛工业的飞速发展对高品级金红石的需求量日益增加,金红石选矿技术研究也越来越受重视[1-3]。试验研究和生产实践表明:研发新型金红石浮选药剂往往是浮选工艺获得进展的关键[4-5];某些O.O型配位的含苯环的螯合捕收剂对金红石有极好的选择性和捕收能力[6-7],如水杨羟肟酸(SHA,O.O型)、苯甲羟肟酸(BHA,O.O型)及对叔丁基邻苯二酚(TBC,O.O型),其中,TBC相对于SHA和BHA有更强的捕收能力和选择性,推断其作用机制可能是通过2个酚羟基上电负性较大的2个O原子与Ti(Ⅳ)形成了O.O型键合螯合物,可能的产物为稳定的五元螯合物。目前的研究主要是从药剂及矿物表面金属离子的溶液化学角度揭示二者之间的作用机制,尚未见有从二者相互作用的界面热力学与动力学角度揭示药剂作用机制的报道,因此,研究以金红石单矿物与N-亚硝基苯胲铵作用的热力学和动力学特性为切入点,对二者的相互作用机制进行讨论,以期从热化学角度揭示N-亚硝基苯胲铵在金红石表面的吸附行为,为研发细粒级嵌布金红石的浮选药剂提供技术参考依据。
1 试验部分
1.1 试验原料
金红石纯矿物取自海南万宁市,纯度大于95%,XRD和XRF分析结果分别见图1和表1。
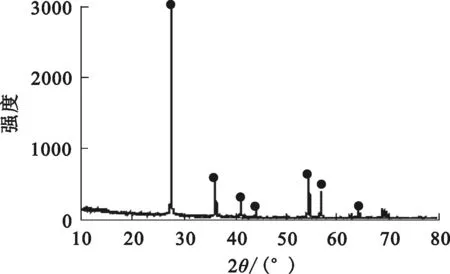
图1 金红石矿样的XRD图谱
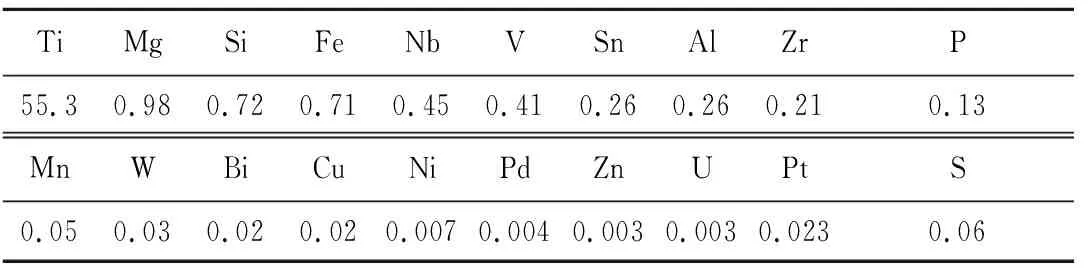
表1 金红石矿样化学成分XRF分析结果 %
1.2 主要仪器与试剂
试验所用主要仪器:SHA型水浴振荡器,Agilent5000紫外-可见分光光度计。
试验所用主要试剂:氢氧化钠、盐酸、N-亚硝基苯胲铵,均为分析纯。
1.3 试验方法
1.3.1吸附动力学
首先,在一系列50 mL锥形瓶中分别加入粒度为-37 μm金红石矿样2 g,再加入20 mL不同pH的N-亚硝基苯胲铵溶液(固定质量浓度),振荡不同时间后过滤,滤液经离心处理,最后对上清液用Agilent5000紫外-可见分光光度计测定药剂浓度,根据药剂初始浓度与剩余浓度的差值计算不同pH条件下振荡时间与药剂吸附量的关系。
1.3.2吸附热力学
首先,在一系列50 mL锥形瓶中分别加入粒度为-37 μm金红石矿样2 g,再加入20 mL不同质量浓度的N-亚硝基苯胲铵溶液,振荡1 h后过滤,滤液经离心处理,对离心后的上清液用Agilent5000紫外-可见分光光度计测定药剂浓度,根据药剂初始质量浓度与剩余质量浓度的差值计算不同pH条件下吸附量与药剂浓度的关系。
2 试验结果与讨论
2.1 矿浆pH、吸附时间对金红石表面吸附N-亚硝基苯胲铵的影响
矿浆pH对N-亚硝基苯胲铵及金红石表面的活性质点的水解形式有重要影响,矿浆酸碱度发生变化不可避免地会影响捕收剂在矿物表面的吸附行为。矿浆pH对金红石表面吸附N-亚硝基苯胲铵的影响试验结果如图2所示。可以看出:不同pH条件下,金红石表面对N-亚硝基苯胲铵的吸附量随搅拌时间的变化趋势基本一致,均呈逐渐增大趋势;搅拌20 min后,吸附达到平衡;矿浆pH为2.53和3.68时的拟合曲线几乎完全重合,且酸性条件下的吸附量大于中性及碱性条件下的吸附量,说明酸性条件有利于N-亚硝基苯胲铵在金红石表面的吸附。原因之一可能是在弱酸性条件下,金红石表面有适度的溶解性;更重要的原因可能是,与N-亚硝基苯胲铵在酸性条件下的稳定性要大于在中性及碱性条件下的稳定性有关。
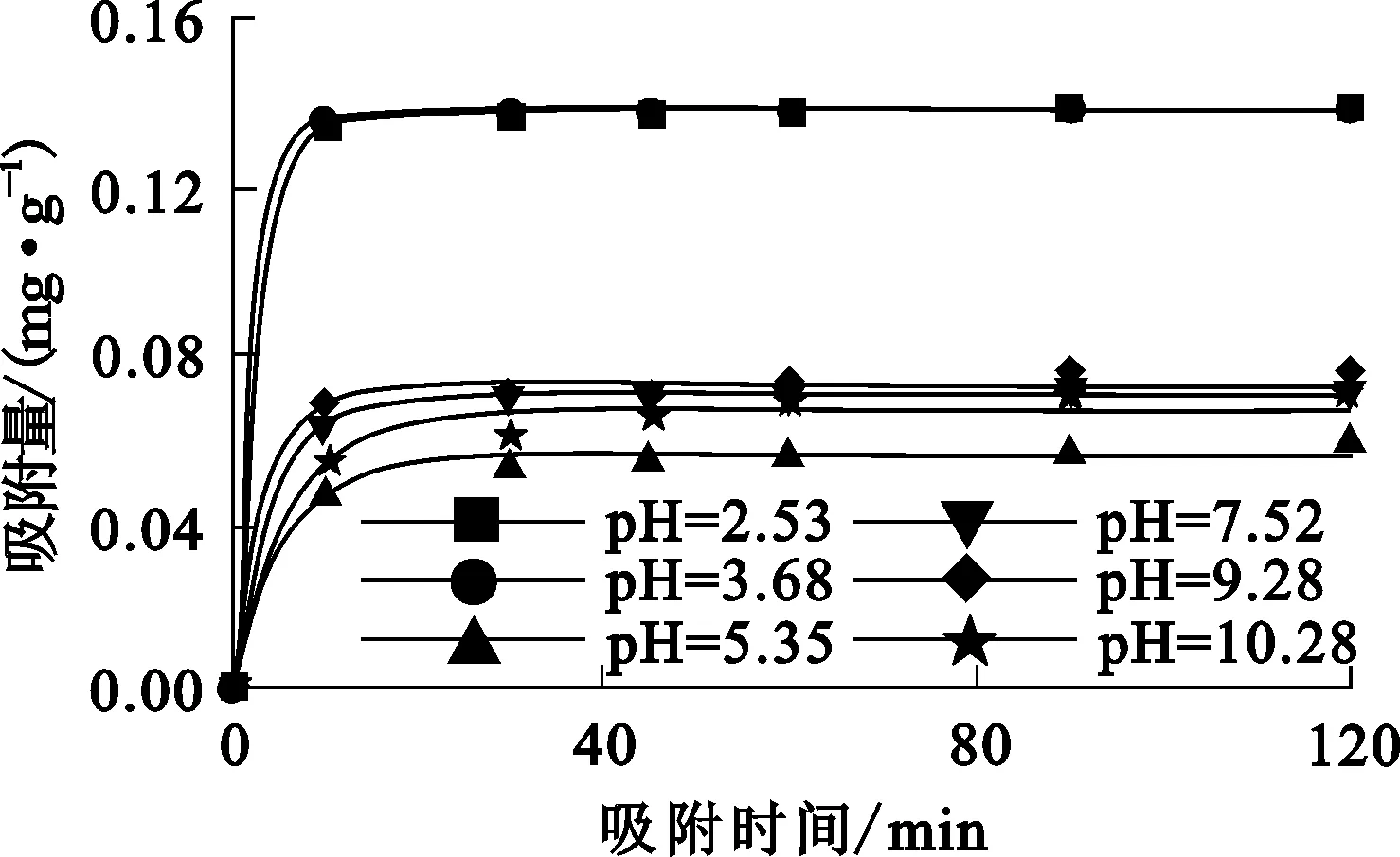
图2 吸附时间和矿浆pH对金红石表面吸附N-亚硝基苯胲铵的影响
2.1.1动力学模型拟合
用以描述吸附过程动力学的模型主要有准一级动力学模型和准二级动力学模型[8]。
准一级动力学方程,
(1)
准二级动力学方程,
(2)
式中:k1为一级吸附速率常数,min-1;k2为二级吸附速率常数,g/(min·mg);qt为吸附t时间时的吸附量,mg/g;q1、q2为平衡吸附量,mg/g。不同pH条件下吸附动力学参数及模型拟合曲线见表2和图3。

表2 N-亚硝基苯胲铵在金红石表面的吸附动力学参数

图3 N-亚硝基苯胲铵在金红石表面的吸附动力学拟合曲线
由表2和图3看出:准一级动力学模型能更好地反映N-亚硝基苯胲铵在金红石表面的吸附动力学行为,且不同pH条件下的理论饱和吸附量与试验值更为接近;另外,由模型拟合所得参数可知,酸性条件下的理论饱和吸附量大于中性及碱性条件下的饱和吸附量,吸附动力学常数也大于中性及碱性条件下的动力学常数,说明酸性条件更有利于吸附进行。
2.1.2吸附扩散模型
刘邦瑞[9]认为矿浆中矿物表面会形成一层矿物膜,药剂离子和矿物的作用就在这一膜层中进行。王淀佐等[10]也认为矿物在矿浆中溶解后会在表面形成一个浓度较大的离子层,矿浆中的药剂与矿物的作用本质上就是与该离子层的作用。因此,浮选过程中,N-亚硝基苯胲铵在矿物表面的吸附主要有2个控制步骤[11]:一是金红石表面活性质点离子在矿物表膜内的扩散,
kdt=ln(1-R);
(3)
二是N-亚硝基苯胲铵通过表面水化层在矿物表膜[6]中的扩散,
At=ln(1-R)-0.497 7。
(4)
式中:R=qt/qe;qt、qe分别为吸附t时间的吸附量和平衡吸附量,mg/g;kd、A为扩散速率常数。
上述2种扩散所涉及的界面化学变化对浮选指标有重要影响。确定药剂吸附过程中的扩散步骤,便可采取有效措施提高浮选工艺指标。为了确定浮选动力学控制步骤,对图2数据进行线性拟合,结果如图4所示。可以看出:不同pH条件下,拟合曲线均近似通过原点,表明金红石表面活性质点离子在矿物表面的扩散可能控制吸附过程。这主要是因为TiO2分子中的Ti—O键能相当大,不易断裂,使得TiO2分子中的晶格能非常大,致使金红石在水溶液中的溶解度非常小,矿物表面活性质点离子在表面的扩散非常缓慢。
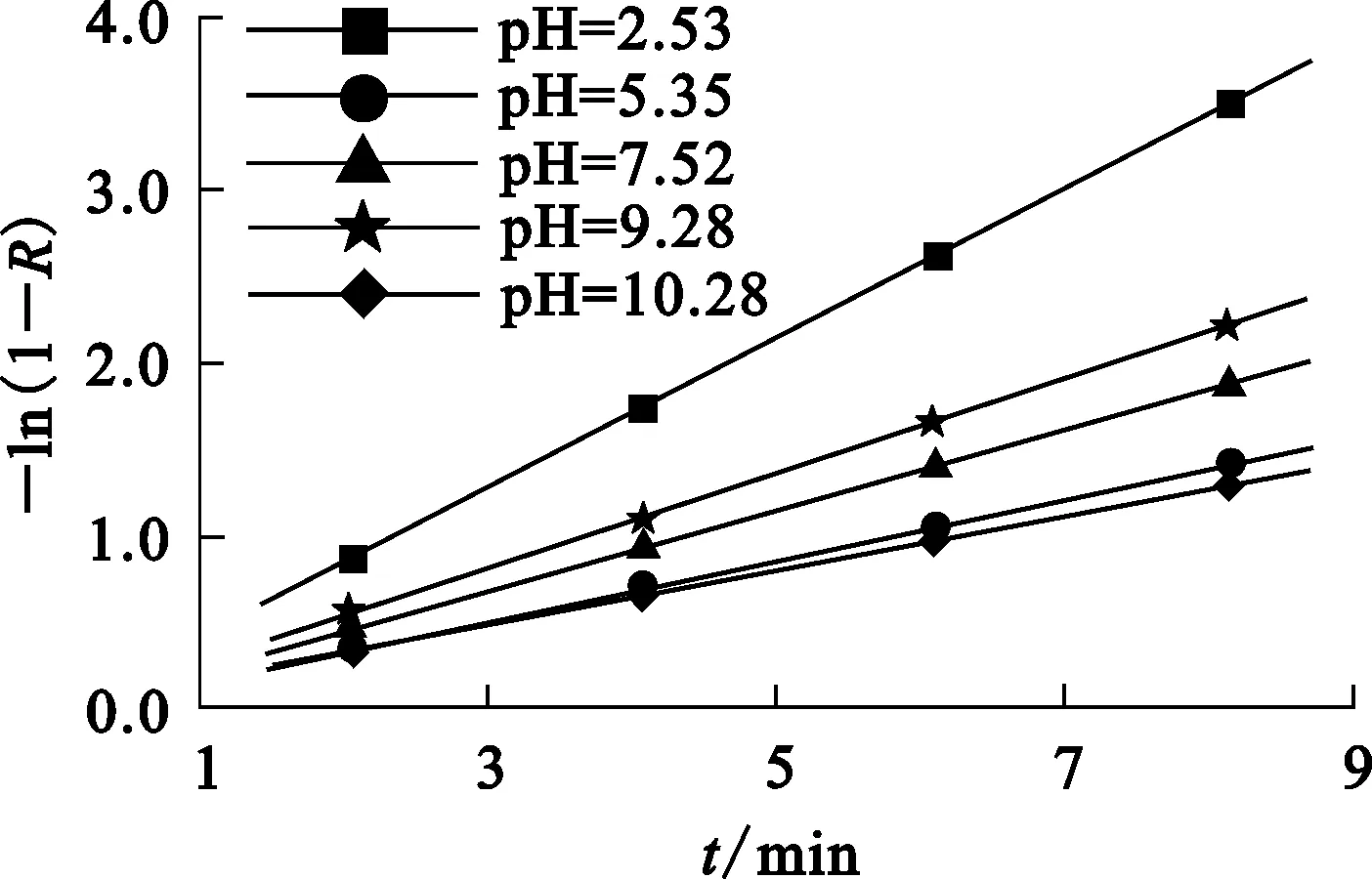
图4 扩散过程拟合曲线
2.2 吸附热力学试验
振荡时间1 h,矿浆pH=3.68,温度对吸附平衡后金红石表面药剂吸附量与药剂初始浓度之间的关系如图5所示。可以看出,在试验条件下,金红石表面药剂吸附量随温度升高及初始浓度增大均呈升高趋势。
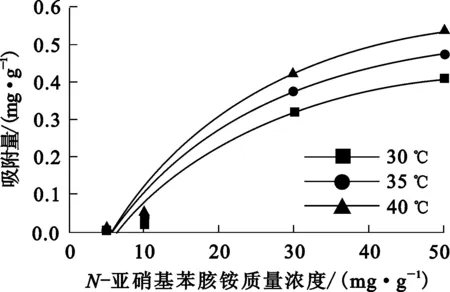
图5 不同温度条件下,N-亚硝基苯胲铵在金红石表面的吸附量随初始质量浓度的变化
2.2.1吸附等温模型和吸附容量
分别采用Langmuir模型(式5)、Freundlich模型(式6)对图5所示吸附过程进行拟合,拟合参数和曲线分别见表3和图6。
(5)
(6)
式中:ρe为吸附平衡后溶液药剂质量浓度,mg/L;qe、qm分别为平衡吸附量和饱和吸附量,mg/g;b为与金红石表面活性位点亲和力有关的常数,L/mg;kF为与吸附能力有关的容量因子;n为表征吸附过程难易的常数。
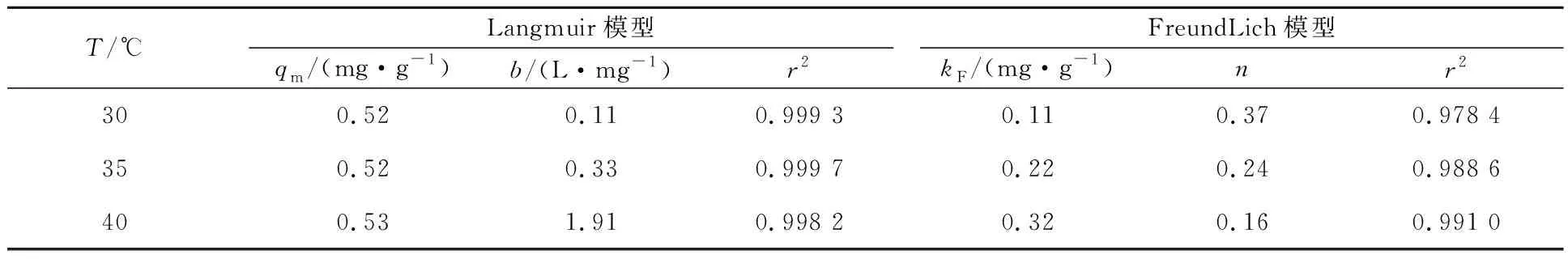
表3 Langmuir和Freundlich等温吸附模型的拟合参数

图6 Langmuir和Freundlich等温吸附模型拟合曲线
由表3可知:相对于Freundlich模型,Langmuir模型能更好地反映N-亚硝基苯胲铵在金红石表面的吸附行为,拟合所得理论饱和吸附量与试验值有很好的一致性,表明N-亚硝基苯胲铵在金红石表面的吸附为单层吸附;随温度升高,试验数据与Freundlich模型的符合程度也上升,说明当温度升高到一定程度时可能会有部分N-亚硝基苯胲铵离子在已吸附到金红石表面的捕收剂离子表面(第一层)发生第二次吸附。
2.2.2吸附过程的热力学参数
图5反映的N-亚硝基苯胲铵在金红石表面的吸附特性可通过吸附过程热力学参数计算(式(7))加以解释。
(7)
式中:ρ0、ρe分别为药剂在溶液中的初始质量浓度和吸附平衡时的质量浓度,mg/L;V为矿浆体积,L;m为矿样质量,g。
吸附过程中的ΔHΘ、ΔSΘ、ΔGΘ的变化见表4。可以看出:随矿浆温度升高,N-亚硝基苯胲铵在金红石表面的吸附ΔGΘ逐渐减小,表明同一药剂浓度下温度升高有利于吸附过程的进行,这与试验结果一致;相同温度下,药剂初始浓度升高,ΔGΘ的变化较为复杂,初始药剂质量浓度为62.0 mg/L时,ΔGΘ的值最小,说明金红石质量与初始药剂质量浓度有一最佳匹配值;另外,由ΔHΘ、ΔSΘ的变化可以看出,吸附过程为熵变推动过程。

表4 N-亚硝基苯胲铵在金红石表面的吸附过程表观热力学参数
2.2.3平均吸附能
平均吸附能(E)是判断药剂与矿物表面作用类型的重要指标[12],其表达式为
(8)
式中K由式(9)求得,
(9)
式中,ρe为吸附平衡后溶液中药剂质量浓度,mg/L。
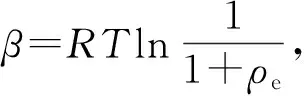
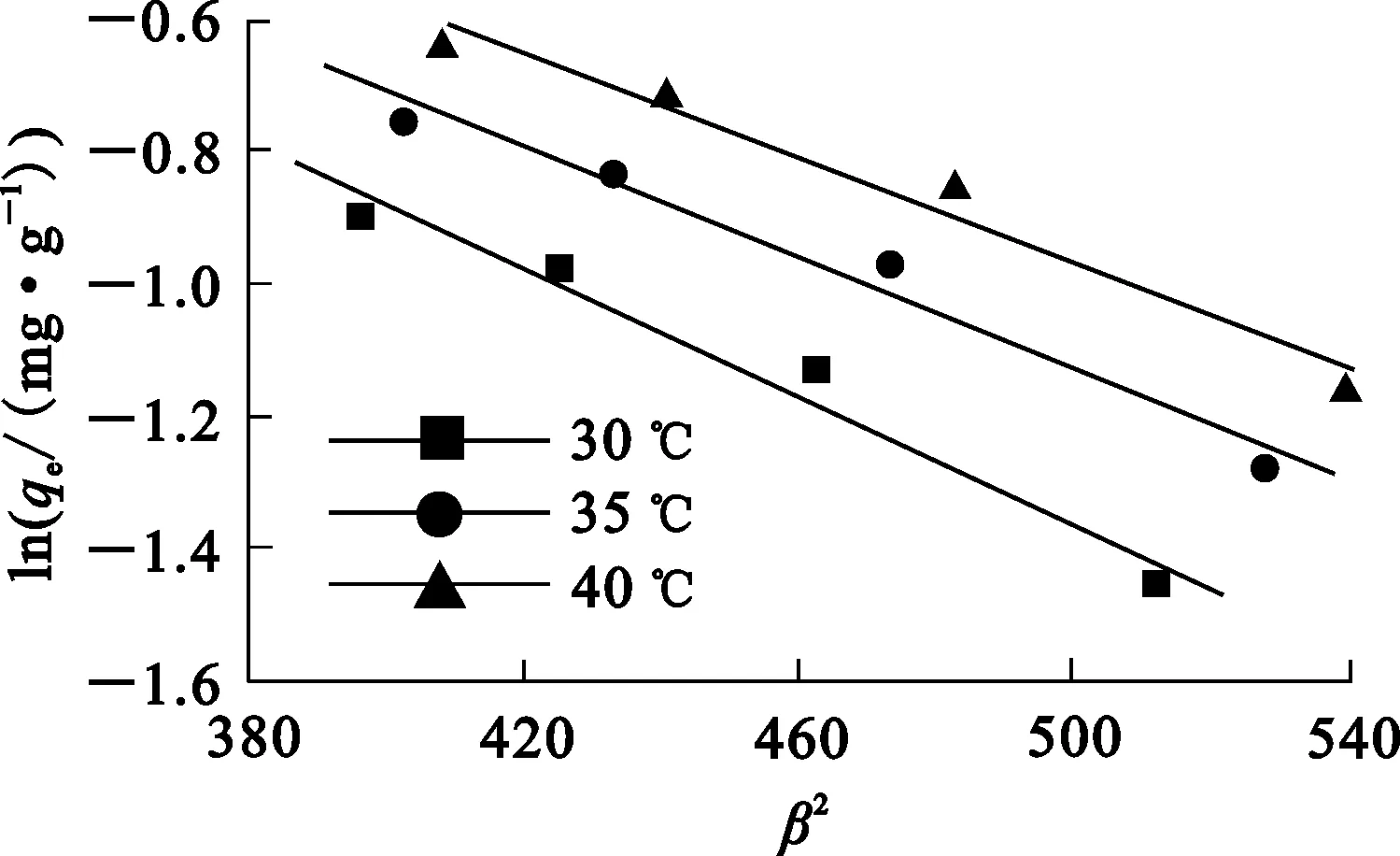
图7 不同温度下的D-R等温线
由图7看出,N-亚硝基苯胲铵在45、50、55 ℃条件下的平均吸附能分别为10.0、10.8、11.1 kJ/mol。由文献[12]可知,N-亚硝基苯胲铵在金红石表面的吸附过程可能是以药剂离子排开矿物表面吸附的水分子而吸附到矿物表面的离子交换型吸附为主。
3 结论
N-亚硝基苯胲铵在金红石表面的吸附速度较慢,20 min后达吸附平衡;弱酸性条件下的饱和吸附量大于中性和碱性条件下的吸附量,吸附动力学符合准一级动力学模型,金红石表面活性质点离子在矿物表膜中的扩散是药剂吸附过程中的控制步骤。
低温条件下,Langmuir 模型能很好描述N-亚硝基苯胲铵在金红石表面的吸附行为,而温度升高时,吸附等温线与Freundlich模型更吻合。
吸附过程中吸热,升高温度有利于反应进行。反应过程随药剂初始质量浓度增大更加复杂。药剂平均吸附能反映吸附过程以离子交换形式进行。
采用N-亚硝基苯胲铵作金红石捕收剂,在酸性条件下进行浮选并适当延长振荡时间,会在一定程度上提高选别指标,而对矿浆适当加温也可优化选别指标。
——以金红石为例

