猪流行性腹泻病毒贵州株M全基因遗传变异分析
田 琴,柳晓飞,张双翔,胡兴义,张 羽,田祥强,潘 永,杨兰兰,王开功,周碧君,文 明,程振涛
(1.贵州大学动物科学学院,贵州贵阳550025 ; 2. 贵州省动物疫病研究室,贵州贵阳550025 ;3.贵州省动物疫病预防控制中心,贵州贵阳550001)
猪流行性腹泻病(PED)是由猪流行性腹泻病毒(PEDV)引起的接触性肠道传染病,各日龄的猪群均能感染,主要临床症状表现为严重腹泻、呕吐、脱水,其中对哺乳仔猪危害最为严重。1978年英国首次报道PED后[1],中国于1980年首次报道该病,随后各省均有PEDV感染报道。2010年后,猪流行性腹泻在全球各国均发生大面积的流行[2-3]。我国也不例外,从南到北出现全面暴发,特别是2013年以来,该病给我国养猪业造成了巨大经济损失。
PEDV属单股正链RNA病毒,基因组全长约28 kb,编码4种结构蛋白和3种非结构蛋白。其中,S基因编码病毒纤突蛋白,该蛋白具有识别靶细胞可使病毒和细胞膜融合的作用,其在免疫反应中起重要作用,因此分析当地PEDV毒株的流行和遗传变异情况具有重要价值[4]。M基因编码的结构蛋白是一种跨膜蛋白,在病毒组装和出芽过程中起重要作用,保守性强,是作为检测PEDV的重要靶基因,在PEDV侵染的早期可妨碍宿主细胞基因的转录[5]。
目前,贵州省对PEDV的研究还侧重于病原调查、抗体水平检测等方面。对PEDV分子研究尚少,本试验对贵州省当前PEDV流行毒株的M全基因进行基因克隆和序列分析,为预防和控制PEDV提供有力的科学数据。
1 材料与方法
1.1 阳性样本来源 2017年6月贵州省福泉某规模化养猪场,1~8日龄仔猪出现严重腹泻、脱水和消瘦,采集肠道及内容物进行病原学检测。
1.2 主要试剂 RNA及DNA提取试剂盒,购自北京世纪元亨动物防疫技术有限公司;Prime ScriptTMRTMaster Mix,购自TaKaRa公司;E.Z.N.A.TMGelExtraction Kit胶回收试剂盒。
1.3 引物设计与合成 根据GenBank收录的PEDV M基因(登录号:AF-353511)设计一对特异性引物,上游引物:5′-TACATGCGAATTGACCCCCT-3′,下游引物:5′-ATCCTTGTTA GTGGGTACACCG-3′,大小为681 bp,并送上海英骏生物技术有限公司合成。
1.4 样本处理及核酸提取 将收集的肠道和内容物用其灭菌PBS进行研磨,-80 ℃冻融3次,离心取200 μL上清液加入1.5 mL离心管中,加入800 μL TRIZol,充分混匀并让其静置10 min,再加入200 μL氯仿,混匀静置10 min,12 000 r/min离心 8 min,取上清移入2.0 mL吸附柱套中,12 000 r/min 离心1 min,弃掉收集管中液体,加入400 μL RinseA 12 000 r/min离心 1 min,弃掉收集管中液体,加入700 μL RinseB 12 000 r/min离心 1 min(重复1次),空柱离心1 min,吸附柱移入1.5 mL离心管中,加入25 μL DEPC处理水,让其静置2 min,12 000 r/min离心 1 min,1.5 mL离心管中液体即为总RNA模板。
1.5 反转录及PEDV M全基因扩增 反转录体系:2 μL Prime Script1step Enzyme Mix,2 μL RNA,6 μL RNase Freed H2O,其条件:37 ℃ 15 min,85 ℃ 5 s。PCR扩增体系:cDNA 2.0 μL,2×TaqMix 12.5 μL,上游引物(10mol/L)1.0 μL,下游引物(10mol/L)1.0 μL,灭菌ddH2O 8.5 μL补至25 μL,其条件:94 ℃ 3 min,然后94 ℃ 30 s,58 ℃ 1 min,72 ℃ 1 min,35 个循环,72 ℃ 7 min。
1.6 PEDV M基因克隆、测序和遗传进化树分析 将RT- PCR扩增产物经胶回收纯化后,与载体pMD19-T连接过夜,转化DH5-α感受态细胞,取阳性菌液送至英潍捷基(上海)贸易有限公司进行测序。利用DNAStar中的MegAlign对2株PEDV贵州流行毒株及国内外登录的26株参考毒株的M全基因进行遗传进化树和同源性分析。
2 结果与分析
2.1 PEDV M全基因RT- PCR扩增结果 将其扩增产物取8 μL上样于1.2%琼脂糖凝胶电泳,可见大小为681 bp的特异性扩增片段,与预期结果一致(图1)。
图1 PEDV M全基因RT- PCR扩增结果
M:DL-2 000 Marker; 1-2:PEDV M全基因RT- PCR产物;
-:阴性对照
2.2 PEDV M全基因测序结果 经克隆为阳性的菌液送至英潍捷基(上海)贸易有限公司进行测序拼接,为了便于分析测序结果与GenBank公布的不同地方26株PEDV流行毒株对比,证实获得了2株PEDV M全基因序列,将其命名为GZFQ06-2017,M基因全长为681 bp,编码226个氨基酸。
2.3 PEDV M全基因的核苷酸序列的同源性分析 利用DNAStar软件对PEDV M全基因的核苷酸和氨基酸序列进行同源性分析。由表1可知,GZFQ06-2017 PEDV M基因与GenBank 公布的26株参考序列(除韩国毒株SM98)的核苷酸相似性为94.0%~95.2%,与中国福建CH/FJZZ-9/201毒株和中国海南CH/HNQX-3/14毒株核苷酸相似性最低,为94.0%,与中国江苏SQ2014毒株核苷酸相似性最高,为95.2%。表明贵州省2017年6月GZFQ06-2017毒株与过去的分离毒株存在突变。
表1PEDVM全基因核苷酸序列同源性比较

2.4 PEDV M全基因遗传进化树分析 应用MegAlign等软件对测序序列与参考序列进行系统进化树绘制,系统进化树构建结果(见图2)。GZFQ06-2017为本试验经克隆得到的序列,从遗传进化树可以看出,除韩国毒株SM98外,2017年6月贵州省PEDV流行毒株GZFQ06-2017与韩国疫苗株Attenuated DR13、中国江苏SQ2014、中国四川SC1402毒株和中国新疆CH/S在同一分支上,其亲缘关系较近;与中国湖北CH-hubei-2016、中国云南CH/YNKM-8/2013亲缘关系较远;而经典毒株CV777与1986年中国新疆CH/S毒株在同一分支上。可以推测贵州的PEDV流行毒株M全基因与过往或者其他国家(或地区)相比出现一定的变异,但是仍然与经典毒株CV777、韩国疫苗株Attenuated DR13、中国江苏SQ2014、中国四川SC1402和1986年中国新疆CH/S分支相距将近,推导亲缘关系较近。
3 讨论
PEDV是20世纪70年代报道以来,是导致猪病毒性腹泻的最主要的病原之一,感染后仔猪表现严重呕吐、水样腹泻和脱水直至死亡等临床症状,该病毒的体外繁殖一直困扰着该病的深入研究[6]。过去,研究人员采用多种方法试图使病毒适于细胞培养,先后以PK-15细胞、BHK细胞和人肺细胞等进行相关试验,但均没有成功,直到1988年 Hofmann 等在培养液中加入胰酶,使PEDV成功地适应于Vero传代细胞[7]。贵州省2010冬季以来受到猪病毒性腹泻的肆虐,其中,PED每年冬春季节发病率和病死率都在逐年增加,因此该病的流行一直受到人们的广泛关注。
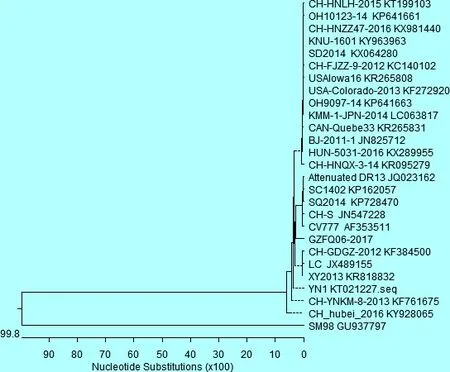
图2PEDVM全基因核苷酸系统进化树分析
虽然PEDV只有一种血清型,但是分子生物学的分析结果表明,PEDV的基因组存在基因多样性[8]。其中,PEDV M基因全长681 bp,编码226个氨基酸,构成病毒的表面结构蛋白,分子量为27 kDa~32 kDa,是一种跨膜糖蛋白。M蛋白无信号肽,预测具有3个跨膜区域,包含两个RNA结合结构域,分别位于病毒外面的氨基末端结构域和病毒内部的羧基结构域,且保守性相对较高。有研究表明,M蛋白可以与M蛋白自身、N蛋白和S蛋白相互作用,在病毒组装过程中发挥重要作用。据报道,同属于冠状病毒科的SARS病毒其M蛋白具有干扰素拮抗活性。因此M蛋白常被研究者作为检测PEDV引物设计的首选,同时M蛋白可以作为PEDV基因工程疫苗的候选抗原[9]。
本研究利用RT -PCR成功检测到2017年6月贵州省福泉某规模化养猪场8日龄左右的哺乳仔猪仅存在PEDV感染,对其中2份阳性样品的PEDV M基因进行克隆和序列比对,结果发现,2株PEDV贵州流行毒株M基因与GenBank上公布的26株PEDV M 基因序列进行比对,GZFQ06-2017 PEDV M基因与参考序列(除韩国毒株SM98)的核苷酸相似性为94.0%~95.2%,与中国福建CH/FJZZ-9/201毒株和海南CH/HNQX-3/14毒株核苷酸相似性最低,为94.0%;与中国江苏SQ2014毒株核苷酸相似性最高,达95.2%。推测贵州省2017年6月GZFQ06-2017毒株与过去的分离毒株存在较大的基因突变。 M基因系统发育树分析结果表明,GZFQ06-2017 PEDV流行毒株与韩国疫苗株Attenuated DR13、中国江苏SQ2014和中国四川SC1402毒株分支相距较近,而与经典毒株CV777与1986年中国新疆CH/S毒株在分支相近,得出其亲缘关系较近;与中国湖北CH-hubei-2016和中国云南CH/YNKM- 8/2013亲缘关系较远。可以推导目前贵州的PEDV GZFQ06-2017 M全基因与过往其他国家(或地区)相比出现较大的差异。说明近年来贵州省不同地区的PEDV流行毒株的M基因变异性大,这与过去的研究结果类似。

