SFTS病毒感染脾脏网状成纤维细胞系的建立
李嘉嘉 陈振 刘伯玉 Adams Latif 刘洋 李川 李阿茜 梁米芳 李德新 柳燕
230032合肥,安徽医科大学微生物教研室(李嘉嘉、陈振、刘伯玉、Adams Latif、柳燕);102206北京,中国疾病预防控制中心病毒病预防控制所(刘洋、李川、李阿茜、梁米芳、李德新)
脾脏是机体最大的免疫器官,是机体细胞免疫和体液免疫的中心。脾脏FRCs是重要的淋巴基质细胞之一,它建立细胞网络,分泌趋化因子以吸引T细胞和树突状细胞,滋养这两种免疫细胞并参与抗原递呈[1];FRCs通过抑制效应T细胞和支持调节T细胞来调节T细胞功能[2];FRCs本身在炎症反应中起作用,其标志性蛋白Podoplanin在局部炎症时能与DC细胞的CLEC-2蛋白相互作用,参与淋巴结的重塑反应[3]。FRCs自身也是 SFTSV、埃博拉病毒、拉沙热病毒、马尔堡病毒等出血热病毒直接感染的靶细胞[4]。其中SFTSV是由我国科学家团队首先分离、发现并命名的布尼亚病毒目Phenuiviridae科白蛉病毒属的新病毒[5]。项目组研究发现,在致死性感染动物模型中,SFTSV感染的主要靶器官是脾脏,而脾脏的FRCs是SFTSV致死性感染的主要靶细胞[6-7],美国Hideki Ebihara团队的动物模型实验[8]和日本学者发布的SFTSV感染死亡患者尸检报告[9]也证实这一结论。但由于脾脏网状纤维细胞分离困难,没有市售的成品细胞系,FRCs在SFTSV、埃博拉病毒、马尔堡病毒等出血热症候群病毒感染中引起的致死机制鲜有报道,建立永生化的FRCs显得尤为重要。
1 材料与方法
1.1 FRCs的分离、培养与永生化 选取4周龄小鼠,处死取脾脏,剪碎后加入5 ml消化液(含0.8 mg/ml金属酶、0.2 mg/ml 胶原酶 P、0.1 mg/ml DNA酶I的DMEM,均购自罗氏公司)37℃消化15 min,离心去除消化液,细胞沉淀用4℃ FACS缓冲液(含 2%FBS 5 mmol/L EDTA 的 PBS)重悬,200目滤网过滤;胎盘蓝染色计数,加入CD45磁珠抗体(德国Miltemyi Biotec GmbH),4 ℃孵育 30 min,使用autoMACS(德国Miltemyi Biotec GmbH)系统的阴性分选程序,富集CD45阴性的细胞群;富集产物按每106细胞加100μl抗体工作液,4℃避光反应30 min,PBS洗两次,重悬过滤后使用MoFlo XDP(美国Beckman Coulter,Inc公司)分选 CD45-CD31-podoplanin+的细胞群(100μm 喷头、纯化模式),分选产物计数后接种;75 CM2培养瓶接种纯化的原代FRCs细胞,待细胞达到70% ~80%覆盖,加入维持液(2%FBS、1%双抗的 DMEM)稀释的 SV40(MOI值为2,上海吉满生物科技有限公司)37℃震荡孵育1 h,补足15 ml维持液继续培养48 h,换用2μg/ml嘌呤霉素的营养液培养;筛选后的细胞进行单克隆培养,选取生长较好的克隆细胞,进行传代培养;低浓度胰蛋白酶短时消化培养的细胞,PBS洗两次,细胞重悬后,按每106细胞加100μl抗体工作液,4℃避光反应30 min,PBS洗两次,重悬过滤后上FACS CantoⅡ(美国 BD公司)检测 CD45-CD31-podoplanin+的细胞群比例,选出符合表型细胞克隆传代培养50代以上。
1.2 FRCs克隆株的生长曲线和克隆形成实验选取生长旺盛的原代 FRCs细胞、Clone01和Clone02细胞消化、悬浮、计数,各取20 000个活细胞,分别接种于96孔培养板,每天进行细胞计数,统计5 d内每天的细胞数量;稀释Clone01和Clone02,低密度(400个每皿)接种于培养皿培养1周后,统计形成的集落数。
1.3 原代FRCs和永生化FRCs的转录组测序和数据分析 在75 CM2培养瓶接种纯化的原代FRCs细胞和永生化的Clone02 FRCs(每种细胞3个生物重复)加营养液培养48 h,使用低浓度胰蛋白酶短时消化培养的细胞,4℃ 预冷的PBS洗3次(每次离心条件为4℃ 300×g离心3 min),细胞沉淀使用3 ml Trizol完全溶解,干冰运输至华大基因公司质检合格后进行建库测序。
1.4 永生化FRCs免疫表型验证和SFTSV感染实验 永生化的Clone02 FRCs接种到Chamber Slide(美国Thermo Scientific),待细胞达到70% ~80%覆盖(约 24 h),加入维持液(2%FBS、1% 双抗的DMEM)稀释的病毒(分4组,MOI值分别为0,0.5,2,10)37oC 震荡孵育1 h,PBS洗3 遍,加维持液继续培养24 h,吸去维持液,PBS洗3遍,预冷的固定液(甲醇和丙酮1∶1)固定 10 min,吸去固定液,-20oC保存待用。Chamber内固定的Clone02 FRCs,未感染的细胞分出两组分别加入PBS稀释的抗小鼠podoplanin和CD31抗体、podoplanin和抗成纤维细胞抗体,感染的细胞和对照组分别加入PBS稀释的抗小鼠podoplanin和SFTSV全病毒抗体,湿盒内37℃孵育1 h,PBS洗3次,晾干后加入伊文思蓝稀释液稀释后的两种相应的荧光二抗,湿盒内37℃孵育1 h,PBS洗3次;使用DAPI工作液染色10 min,PBS洗3次,用激光共聚焦显微镜(德国徕卡TCS SP8)拍照。
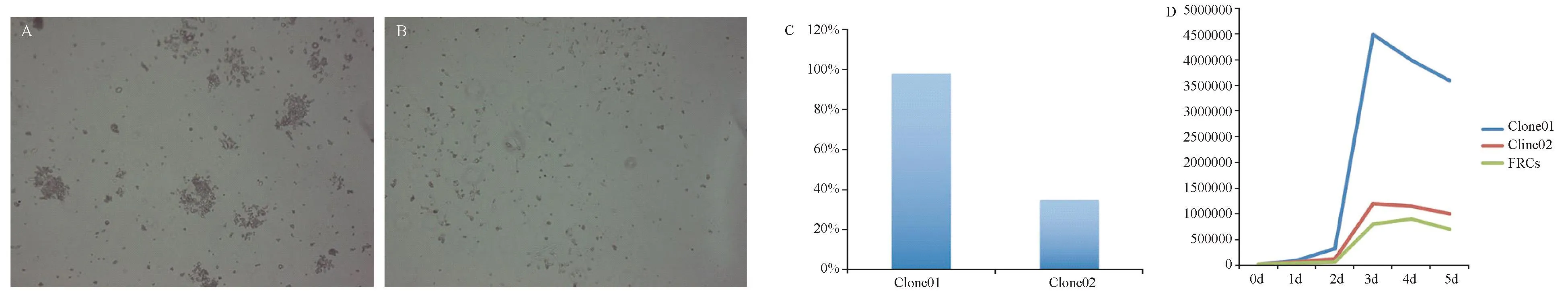
A,Clone01和Clone02克隆形成实验的形态图.B,Clone02克隆形成实验的形态图.C,Clone01和Clone02克隆形成率柱状对比图.D,原代细胞、Clone01和Clone02的生长曲线的折线图,Y轴表示细胞数量,X轴代表细胞生长的时间图1 Clone02和Clone01的克隆形成实验和生长曲线A,The microscopic photographs of clone formation of Clone 01.B,The microscopic photographs of clone formation of Clone 02.C,The colony forming efficiency of Clone 01 vs Clone 02.D,The growth curve of Clone 02,Clone 01,primary FRCs.The graphs represent the number of cells counted (Y-axis) from each culture once per day during 5 days(X-axis)Fig.1 Colony forming and expansion rate of Clone 02 and Clone 01
2 结果
2.1 原代FRCs和永生化FRCs体外分离、培养结果 培养4 h后,会有少量不贴壁的细胞,换液后可清除,多色流式细胞仪鉴定细胞纯度达到99%。分离纯化的原代细胞体外可稳定传代多次,细胞较大,卵圆或星形,多突,胞核呈椭圆形,胞质颗粒较多,细胞融合后规则排列,呈放射状或涡旋走形。分离到4个永生化克隆株,其中只有Clone01和Clone02与原代的免疫表型相同,Clone03表达了 CD45,而Clone04的podoplanin表达减弱;Clone01细胞胞体变小,变圆,生长和分布形态变化很大,Clone02形态则与原代FRCs相同。
2.2 FRCs永生化细胞的生长曲线和克隆形成实验结果 Clone01所形成的集落和Clone02差别较大,Clone01形成的集落较小,Clone02形成的集落交大,常部分融合,Clone02的克隆形成率低于Clone01。原代细胞和Clone02的生长曲线较为接近,Clone01的生长曲线与它们差异显著(图1)。
2.3 原代FRCs与永生化FRCs的转录组测序和数据分析结果 原代 FRCs、Clone02的 CD31、podoplanin和CD45基因表达定量结果与流式细胞仪结果接近。据表中各基因表达的fpkm值(小于等于1为极低表达水平的基因,1~10之间的为较低表达水平的基因,大于等于10的为中高表达水平的基因),发现二种细胞表型均为成纤维细胞标记和podoplanin中高强度表达,CD45和CD31极低水平表达(见表1)。样本相关性分析发现,各样本生物重复之间相关性均不小于0.99,生物重复之间差异小,样本代表性强。Clone02和原代FRCs相关性较好,生物重复两两比较的pearson相关系数在0.965到0.980之间(图2)。
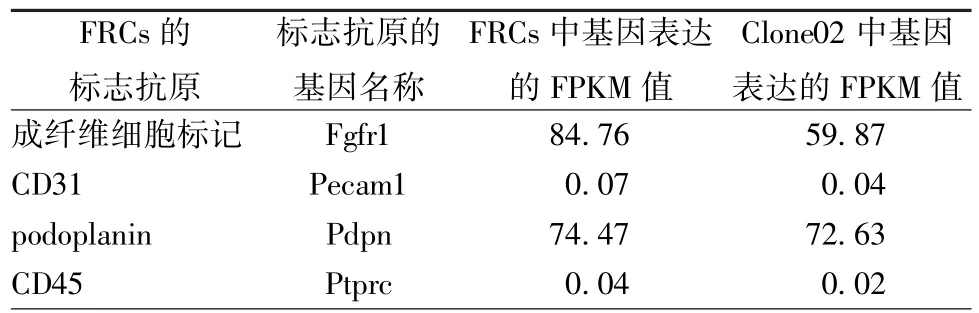
表1 转录组测序分析FRCs标志抗原基因表达的结果Tab.1 Gene expression analysis of FRCs markers by RNA-seq
2.4 永生化FRCs免疫表型验证 和SFTSV感染实验结果 通过激光共聚焦技术结果证明:在Clone02细胞上,表达成纤维细胞标志和podoplanin,不表达 CD31(图3);在 MOI值0.5 的低浓度下,SFTSV就可以感染Clone02细胞,SFTSV病毒颗粒在细胞内染色呈绿色沙粒状(图4)。
3 讨论
FRCs由于其在脾脏中含量低于0.1%,体外分离纯化难度较大,采用磁珠分选富集和流式细胞仪精确分选逐级分选方法,保证了分选的效率和纯度;FRCs不表达造血细胞标志抗原CD45和表皮细胞标志抗原 CD31,特异的表达淋巴标记抗原podoplanin,3种抗体组合可以排除白细胞、血管内皮细胞、淋巴内皮细胞等的干扰,同时流式细胞术、转录组测序基因表达分析和激光共聚焦技术联合使用,保证实验结果的准确、可靠[10]。
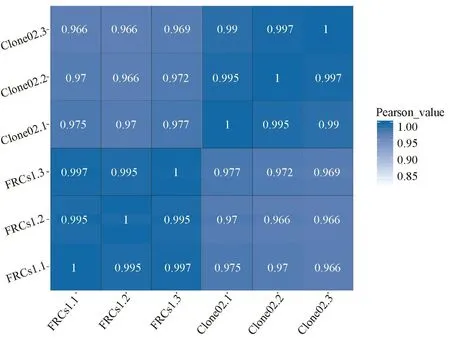
X、Y轴代表每个样本,每个样本3个生物重复,样本之间、各生物重复之间进行两两比较,方格的颜色越深、数值越高代表相关性越好,颜色越浅相关性越差图2 两种样品间Pearson相关性分析热图Both X and Y axis represent each sample and its three biological repeats.The darker color and higher value inside indicate higher Pearson correlation,while the lighter and lower ones mean lower Pearson correlationFig.2 Heatmap of Pearson correlation between samples

激光共聚焦结果证实Clone02细胞表达成纤维细胞标记和淋巴标记podoplanin,不表达表皮细胞标记CD31图3 Clone02免疫表型的验证结果Under a Confocal Microscopy,Clone 02 cells express the key surface marker podoplanin and fibroblasts marker,do not express endothelial cells marker CD31Fig.3 Polychromatic fluorescent labeled Clone 02 cells
转录组测序的样品相关分析通过基因表达谱从宏观上证明了永生化细胞与原代细胞的相似性。Pearson相关分析显示Clone02株细胞与原代细胞基因表达谱相似,提示永生化的细胞很好的保留了原代细胞的功能和特性。
体外感染实验说明Clone02保留了体内FRCs细胞可以被 SFTSV 感染的特性[6-7,11],因此可以推断FRCs Clone02与原代细胞生物学特征接近,免疫表型接近,基因表达谱相似,可以被SFTSV感染,是一个潜在的进行体外FRCs细胞的功能及SFTSV感染机制研究的细胞平台。
蓝色为细胞核,绿色沙粒状的为病毒染色,红色标记为FRCs特异标记podoplanin,三色合并为一张彩色图图4 感染SFTSV后Clone02的激光共聚焦结果Under a Confocal Microscopy,nucleus stained with DAPI emit bright blue light, viral particles of SFTSV green fluorescence,podoplanin in cytoplasm of Clone 02 red light.Pictures of three colors are merged in oneFig.4 Polychromatic fluorescent labeled SFTSV infected Clone02
利益冲突 无

