血行播散性肺结核并发肠结核多发穿孔一例
蒋钰辉 盛健 戴希勇
血行播散性肺结核是结核分枝杆菌进入血液后广泛散布到肺或各器官引起的一种严重全身性结核病,近50%并发肺外结核[1]。在血行播散性肺结核并发的肺外结核中,肠结核的发病率并不高,且大多可通过内科保守治疗痊愈,但若继发肠穿孔、肠梗阻、消化道出血等并发症,往往需要外科治疗。病灶单一的、局限性的肠结核穿孔,虽然存在患者基础状况差、结核感染未控制等问题,但由于术中可以将病变肠管一期切除,治疗效果总体较好。而对临床上少见的多节段性肠结核继发的多发肠穿孔,手术治疗困难,预后极差[2]。笔者报告1例血行播散性肺结核并发肠结核多发穿孔患者的诊疗经过,以总结经验教训,供临床医师交流探讨。
临床资料
患者,男,27岁,务工人员。体质量45 kg,身高175 cm。因“间断咽痛4个月,发热2个月”,于2017年7月4日入武汉市肺科医院治疗。患者于2017年3月开始无明显诱因出现咽痛,以“咽喉炎”行抗感染治疗,但患者临床症状反复。2017年5月开始出现间断发热,体温在37.5~39.0 ℃之间波动,多为夜间发热,无畏寒、寒战,无盗汗,抗感染治疗效果不佳。偶感腹痛、腹胀,伴纳差,可自行缓解。大便每日1~3次不等,多为黄色糊状便;小便如常。既往无烟酒等不良嗜好,无毒品接触史,无粉尘接触史,无病毒性肝炎、艾滋病、梅毒等传染病史。
入院检查:体温36.6 ℃,脉搏140次/min,呼吸频率23次/min,血压107/86 mm Hg(1 mm Hg=0.133 kPa)。营养风险筛查2002(nutritional risk screening 2002,NRS 2002)评分表评分为4分,提示患者存在营养风险。患者神志清醒,体型消瘦,全身皮肤及巩膜无黄染及出血点,咽后壁充血,可见散在浅溃疡。双侧颈部可触及小淋巴结,直径介于0.5~2.0 cm之间,质地坚韧,边界清楚,活动可,无压痛。听诊双肺呼吸音稍粗,双肺未闻及干湿性啰音。心律齐,无杂音。腹部平软,无压痛及反跳痛,肝脾肋下未触及,移动性浊音阴性,肠鸣音活跃。双下肢水肿。生理反射存在,病理反射未引出。入院后血常规检查:白细胞计数2.01×109/L、红细胞计数3.85×1012/L、血红蛋白105.00 g/L、红细胞压积0.33、中性粒细胞比率0.89。肝功能、血电解质检测:丙氨酸氨基转移酶79 U/L、天冬氨酸氨基转移酶112 U/L、总蛋白49.5 g/L、白蛋白21.1 g/L、钠133.50 mmol/L、钾2.95 mmol/L、钙2.05 mmol/L。红细胞沉降率64.0 mm/1 h。超敏C反应蛋白92.14 mg/L。降钙素原27.42 ng/L。乙型肝炎、丙型肝炎、HIV、梅毒抗体相关检查结果均正常。痰抗酸染色涂片检查3次阳性。痰TB-DNA 2×106拷贝/ml。胸部CT检查,显示双肺出现大小不一的微结节、粟粒状影,部分融合呈片状,双上肺见环形空洞(图1,2)。颅脑MR增强扫描,显示左侧小脑出现小结节状环形强化影;脑池、脑室大小形态正常,脑沟、裂不宽,中线结构居中,两侧丘脑、脑干未见明显异常信号及强化(图3)。

图1 胸部CT扫描(2017年7月4日),双上肺可见弥漫性大小不一的粟粒样结节影,部分融合,并可见环形空洞 图2 胸部CT扫描(2017年7月4日),双下肺可见弥漫性大小不一的结节、粟粒状影,部分融合呈片状 图3 颅脑MR增强扫描(2017年7月5日),左侧小脑可见小结节状环行强化影
患者入院后,7月4日夜间腹泻6次,排出褐色水样便,每次50~200 ml。大便隐血试验阳性。大便抗酸染色涂片检查阴性。大便TB-DNA 3×104拷贝/ml。腹腔彩色超声检查显示腹腔少量积液。予以抑酸、口服益生菌等对症治疗后腹泻症状缓解。于7月5日开始予以患者H-R-E-Mfx-Am(H:异烟肼;R:利福平;E:乙胺丁醇;Mfx:莫西沙星;Am:阿米卡星)口服,并行抗感染、护肝、升白细胞等对症治疗,患者发热症状缓解。7月7日凌晨患者突发腹痛,为阵发性胀痛;临床检查见腹肌稍紧张,下腹部压痛阳性,反跳痛可疑阳性,无移动性浊音,肠鸣音活跃,可闻及气过水声。腹部立位X线摄影显示肠积气,未见明显液平及膈下游离气体(图4)。进一步行腹部CT检查,显示腹腔积液、肠系膜炎、腹膜炎;左侧可见部分小肠内气液平面,考虑为肠梗阻。予以禁食,行胃肠减压,抗结核药物调整为H-R-Mfx-Am静脉滴注,并加用静脉营养支持[氨基酸脂肪乳葡萄糖注射液(卡文)、20%人血白蛋白等]等治疗,患者腹痛症状逐步改善。7月9日下午患者突发腹痛加剧,为持续性胀痛。临床检查:腹部平,腹肌紧张,满腹压痛阳性,反跳痛阳性,移动性浊音阳性,肠鸣音弱。行腹部立位X线摄影,显示左侧膈下游离气体,小肠见阶梯状液平,考虑为肠穿孔、肠梗阻(图5)。于7月10日 1:00急诊行剖腹探查术,术中探查见腹腔大量黄绿色浑浊液体,内含食物残渣,总量约1200 ml;自十二指肠悬韧带远端约120 cm处至回盲部近端约50 cm处、长约160 cm小肠见13处溃疡,溃疡直径约0.8~2 cm,其中9处溃疡中央见直径约0.3~0.6 cm的穿孔,穿孔部位间隔1~15 cm不等的距离,可见肠液外溢;另4处溃疡穿透至浆膜下,透过浆膜可见干酪样坏死物(图6)。小肠及肠系膜水肿,见散在粟粒样结节,并附着脓苔;肠系膜淋巴结多发肿大,直径介于0.5~2 cm之间,质地坚韧,边界清楚,表面光滑。术中经参与手术医师讨论后,先将小肠穿孔及溃疡逐一修补(图7),后于距第一处穿孔近端约10 cm(距十二指肠悬韧带约110 cm)处的正常空肠肠管处作空肠双腔造瘘术(图8)。术中取小肠溃疡内坏死物检查:GeneXpert MTB/RIF检测到结核分枝杆菌,未检出rpoB突变;TB-DNA 30 000拷贝/ml;结核分枝杆菌液体培养及药物敏感性试验结果显示:结核分枝杆菌,对抗结核药物均敏感。
术后予以H-R-Am-Lfx-“Amx-Clv”(Lfx:左氧氟沙星;Amx-Clv:阿莫西林-克拉维酸钾)静脉滴注、营养支持[氨基酸脂肪乳葡萄糖注射液(卡文)、电解质等]、护肝、抑酸等对症治疗,另予以奥曲肽连续静脉泵入5 d,以减少胃肠道分泌。术后第3日患者空肠造瘘口可见肠液溢出,拔除胃管并行流质饮食。后患者持续行静脉营养治疗,逐步调整为半流质饮食,并辅以整蛋白型肠内营养剂(能全素)口服。术后1周后造瘘口肠液每日溢出量约1200~2000 ml,期间监测见反复电解质紊乱,并出现精神差、四肢麻木抽搐等症状,经对症补充电解质后缓解。术后1个月(8月15日)将胃管经空肠远端造瘘口送入远端小肠约50 cm处(图9),经胃管泵入5%葡萄糖注射液,泵速由20 ml/h逐步增加至200 ml/h,持续泵入48 h,患者无腹痛、腹胀、腹泻等不适症状;后使用短肽型肠内营养混悬液(百普力),初始泵速20 ml/h、总量500 ml/d,逐步提升泵速至200 ml/h、1500 ml/d,并逐步停用静脉营养治疗,监测患者血电解质、白蛋白及血红蛋白等逐步恢复并稳定在基本正常水平。
8月20日开始,患者反复诉咽喉异物感,怀疑为喉结核出现进展。为强化抗结核药物治疗,于8月28日开始经营养管注入乙胺丁醇(EMB)1.0 g,8月30日经营养管注入吡嗪酰胺(PZA)1.5 g后,患者出现全身皮疹。随后以H-R-E-Lfx-Am-“Amx-Clv”方案维持,并加用异烟肼、布地奈德混悬液雾化吸入治疗。患者咽喉异物感症状进行性加重,并逐步出现吞咽困难。9月11日行电子喉镜示咽部黏膜充血,舌根结节状隆起,会厌呈结节状改变,结构不清。9月16日患者进食鸡蛋后出现呛咳、窒息,急诊行纤维支气管镜检查,示鼻咽后壁黏膜充血、肿胀,周围管壁黏膜红肿、充血、增生、糜烂,喉咽腔重度狭窄,纤维支气管镜无法通过。于9月16日急诊行气管切开术。术后停止进食,予以短肽型肠内营养混悬液(百普力)行造瘘口远端肠内营养治疗。术后患者仍感咽喉部异物感及吞咽困难,请外院耳鼻喉科医师会诊,建议至少抗结核药物治疗3个月以上再酌情考虑是否行手术治疗。
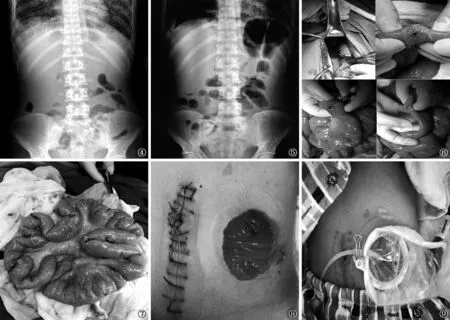
图4 患者腹部立位X线摄影(2017年7月7日),示肠积气,未见明显液平及膈下游离气体 图5 患者腹部立位X线摄影(2017年7月9日),示右侧膈下游离气体,小肠见阶梯状液平 图6 对患者行剖腹探查术(2017年7月10日),术中见腹腔大量肠液,小肠可见13处溃疡,其中9处穿孔 图7 2017年7月10日,对患者行小肠穿孔修补术后的整体观 图8 2017年7月10日,对患者行空肠造瘘术,显示造瘘肠管红润 图9 2018年8月15日,将胃管送入患者空肠造瘘口远端约50 cm处,经该通道行肠内营养治疗
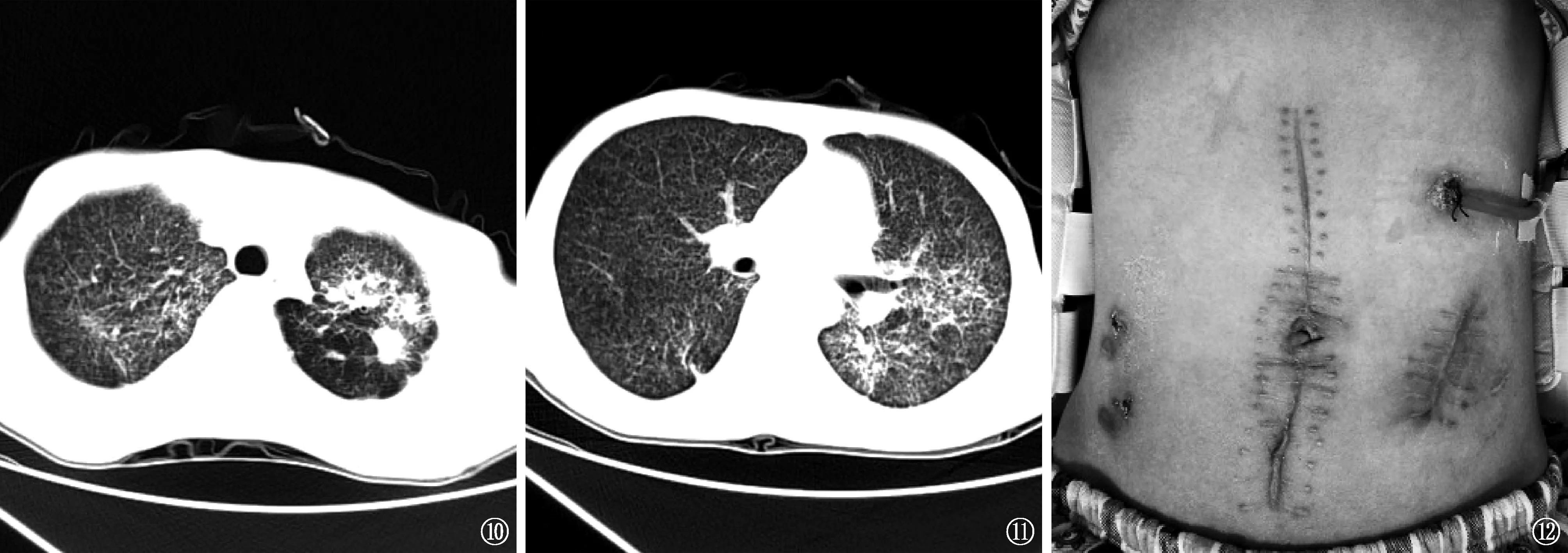
图10 患者胸部CT检查(2017年10月10日),双上肺见斑片状、条索状高密度影,粟粒样结节明显吸收,空洞闭合 图11 患者胸部CT检查(2017年10月10日),示双下肺粟粒样结节明显吸收,可见斑片状、条索状高密度影 图12 对患者行空肠造瘘还纳+胃造瘘术(2017年11月7日),左上腹可见胃造瘘口引出
经前述抗结核药物治疗方案治疗4个月后,对患者进行胸部CT复查,见肺部病灶明显吸收(图10,11)。11月2日对患者进行喉镜复查,示鼻咽部软腭与咽后壁粘连,会厌舌根平面组织增生狭窄。经科内讨论后,拟经鼻腔置入空肠营养管后行空肠造口还纳术;11月4日行经鼻腔置入空肠营养管失败,11月7日在全麻下经喉镜引导再次试行置入空肠营养管,见舌根与咽后壁粘连,营养管无法通过,改行空肠造瘘还纳+胃造瘘术(图12)。术后3 d患者肛门排气,经胃造瘘管注入米汤后出现腹胀,考虑为空肠造瘘后“胃瘫”。经造瘘管行胃肠减压并予以促胃肠动力药物治疗后症状缓解,于术后15 d开始逐步经胃造瘘管注入流质食物,患者未再发腹胀。于11月26日调整为口服抗结核药物治疗方案为H-R-E,经胃造瘘管注入。患者对抗结核药物治疗耐受良好,后患者出院至外院耳鼻喉科治疗,于2017年12月17日行喉结核病灶清除术,手术标本病理显示:肉芽肿性炎,倾向于结核性肉芽肿。术后恢复正常进食,于2018年1月10日返回我科拔除胃造瘘管。
术后随访6个月,患者未再发肠穿孔、肠梗阻等。2018年1月因喉结核致喉狭窄再次行喉结核病灶清除+气管切开术治疗。
讨 论
肠结核穿孔是腹腔结核中常见的急症之一,具有临床表现不典型、患者一般状况差等特点,临床诊断、治疗困难。与常见的外伤、溃疡等引起的肠穿孔一样,肠结核穿孔一旦诊断明确,需急诊手术。但是,由于结核病本身的病理生理特点,肠结核穿孔的手术方式与术后治疗原则在细节上与其他原因所致的肠穿孔存在一些差异。
一、手术方式的选择及存在的问题
肠结核发病部位不固定,最好发部位是回盲部,其次为空回肠、升结肠、横结肠、乙状结肠等,部分甚至可呈节段性分布[2-3]。由于肠结核穿孔部位为活动的结核病灶,且患者营养状况差,腹腔感染严重,若仅行穿孔修补术,则术后再穿孔发生率高[4]。因此,肠结核穿孔的手术原则是切除病变肠管,清除腹腔结核病灶及充分引流。对病灶局限者,应积极行肠切除术,并一期行肠吻合。病灶广泛或腹腔污染严重者,可行肠切除术,同时辅助横结肠造口或回肠造口术[3]。对于临床比较少见的多节段性肠结核出现多部位穿孔者,手术治疗比较棘手,目前国内文献报道的治疗成功率不高。张建等[3]报道1例患者,病灶共34处,穿孔7处,病变涵盖空肠起始到回肠末段,无法作肠切除,仅行修补术,患者于围手术期死亡。建议对于病灶广泛并病情危重者,可行肠道短路手术,待全身情况改善后再行二期病灶切除术。杨薇等[5]报道1例患者小肠穿孔5处,行肠穿孔修补术,术后第4日出现肠瘘,患者于围手术期死亡。笔者在本例患者的手术方式选择上也犹豫不决,经过参与手术的医师紧急讨论后,采取先将小肠溃疡及穿孔部位逐一修补,后于距第一处穿孔近端约10 cm处空肠行空肠双腔造瘘术。选择这种手术方式的优点是:将病变肠管段暂时旷置,可减少肠液的物理化学刺激,降低早期肠瘘风险;造瘘口近端正常的胃、十二指肠及近端空肠仍具备一定的消化吸收能力,适当进食可维持上消化道正常的功能和生理屏障;术后评估肠穿孔愈合后,可经造瘘口行远端小肠肠内营养支持治疗,保证患者充足的营养供给;术后抗结核治疗3个月以上,待结核病控制稳定后行消化道重建,可尽可能保留肠管,保证患者以后正常的消化吸收功能。然而,在后期的临床观察中发现,该术式也存在一定的弊端。首先是近端空肠造瘘后,造瘘口近端肠管的消化吸收不能满足机体所需,口服抗结核药物吸收不足,需肠外营养及静脉输注抗结核药物治疗。其次,造瘘口近端肠液经造瘘口大量丢失,导致反复的电解质紊乱和酸碱失衡。此外,术后患者因喉结核进展致喉狭窄无法进食,造瘘口近端胃肠道出现“废用”性功能紊乱,在空肠造瘘还纳术后早期出现“胃瘫”。因此,这种术式对于医护人员在围手术期的临床观察、营养监测治疗及抗结核治疗方案合理制定等方面要求较高。
二、术后治疗
当肠结核出现肠梗阻、消化道出血等并发症时,病程迁延反复,需长期禁食。另外,肠结核行肠造瘘术,尤其是近端小肠造瘘术者,由于肠道消化吸收面积的减少,术后常出现营养不良和口服抗结核药吸收不足。因此,正确的营养支持治疗和合适的抗结核药物治疗是这类患者治疗的核心,也是困难所在。
对于有消化道症状的肠结核患者,尤其是长期进食不足及行腹部手术者,均存在营养不良风险,应进行营养风险评估。临床上常用的营养评定工具较多,各有优缺点及应用范围。《SCCM/ASPEN成人危重症病人营养支持治疗实施与评价指南(2016版)》[6]推荐使用NRS 2002评分和危重症患者营养风险评分(NUTRIC评分),因为这两种评分是营养状况和疾病相结合的一种评估工具[7]。指南中对大手术后的营养治疗方案的建议是:可耐受肠内营养的患者应在术后24 h内开始行肠内营养治疗。对于消化道大手术后不能行肠内营养治疗的患者,若预计禁食时间超过1周者,应在术后第5~7天开始进行肠外营养治疗。在大手术后,相对于肠外营养,肠内营养能促使肠蠕动、改善门静脉循环、调整肠道微生态、维护肠黏膜屏障,继而减少术后的并发症,加速患者的康复[8]。因此,在患者病情允许的前提下,应尽早进行肠内营养治疗。由于本例患者接受的是空肠造瘘术,造瘘口近端肠管消化吸收功能有限,术后早期主要行肠外营养治疗。经过1个月的静脉抗结核及营养支持治疗,复查胸部CT见肺结核病灶有吸收,提示抗结核治疗有效。在观察无异常腹部症状和体征,辅助检查未见肠瘘、腹腔感染等征象,预估肠结核穿孔部位已经修复、稳定后,将胃管经造瘘口置入远端小肠行肠内营养治疗。考虑到肠内营养的部位是空肠远端的下消化道,消化吸收能力不足,笔者选用的肠内营养剂为短肽型肠内营养混悬液(百普力)。短肽型肠内营养混悬液是以乳清蛋白水解物为氮源的一种肠内营养剂,经过少量消化过程即可吸收,适宜于代谢性胃肠道功能障碍患者[9]。在调整为肠内营养治疗后,患者营养状况逐步改善。同时,由于喉结核致吞咽困难而减少经口进食,造瘘口近端肠液分泌减少,电解质紊乱状况也得到改善。
肠造瘘术,尤其是小肠造瘘术必然会导致参与有效消化吸收的肠道减少,使主要经肠道吸收的口服抗结核药物无法达到有效的血药浓度,因此,临床上只能采用静脉用药,期望能保障治疗效果。由于一线抗结核药物中PZA、EMB没有静脉制剂,标准的口服四联治疗方案无法通过静脉给药途径实施,目前也没有静脉抗结核治疗方案的指南和共识,静脉用药全凭个人经验。在WHO《耐药结核病治疗指南(2016年更新版)》中,氟喹诺酮类及氨基糖苷类药物是被推荐作为A、B组的核心抗结核药物,其强大的抗结核作用已得到充分的肯定[10]。因此,笔者制定静脉抗结核治疗方案的原则是将一线抗结核药物中的RFP、EMB作为核心药物,与氟喹诺酮类药物(Lfx、Mfx)及氨基糖苷类药物[链霉素(Sm)、Am]中各选取一种药物组成四联静脉治疗方案,在患者可以耐受的前提下足量给药。本例患者为肺结核血行播散致全身多发结核,肠穿孔腹腔污染严重,术后在上述四联用药的基础上加用Amx-Clv,兼顾强化抗结核和抗感染治疗。经过4个月的治疗,患者肺结核病灶逐步吸收,肠结核穿孔修复、稳定,证实该静脉用药方案是安全、有效的。目前,没有临床研究证实抗结核药物静脉给药的疗效优于口服,也没有关于静脉抗结核治疗方案的系统性研究,本例患者采用的静脉抗结核治疗方案是在特定情况下的一种无奈的选择。由于标准的口服四联抗结核药物治疗方案具有经济、方便、有效等优点,尤其是PZA、EMB在结核感染早期具有很好的治疗效果,且可以减少耐药结核病的发生。因此,静脉给药只是一种被迫的短期“替代方案”,在患者完成消化道重建手术且胃肠道功能恢复后,应尽早恢复口服治疗方案。
血行播散性肺结核是一种严重的全身性结核病,约1/2患者并发有肺外结核,在其临床评估和诊疗过程中,除了要求结核科医生需具备较强的综合能力外,往往需要多个学科共同协作,本例患者就是一个典型的个案,其治疗过程涉及到结核科、胃肠外科、营养科、耳鼻喉科等多个学科。因此,从疾病的临床特点来看,将多学科诊疗模式(MDT)应用于结核病的治疗是一种极具前景的尝试。2017年世界防治结核病日主题是“Unite to end TB:Leave no one behind”,就是要求全人类联合起来消除结核病,从科学技术层面而言,其中的重要内涵就是多学科协作[11]。目前,中华医学会2018年结核MDT病例荟萃讨论活动正在全国如火如荼地开展,其在结核病诊疗中起到的积极作用值得期待。

