细胞因子基因多态性与肺结核并发糖尿病易感性的相关性研究
董斯佳 袁立 陈诚 蒋伟利 赵琦
结核病(tuberculosis,TB)是由结核分枝杆菌引起的一种慢性感染性疾病,世界卫生组织(WHO)[1]2017年全球结核病报告指出,2016年全球新发结核病1040万例,约160万例死亡,是世界范围内第九大死因,也是单一传染因素的首要原因。糖尿病(diabetes mellitus,DM)是一组由遗传和环境等因素共同作用导致的慢性代谢性疾病,其特点是慢性的高血糖伴发碳水化合物、脂肪和蛋白质代谢紊乱。研究表明,两病的发生、发展和转归存在密切联系[2-3],TB并发DM(tuberculosis and diabetic mellitus,TB-DM)已成为威胁人类生命和健康的重大卫生问题[4]。由于TB和DM的发生均与遗传因素有关,探索遗传因素在TB-DM发病机制中的作用能够为今后开展基于TB-DM高危人群的基因遗传筛查和预防TB-DM的发生有重要意义[5]。既往研究显示,许多基因均被证明与TB和DM的易感性存在关联,其中白细胞介素 10(IL-10)和γ-干扰素(IFN-γ)受到广泛关注[6-10];但与共患疾病相关基因多态性及其差异的报道较少,目前涉及的包括人类淋巴细胞抗原(HLA)基因、Toll样受体4(TLR4)、IL-10等[11]。本研究以肺结核(pulmonary tuberculosis,PTB)并发DM(pulmonary tuberculosis and diabetic mellitus,PTB-DM)患者、PTB患者、DM患者为研究对象,通过选取与PTB和DM易感性相关、关注较多的IFN-γ和IL-10作为候选基因,研究其与疾病共患易感性的关系,探索PTB-DM发病的危险因素和发病机制。
对象和方法
一、研究对象
1.一般情况:采取目的性抽样方法,抽取华东地区江苏省内徐州市下辖的新沂市和睢宁县、南京市鼓楼区作为研究现场,选取2013年4月1日至2014年3月31日间上述研究现场TB防治定点机构新诊断登记的142例涂阳PTB-DM患者(PTB-DM 组),并同期选取新诊断的147例PTB患者(PTB组)、141例DM患者(DM组)作为对照,共计430例纳入研究。142例PTB-DM患者中,男95例(66.90%)、女44例(33.10%),性别缺失3例,平均年龄为(50.22±18.86)岁;147例PTB患者中,男102例(69.39%)、女45例(30.61%),平均年龄为(49.58±19.40)岁;141例DM患者中,男96例(68.09%)、女45例(31.91%),平均年龄为(53.00±16.15)岁。三组间年龄(F=1.422,P=0.242)和性别(χ2=0.064,P=0.969)比较,差异均无统计学意义,组间具有可比性。
2.患者纳入标准: (1) PTB诊断依据《WS 288—2008 肺结核诊断》标准[12],结合实验室细菌学检查 (痰涂片萋-尼染色镜检)、胸部影像学检查、流行病学资料、临床表现,以及必要的辅助检查进行综合分析。本研究纳入者均为涂阳PTB患者。(2) 诊断DM时,所有患者在治疗前均检测空腹血糖,若空腹血糖≥7.0 mmol/L则进一步行糖化血红蛋白(glycosylated hemoglobin,GHb)检测,若GHb≥6.5%则确诊为DM。
3.患者排除标准:(1)所有患者均排除自身免疫性疾病、肝肾疾病、过敏性疾病、肿瘤等。(2)近3个月来罹患肺炎,或者服用糖皮质激素、利尿剂等特殊药物,或抽取静脉血当日体温超过38.5 ℃者均不入组。
二、研究方法
1.问卷调查:采用统一自行设计的调查表[13],由经过培训的调查员填写并每个月对收集的调查问卷进行现场质量控制。内容包括调查对象的一般人口学特征(包括性别、年龄等)、社会特征、经济学信息(包括受教育程度、经济状况等)、慢性病病史(特别是DM病史及家族史等),以及DM相关危险因素调查(如饮食、运动习惯等);PTB患者另附调查相关就诊经历、治疗经历;DM患者另附DM诊疗经历等信息收集表。共计发放问卷430份,回收430份,有效问卷430份。
2.基因组DNA提取:经研究对象知情同意后,采集外周静脉血5 ml,置于抗凝管中,采用1 ml血液基因组DNA提取试剂盒(上海莱枫生物科技有限公司),按照说明书方法提取DNA,于-80 ℃深低温冰箱冻存。
3.IFN-γ和IL-10单核苷酸多态位点(SNP)选择:参考已有文献报道[6-9, 11]的与PTB-DM、DM、TB易感性均存在关联的功能性SNP位点,最终将IFN-γ +874A/T、IL-10 -592A/C、IL-10 -1082G/A纳入研究。
4.PCR扩增:采用上海生工生物工程公司PCR扩增试剂盒,引物序列由上海生工生物公司合成。IFN-γ+874A/T上游为5′-AAAACAGCAAAGCCACCC-3′,下游为5′-TTTTATTCTTACAACACAAAATCAGA-3′;IL-10 -592A/C上游为5′-TCCAGCCACAGAGCTTACAAC-3′,下游为5′-AGGTCTCTGGGCCTTAGTTTCC-3′;IL-10 -1082G/A上游为5′-CCAAGACAACACTACTAAGGCTCCTTT-3′,下游为5′-GCTTCTTAT-ATGCTAGTCAGGTA-3′。PCR反应总体积为15 μl,其中DNA 0.5 μl、上游引物0.2 μl、下游引物0.2 μl、预混液(Mix) 3.1 μl、水(dH2O)11 μl。PCR反应条件:95 ℃预变性5 min、变性30 s,68 ℃退火45 s,72 ℃延伸45 s;共20个循环,每次-0.5 ℃。随后再进行20个循环反应(每个循环包括95 ℃ 30 s、58 ℃ 30 s、72 ℃ 40 s、72 ℃ 6 min),最后72 ℃延伸6 min。
5.限制性片段长度多态性(restriction fragment length polymorphism,RFLP) 鉴定:扩增产物分别用Bg1Ⅱ(IFN-γ+874A/T)、RsaⅠ(IL-10 -592A/C)、EcoNⅠ(IL-10 -1082G/A)限制性内切酶进行酶切,酶切产物经2%琼脂糖凝胶电泳检测(图1),根据电泳图中条带的数目判断基因型。各基因位点分型标准:IFN-γ +874A/T位点基因型分别为AA(182 bp)、AT(182 bp、161 bp、21 bp)、TT(161 bp、21 bp),IL-10 -592A/C位点基因型分别为AA(236 bp、176 bp)、AC(412 bp、236 bp、176 bp)、CC(412 bp),IL-10 -1082G/A 位点基因型分别为GG(253 bp、97 bp、27 bp)、GA(280 bp、253 bp、97 bp、27 bp)、AA(280 bp、97 bp)。

依上至下分别为 IFN-γ+874A/T、IL-10 -592A/C、IL-10 -1082G/A 位点的酶切结果电泳图,各图中位置9为Marker图1 基因多态性位点酶切结果电泳图
三、统计学处理
采用Hard-Weinberg 遗传平衡检验数据,以明确群体是否具有遗传平衡,若符合遗传平衡则证明本次研究所选对象基因和基因型频率没有发生迁移、突变和选择,样本来自遗传平衡状态的人群,符合大群体中基因频率和基因型频率的遗传规律,群体的遗传性能相对稳定,具有一定代表性。

采用在线分析软件SHEsis(http://analysis.bio-x.cn/myAnalysis.php)对IL-10 -592A/C和-1082G/A位点之间进行连锁不平衡分析,以说明某些组合单倍型在遗传适应性上具有优势,以P<0.05表示SNP之间存在连锁不平衡,以相对大小D′和相关系数r2表示SNP之间存在的连锁不平衡程度[14],但由于SHEsis在线软件进行单倍型分析时,有些单倍型的频率非常低,很有可能会影响分析结果而产生偏差,故本研究将最低频率阈值设定为0.03,所有频率低于0.03的单倍型其分布差异不予分析;并用该软件进一步分析IL-10 -592A/C和-1082G/A位点单倍型与PTB-DM易感性的相关性。
结 果
一、基因多态性位点分型鉴定结果
IFN-γ+874A/T、IL-10-592A/C、IL-10-1082G/A位点经PCR扩增和基因多态性位点分型鉴定,获得本次研究对象等位基因(分别为A、T,A、C、G、A)和基因型(分别为AA、AT、TT,AA、AC、CC、GA、AA)的构成情况,为后续共患疾病易感性相关性的分析提供等位基因和基因型范围。各组IL-10 -1082G/A位点可能的基因型有GG、GA、AA等3种,但GG基因型在3个组的研究对象中均未检测到。
二、Hard-Weinberg 遗传平衡检验
对3个组研究对象各位点基因型分布进行Hard-Weinberg 遗传平衡检验,显示IFN-γ+874A/T位点上PTB组不符合Hard-Weinberg遗传平衡(χ2=6.700,P=0.009),而DM组和PTB-DM组该位点上均符合遗传平衡(P值均>0.05);IL-10 -592A/C和IL-10 -1082G/A位点上3个组均符合Hard-Weinberg遗传平衡(P值均>0.05),见表1。
三、单个SNP位点与PTB-DM易感性相关性分析
1.各位点等位基因频率与PTB-DM易感性相关性分析:3个组的研究对象在IFN-γ +874A/T、IL-10 -592A/C、IL-10 -1082G/A等3个位点的A等位基因频率差异均无统计学意义(P值分别为0.750、0.135、0.130)。进一步两两比较,在IFN-γ +874A/T和IL-10 -592A/C 2个位点上,PTB-DM组和PTB组、PTB-DM组和DM组之间等位基因频率比较,差异均无统计学意义(P值均>0.05);在IL-10 -1082G/A位点上,PTB-DM组和PTB组A等位基因频率比较,差异无统计学意义(P=0.146),而PTB-DM组和DM组等位基因频率差异有统计学意义(P=0.046),见表2。

表1 各位点基因型在不同组中的Hard-Weinberg检验情况
注预期频数为根据平衡公式求得的平衡状态时的理论频数,观察频数为样本中实际频数,可能会出现基因位点检测不到,导致频数少于患者例数。理论值与实际值完全一致时,认定为平衡群体;如不一致,则通过卡方检验判断其在两组间的分布是否有差异,以P>0.05界定来自平衡群体
2.各位点基因型频率与PTB-DM易感性相关性分析:在IFN-γ +874A/T、IL-10 -592A/C、IL-10 -1082G/A 3个位点上,三组间的基因型频率差异均无统计学意义(P值均>0.05),详见表3。
3.logistic回归分析:校正年龄和性别对结果的影响后,在PTB-DM组与PTB组、PTB-DM组与DM组间,以是否发生共患为因变量,以各种基因模型为自变量,对PTB-DM组与PTB组、DM组位点基因型频率分别进行logistic回归分析。结果显示,PTB-DM组与PTB组的IFN-γ +874A/T、IL-10 -592A/C、IL-10 -1082G/A位点基因型频率的差异均无统计学意义;PTB-DM组与DM组间IFN-γ +874A/T、IL-10 -592A/C位点基因型频率差异无统计学意义,但与IL-10 -1082G/A位点基因型频率差异存在统计学意义,在DM组患者中,基因型为AA的患者发生PTB-DM的风险是基因型为GA患者的 1.970倍(aOR=1.970;95%CI: 1.066~3.643),见表4。
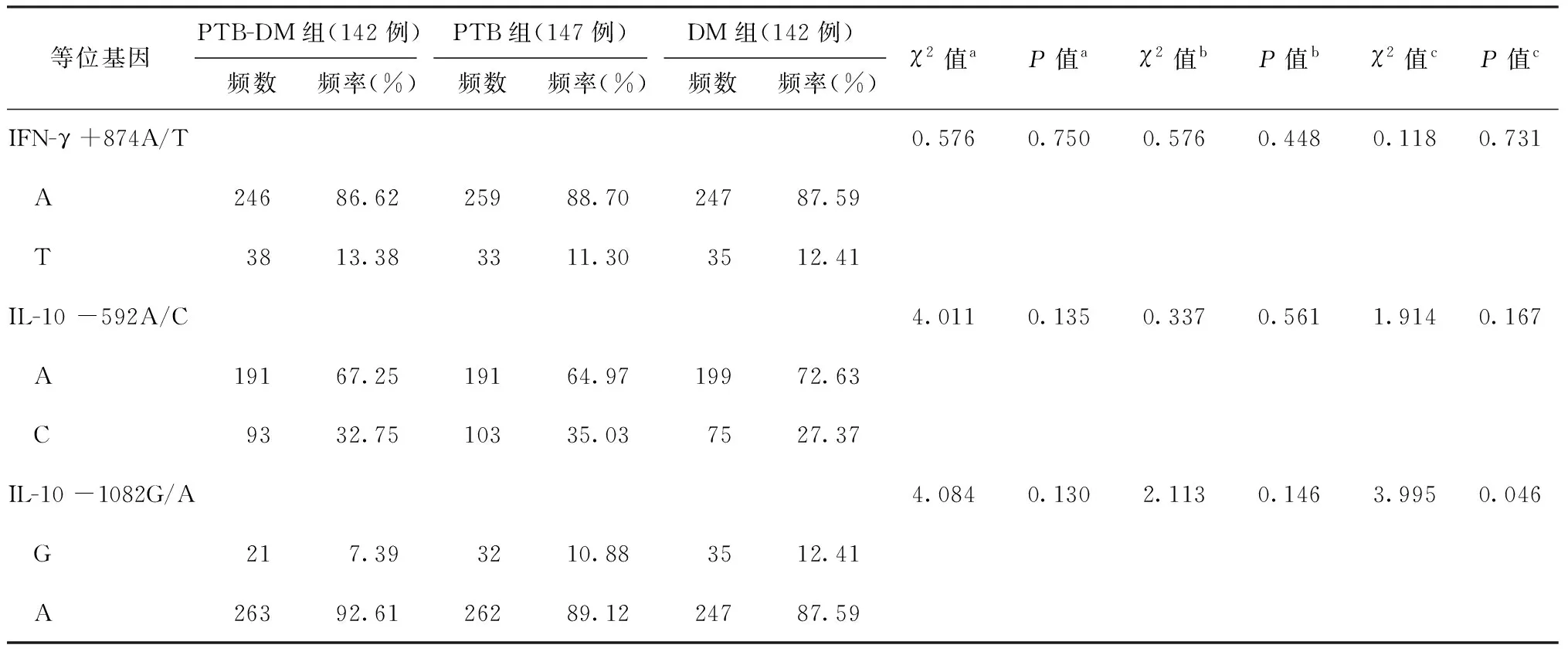
表2 研究对象各类等位基因在各组中发生频率的比较
注a:PTB-DM 组、PTB 组、DM 组三组比较;b:PTB-DM 组与 PTB 组比较;c:PTB-DM 组与 DM 组比较

表3 研究对象各类基因型在各组中发生频率的单因素分析

表4 研究对象各类基因型在各组中发生频率的多因素logistic回归分析
注表中“-”为无检验数据
四、基因内多态性位点之间的关联情况
1.连锁不平衡分析结果:在PTB-DM组及PTB组、DM组中,IL-10 -592A/C和IL-10 -1082G/A位点间存在连锁不平衡(D′=0.959,r2=0.181,P<0.001)。
2.单倍型分析结果:运用单倍型分析软件估计IL-10 -592A/C和IL-10 -1082G/A位点单倍型频率,并分别比较PTB-DM组和PTB组、PTB-DM组和DM组之间单倍型频率分布,结果显示,本次研究人群中,IL-10 -592A/C和IL-10 -1082G/A位点共存在4种单倍型,分别为A-A、A-G、C-A、C-G,在3个组中的出现频率均超过3%的单倍型组合(组内频率>0.03)为A-A、C-A、C-G;A-G可能低于最低频率阈值0.03,本研究中不予分析其分布差异。
PTB-DM组、PTB组、DM组的A-A、C-A、C-G单倍型频率分布详见表5、6,PTB-DM组和PTB组的3种单倍型频率差异均无统计学意义;PTB-DM组和DM组的A-A、C-G单倍型频率差异也均无统计学意义,但C-A单倍型频率差异有统计学意义。
讨 论
研究表明,TB患者罹患DM的可能性比正常人群更高,可导致TB病情迁延不愈,传染性难以控制,严重威胁公共卫生安全和人群健康;而DM患者对TB的易感性也大大增加,共患可使DM患者病情加重,血糖控制难度增加,并发症风险增高,显著增加了糖尿病的医疗负担和社会经济成本[2-3]。故认为DM患者是预防TB发生的重要靶向人群,在DM患者中积极预防TB的发生,一方面可以在一定程度上减缓TB疫情的发展和蔓延,另一方面也有利于降低DM和TB的病死率[4]。本研究通过研究IFN-γ和IL-10基因位点多态性与PTB和DM易感性的关系,了解遗传因素在疾病共患机制中的作用,为日后基于基因多态性的共患高危人群筛查提供科学依据。

表5 IL-10 基因单倍型频率在PTB-DM组与PTB组间的比较
注“频数”为频率×总体个数得到的预期数,为软件估算得到;“-”指A-G可能低于最低频率阈值0.03,本研究中不予分析其分布差异

表6 IL-10 基因单倍型频率在PTB-DM组与DM组间的比较
注“频数”为频率×总体个数得到的预期数,为软件估算得到;“-”指A-G可能低于最低频率阈值0.03,本研究中不予分析其分布差异
一、细胞因子基因单个SNP位点与PTB-DM易感性的相关性分析
基因位点多态性是由于等位基因之间在特定的位点上DNA序列存在差异,即基因组中散在碱基不同,单个碱基的置换又称为SNP,是基因多态性的一种形式[15]。IL-10是一类重要的免疫调节细胞因子,主要由活化的T细胞、单核细胞、B细胞和胸腺细胞产生。既往针对IL-10基因位点多态性与疾病易感性的研究结果显示,IL-10的-1082G/A位点、-819C/T位点和 -592A/C位点被证明与多种疾病有关,如肝硬化[16]、甲状腺癌[17]、白血病[18]等,当然也包括TB和DM。但目前针对PTB-DM的基因位点多态性的研究尚十分稀少,仅有Garcia-Elorriaga 等[19]在2013年对21例PTB-DM患者、77例TB患者和60名健康对照者进行IL-10 -1082G/A位点和-592C/A位点的基因型检测后发现,PTB-DM患者的IL-10 -592AA和IL-10 -592CC 基因型频率均明显高于健康对照者,而IL-10 -1082GG低于健康对照者,提示IL-10基因多态性可能与PTB-DM易感性有关。但该研究样本量过小、健康对照定义不够明确、对照组的年龄与患者组并不匹配等,导致结论的科学性较局限。
本次研究发现,IL-10 -1082G/A位点等位基因和基因型频率分布在PTB-DM患者及DM患者中差异均有统计学意义,PTB-DM组-1082G/A位点A等位基因频率高于DM组,其AA基因型在PTB-DM患者中的频率明显高于DM患者,该位点表现为AA基因型的DM患者对于TB的易感性是表现为GA基因型患者的1.970倍 (95%CI: 1.066~3.643),提示IL-10 -1082位点的AA基因型可能与PTB-DM易感性有关,为疾病共患的危险因素。同时,PTB-DM与DM患者相比,IL-10 -592A/C位点等位基因频率和基因型频率差异均无统计学意义,提示在DM患者中,IL-10 -592A/C位点的SNP可能与其易感TB无关;PTB-DM患者与PTB患者相比,IL-10 -1082G/A位点、IL-10 -592A/C位点的等位基因频率和基因型频率差异也均无统计学意义,提示在PTB患者中,IL-10 -1082G/A位点、IL-10 -592A/C位点的SNP可能与其易感DM无关。以上阴性结果与Garcia-Elorriaga等[19]的研究结果不一致,该研究报道了共患患者和健康人群间的SNP和易感性的关联,而本研究侧重的是共患患者分别与PTB、DM之间的关联,可能是关注点的不同导致了一些结果上的差异;还可能与样本量大小、研究人种、研究对象的选择、实验方法的不同有关,有待下一步更大样本的研究进一步证明。另外,本研究中只对年龄和性别进行了控制,未对更多相关因素进行考虑,该局限性可能导致基因多态性与疾病易感性之间的相关性产生一定偏移。本研究未对不同类别糖尿病进行入组限制,由于我国90%为Ⅱ型糖尿病患者[20],故本研究结论适用于肺结核并发Ⅱ型糖尿病患者人群,对其他人群的外推性受到一定程度限制。
IFN-γ是另一类在机体免疫过程中扮演重要角色的细胞因子,对于调节结核分枝杆菌感染后机体的固有免疫和适应性免疫有重要作用。在既往研究中,IFN-γ +874A/T位点和CA repeats 12/non-12位点均被证明与多类疾病易感性有关,其中包括TB和DM。在西班牙[21]、南非[22]、中国[23]患者中,IFN-γ +874A/T位点的AA基因型均被证明增加了罹患TB的风险;在波兰[24]儿童、 希腊[25]患者中IFN-γ +874A/T位点的A等位基因被证明是DM的易感因素,但既往尚无针对PTB-DM患者的相关基因多态性研究。本次研究中,创新性地探索了IFN-γ +874A/T位点与PTB-DM易感性是否存在相关性。结果显示,IFN-γ +874A/T 位点的等位基因频率和基因型分布在PTB-DM组、PTB组、DM组中差异均无统计学意义,提示IFN-γ +874A/T位点可能与DM患者易感TB无关,也与TB患者易感DM无关。由于该位点与疾病共患易感性相关性是首次进行研究,相关文献报道较少,有待进一步大样本的研究证明。
二、细胞因子基因内位点单倍型频率与PTB-DM易感性的相关性分析
既往研究中对于复杂疾病相关基因进行定位的方法主要有两大类,一类是进行基于家系数据(即亲本到子代的数据)的多位点连锁分析,另一类则是基于人群数据的单倍型分析;当致病基因的效应相对较弱时,一般在研究中采用单倍型的关联分析[26]。本次研究发现,IL-10 -592A/C和IL-10 -1082G/A位点间存在连锁不平衡,在此基础上进一步分析IL-10单倍型与PTB-DM易感性的相关性,发现C-A 单倍型能增加DM患者共患TB的风险(OR=1.590,95%CI:1.056~2.396)。而C-A单倍型中IL-10 -1082G/A位点表现为A等位基因,也与前文基因型中相关发现一致,进一步说明了IL-10 -1082G/A位点可能与PTB-DM易感性有关。
三、共患患者IL-10 -1082G/A和-592A/C位点等位基因和基因型频率的差异
本次研究中发现,在PTB-DM患者人群中,IL-10 -1082G/A位点和-592A/C位点的等位基因和基因型频率随国家地域分布和种族不同而有所差异。在针对墨西哥人群的相关研究中,IL-10 -592A/C位点的AA基因型在PTB-DM人群中仅占5%,而CC基因型占总患者例数的52%[19];但在本次研究中,共患患者IL-10 -592A/C位点的AA基因型和CC基因型的频率分别为44.37%和9.86%,与其分布相差较大。同样,墨西哥人群中PTB-DM患者IL-10 -1082G/A位点的AA和GG基因型频率均为29%[19],而本次研究中,共患患者的AA基因型频率为85.21%,GG基因型甚至并未检测到,提示在不同人群种族中其本身的基因SNP的表现并不相同。也与此前王牡丹等[27]对我国浙南地区健康人群的IL-10基因启动子区的多态性研究结果类似。本研究未检测到GG基因考虑与人种差异有关。
综上所述,对基因多态性的研究有助于从免疫学的角度理解PTB共患DM的发生、发展规律,探索携带不同等位基因的个体对共患疾病的易感性,为早期筛查、早期治疗提供可能性。本次研究中发现的PTB-DM易感性的相关基因多态性位点尚是冰山一角,我们相信存在更多基因的SNP与两类疾病的共患易感性有关,而此类基因及其多态性尚需要更多的研究证明。

