三种细胞因子在肺结核与肺癌胸腔积液中的诊断价值
刘浩然 张亚莉 任卫聪 赵玲娟 李传友 王伟 高孟秋
结核病(tuberculosis,TB)是严重危害人类健康的主要传染病,是全球共同关注的严峻问题。WHO[1]2016年数据显示,我国肺结核发病例数位居世界第三。肺结核的临床确诊依赖于细菌学的检测,如痰涂片及痰培养等,但临床上菌阴肺结核患者的比例较高。菌阴肺结核患者的临床诊断目前主要依赖于影像学表现、临床症状及血清标志物水平的变化等进行综合评价[2]。肺癌是发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一,是中国乃至全世界最常见的恶性肿瘤及首位的癌症死亡原因。肺癌的临床诊断主要依赖于穿刺活检、痰脱落细胞等病理学相关检测,但在临床上有时很难得到病理学证据这一肺癌诊断的金标准,使肺癌的诊断变得更加困难,导致肺癌与肺结核常难以鉴别[3]。在区分结核性胸腔积液及肺癌性胸腔积液时,其诊断仍主要依赖于胸腔积液中的细菌学及病理学证据,依旧存在着检出率低、敏感度低等问题。可见进一步探索、发现可以有效区分肺结核及肺癌的生物学标志物就显得尤为重要。
巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)是一种多功能的细胞因子,在肺结核中MIF具有抑制巨噬细胞游走、调节固有免疫反应等多种功能,发挥重要的抗结核作用[4];在肺癌中MIF对肺癌细胞的增殖及凋亡产生重要的影响,在肺癌的进展中发挥诸多调节作用[5]。维甲酸相关孤儿核受体α(RAR-related orphan receptor alpha,RORα)及维甲酸相关孤儿核受体γ(RAR-related orphan receptor gama,RORγ)是孤儿核受体家族中的重要成员,二者可以结合DNA并参与到转录活性的调控中,调节细胞的生长发育,同时在机体抗结核的免疫反应中发挥多种调控作用[6-8]。
机体在受到结核分枝杆菌感染后,巨噬细胞会产生并分泌MIF,发挥一定的抗结核作用。 Das 等[9]的研究证实了MIF在机体抗结核的免疫反应中发挥着重要的免疫调节作用,以及杀菌抑菌作用。另有一些研究发现,MIF在肺癌患者肺组织中的过度表达能够增强癌细胞的活性,这可能与肿瘤的演化进展密切相关[10-11]。可见,MIF在不同疾病状态下发挥着不同的作用,其表达水平也很可能存在着一定差异。同样有研究发现[12],RORα及RORγ在肺结核与肺癌中存在着转录水平上的表达差异。
可见MIF、RORα及RORγ在肺结核及肺癌患者中均有表达,而3种细胞因子在肺结核和肺癌患者之间的表达水平可能存在着一定差异。本次研究笔者检测了肺癌和肺结核患者胸腔积液中上述3种蛋白的水平,探索3种细胞因子在肺结核与肺癌患者胸腔积液中的表达情况,从免疫学的角度对3种细胞因子进行比较分析,并且评价了各自在肺结核及肺癌鉴别诊断中的价值。
材料和方法
1. 研究对象:所有纳入研究患者的样本均为冻存胸腔积液,全部取自北京胸科医院,具有完整的患者病历资料。查阅2010年至2018年病历资料,对所有确诊为继发性肺结核及肺癌患者的胸腔积液样本进行编号,通过简单随机抽样[13],选取肺结核及肺癌患者胸腔积液标本各80例。其中,肺结核组男51例(63.75%)、女29例(36.25%),年龄范围18~81岁、平均年龄(46.90±20.03)岁;肺癌组男59例(73.80%)、女21例(26.30%),年龄范围29~83岁、平均年龄(60.84±11.72)岁(表1)。两组间性别构成比较,差异无统计学意义(χ2=1.86,P>0.05);肺结核组与肺癌组患者的年龄分布比较,差异有统计学意义(t=5.37,P<0.01),肺癌组年龄分布高于肺结核组。

表1 患者一般特征在两组中的分布
注表中括号外数值为“患者例数”,括号内数值为“构成比(%)”
2. 样本量估算:通过预试验结果进行样本量的估算,使用两独立总体样本量估算公式进行计算[13],得到两组最低纳入样本量为46例,为保证本研究的科学性,故将各组纳入样本例数定位80例。
3. 纳入标准:(1)肺结核组。痰细菌学检测结果阳性,包括痰涂片阳性或痰培养阳性,并且符合临床肺结核诊断标准[14],同时患者具有胸腔积液。(2)肺癌组。有肺癌的病理学证据,并且符合肺癌的临床诊断标准[15],同时患者具有胸腔积液。
4. 排除标准:所有患者均排除患有自身免疫性疾病、肝肾疾病、过敏性疾病等。同时排除采样时3个月内患过肺炎或服用特殊药物(如糖皮质激素等)者。
5. 检测方法:所有胸腔积液标本室温解冻后离心取上清,采用双抗体夹心酶联免疫吸附试验(ELISA)检测标本中的MIF、RORα及RORγ浓度。采用武汉华美生物工程的ELISA试剂盒。

结 果
1. 两组患者胸腔积液中MIF、RORα及RORγ检测水平的比较:肺结核组患者胸腔积液MIF、RORα及RORγ检测水平[M(Q1,Q3)]分别为5.83(2.41,16.43)、0.63(0.37,1.66)和3.23(1.82,5.26) ng/L;肺癌组患者胸腔积液MIF、RORα及RORγ检测水平分别为2.79(0.91,11.12)、0.63(0.57,2.16) 和3.44(1.94,7.11) ng/L(表2)。各组数据不符合正态分布,采用非参数检验(Mann-WhitneyU检验)。肺结核组患者胸腔积液MIF检测水平[5.83(2.41,16.43) ng/L]高于肺癌患者组[2.79(0.91,11.12) ng/L],差异有统计学意义(U=2314.50,P<0.01)。但胸腔积液中RORα及RORγ检测水平在两组之间比较,差异无统计学意义(U值分别为3525.00、3431.50,P值均>0.05)。3种细胞因子的表达水平散点图具体见图1。
2. 受试者工作特征曲线(ROC曲线)分析:采用ROC曲线分析鉴别诊断结核性和肺癌性胸腔积液的最佳界值,通过检测胸腔积液中MIF水平的ROC曲线下面积为0.64,具有一定的诊断价值(图2)。当尤登指数(敏感度+特异度-1)[13]取最大值0.28时,MIF水平的鉴别诊断结核性与肺癌性胸腔积液的界限值为2.01 ng/L,此时敏感度为82.50%、特异度为45.00%。
讨 论
肺结核及肺癌均是威胁人类生命健康的严重公共卫生问题,两者的临床表现有时难以区分。两种疾病均可使患者产生胸腔积液,而胸腔积液成分的差异可以对区分两种疾病起到一定的提示作用。
本研究发现MIF在结核性胸腔积液中的水平要高于肺癌性胸腔积液,并且胸腔积液中的MIF水平可以在一定程度上辅助对两种疾病进行鉴别诊断,但其不足在于诊断效能仍较低,敏感度及特异度均不高,具有一定的鉴别诊断价值。为进一步提高其诊断效能,可以将胸腔积液中MIF的表达水平与其他已有意义于临床的血清学生物标志物进行联合分析,构建新的联合诊断模型,这可能有助于提高诊断的敏感度及特异度。
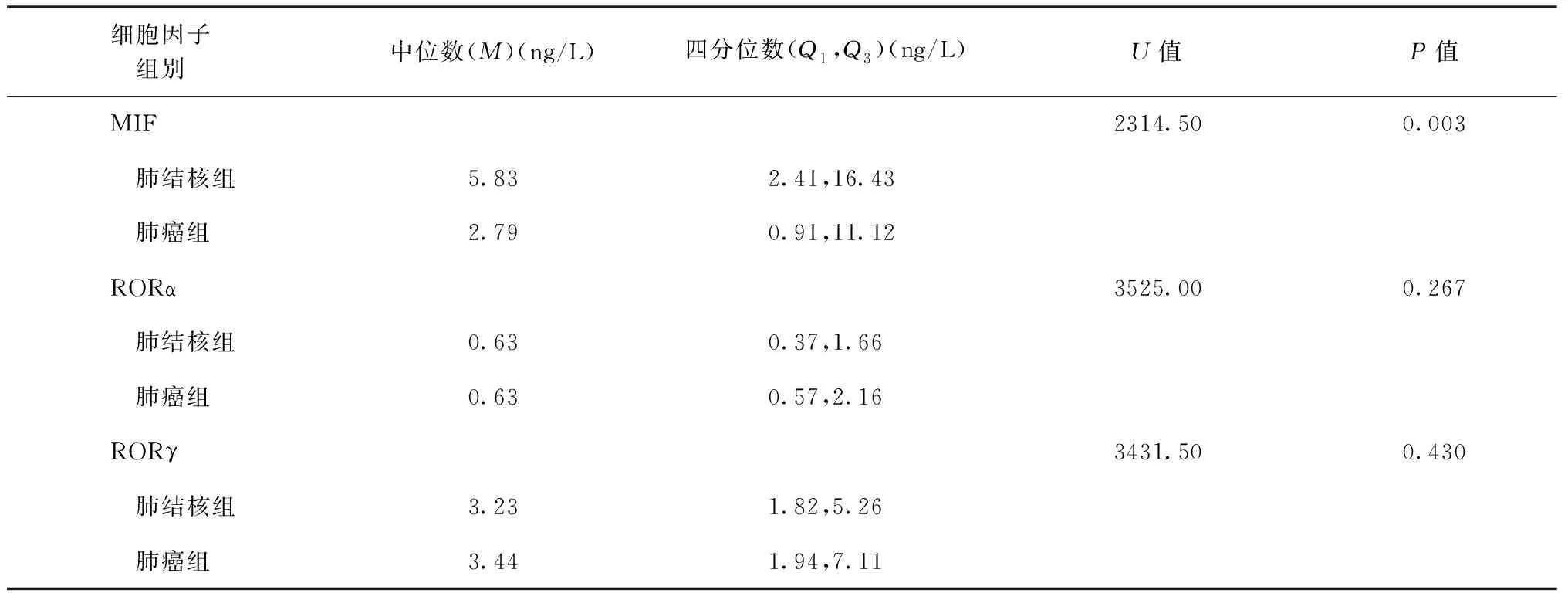
表2 肺结核及肺癌患者胸腔积液中MIF、RORα和RORγ检测水平的比较
注各组数据不符合正态分布,采用非参数检验(Mann-WhitneyU检验)
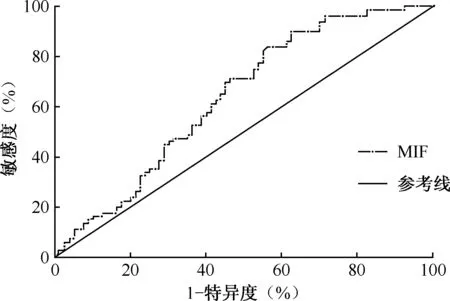
图2 胸腔积液检测MIF表达水平鉴别诊断肺结核及肺癌的ROC曲线
Espósito等[12]研究发现,结核性胸腔积液中RORα及RORγ的转录水平较肺癌性胸腔积液中的水平高。而在本研究中,通过ELISA方法检测两种疾病胸腔积液中的RORα及RORγ的蛋白水平并未发现差异有统计学意义。虽然两种受体在转录水平上有差异,但在蛋白水平上可能尚未发生明显变化。本次实验中,在两组患者的胸腔积液中均检测出了较低水平的RORα及RORγ表达,这可能是由于胸腔积液中巨噬细胞或肿瘤细胞的死亡及破裂,使两种核受体游离到胸腔积液中而被检测到。另外,改进实验方法,如裂解胸腔积液中的细胞后再进行上述细胞因子的检测等,可能有助于提高检测结果的敏感程度,但仍需进一步在转录水平进行验证分析。
综上所述,肺结核患者胸腔积液中的MIF水平较肺癌患者更高,胸腔积液中MIF的水平在一定程度上有助于对肺结核与肺癌患者进行鉴别诊断;而两组患者胸腔积液检测RORα及RORγ的结果差异无统计学意义,仍有待做进一步的研究。但本研究样本量较少,并且没有进行转录水平等其他层面的验证分析,在一定程度上对结果的精确性可能产生影响,有待进一步做更大样本和更深入的研究。

