单核细胞HLA-DR和CD16检测在炎症性疾病中的应用价值
章黎华,王维维,张 良,沈立松
(1. 上海交通大学医学院附属新华医院检验科,上海 200092;2. 上海交通大学医学院附属新华医院泌尿外科,上海 200092)
炎症反应是临床常见的疾病过程,感染、损伤、自身免疫性疾病等都会发生或伴有一定程度的炎症反应。单核细胞作为机体免疫防御系统的主要成员之一,能够吞噬入侵体内的异物和病原微生物,释放多种细胞因子,并参与抗原提呈、免疫调节等过程,在固有免疫应答中发挥着重要作用[1]。表达于单核细胞上的人白细胞抗原-DR(human leukocyte antigen-DR,HLA-DR)属于主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子,能将抗原提呈给辅助性T细胞,诱导适应性免疫应答的启动[2]。CD16为IgG Fc段受体分子,属于免疫球蛋白超家族成员。相对于CD16-单核细胞,CD16+单核细胞分泌肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)等促炎因子的能力较强,与感染和炎症性疾病的发病过程密切相关[3]。本研究拟分析炎症性疾病患者单核细胞HLA-DR、CD16表达与其他白细胞指标的相关性,以评估单核细胞HLA-DR和CD16诊断炎症性疾病的价值。
1 材料和方法
1.1 研究对象
选取2017年3—7月上海交通大学医学院附属新华医院诊断为炎症性疾病的患者56例,其中男33例,女23例,年龄(60.05±13.56)岁,包括肺炎(肺部感染)36例、支气管炎3例、胸膜炎3例、脓胸2例、脓毒血症5例、泌尿道感染5例、急性胃肠炎1例,化脓性脊柱炎1例。另选取同期上海交通大学医学院附属新华医院体检健康者40名作为正常对照组,其中男23名,女17名,年龄(58.92±11.36)岁,排除血常规、血糖、血脂、肝功能及肾功能异常者。2个组年龄和性别差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 样本采集 采集炎症性疾病患者疾病发作期空腹静脉血2~3 mL,采集正常对照组体检当日空腹静脉血2~3 mL,均采用肝素抗凝。
1.2.2 单核细胞HLA-DR和CD16检测 将50 μL抗凝全血与抗人CD14抗体-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、抗人HLA-DR抗体-莲红蛋白(phycoerythrin,PE)(美国Beckman-Coulter公司)和抗人CD16抗体-多甲藻黄素-叶绿素-蛋白质复合物 花青苷5.5(peridinin-chlorophyllprotein complex cyanin5.5,PerCP Cy5.5)(美国BD公司)各5 μL充分混匀,避光共同孵育15 min。取出孵育完成的样本,加入1 mL红细胞裂解液[0.15 mol/L NH4Cl、10 mmol/L NaHCO3、1 mmol/L乙二胺四乙酸二钠(ethylenediaminetetraacetic acid-Na2,EDTANa2)],待红细胞充分裂解后,在FACSCantoⅡ六色流式细胞仪(美国BD公司)上进行检测。采用相同的检测电压和荧光补偿,通过CD14和侧向散射(side scatter,SSC)对单核细胞进行设门,每份样本获取2 000个单核细胞,固定各阳性“门”位置,分别检测单核细胞HLA-DR、CD16表达量[用平均荧光强度(mean fluorescence intensity,MFI)表示,即HLA-DR MFI、CD16 MFI];同时检测单核细胞中的HLADR阳性细胞百分比(HLA-DR+%)、HLA-DR阳性分子MFI(HLA-DR+MFI)、CD16阳性细胞百分比(CD16+%)和阳性分子MFI(CD16+MFI)。比较各组中CD16+与CD16-单核细胞HLA-DR MFI是否存在差异。
1.2.3 白细胞各项指标的检测 采用LH750血液分析仪(美国Beckman-Coulter公司)及配套试剂检测中性粒细胞绝对数(neutrophil absolute value,NEUT#)、中性粒细胞百分数(neutrophil percentage,NEUT%)、淋巴细胞绝对数(lymphocyte absolute value,LYMPH#)、淋巴细胞百分数(lymphocyte percentage,LYMPH%)、单核细胞绝对数(monocyte absolute value,MO#)及单核细胞百分数(monocyte percentage,MO%),计算中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)。
1.3 统计学方法
采用SPSS 16.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用t检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估单核细胞HLA-DR MFI、HLA-DR+%、HLADR+MFI、CD16 MFI、CD16+%和CD16+MFI诊断炎症性疾病的价值。采用Spearman相关分析评估单核细胞HLA-DR MFI、HLADR+%、HLA-DR+MFI、CD16 MFI、CD16+%和CD16+MFI与白细胞各项指标[NEUT#、NEUT%、LYMPH#、LYMPH%、MO#、MO%及NLR]的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 炎症性疾病组与正常对照组白细胞各项指标的比较
炎症性疾病组NEUT%、NEUT#、MO#及NLR均明显高于正常对照组(P<0.01),而LYMPH#和LYMPH%均明显低于正常对照组(P<0.01)。2个组之间MO%差异无统计学意义(P>0.05)。见表1。
表1 炎症性疾病组与正常对照组白细胞各项指标的比较 (±s)

表1 炎症性疾病组与正常对照组白细胞各项指标的比较 (±s)
注:与正常对照组比较,*P<0.01
MO%(%)炎症性疾病组 56 9.68 ± 4.27* 82.25 ± 7.08* 1.04 ± 0.50* 9.83 ± 4.63* 10.79 ± 6.12* 0.77 ± 0.33* 7.02 ± 3.44正常对照组 40 3.45 ± 0.88 58.09 ± 5.94 1.93 ± 0.38 33.23 ± 6.05 1.86 ± 0.64 0.36 ± 0.09 6.09 ± 1.27组别 例数 NEUT#(×109/L)NEUT%(%)LYMPH#(×109/L)LYMPH%(%) NLR MO#(×109/L)
2.2 炎症性疾病组与正常对照组单核细胞HLADR和CD16表达的比较
炎症性疾病组单核细胞HLA-DR MFI、HLA-DR+%及HLA-DR+MFI均明显低于正常对照组(P<0.01),而单核细胞CD16 MFI、CD16+%及CD16+MFI均明显高于正常对照组(P<0.01)。见表2。
炎症性疾病组中CD16+单核细胞的HLADR MFI为2 869±1 084,明显高于CD16-单核细胞(1 121±665)(P<0.01)。正常对照组中CD16+单核细胞的HLA-DR MFI为4 801±1 822,明显高于CD16-单核细胞(3 696±1 239)(P<0.01)。
表2 炎症性疾病组与正常对照组单核细胞HLA-DR和CD16表达的比较 (±s)

表2 炎症性疾病组与正常对照组单核细胞HLA-DR和CD16表达的比较 (±s)
注:与正常对照组比较,*P<0.01
组别 例数 HLA-DR MFIHLA-DR+%(%) HLA-DR+ MFI CD16 MFI CD16+ %(%) CD16+ MFI炎症性疾病组 56 1 426 ± 733* 71.44 ± 21.15* 1 823 ± 568* 467 ± 237* 18.14 ± 13.70* 3 272 ± 1 753*正常对照组 40 3 805 ± 1 266 98.69 ± 2.12 3 838 ± 1 250 155 ± 48 9.59 ± 4.74 871 ± 256
2.3 单核细胞HLA-DR MFI、HLA-DR+%、HLA-DR+ MFI、CD16 MFI、CD16+%和CD16+MFI与白细胞各项指标的相关性分析
单核细胞HLA-DR+%、HLA-DR MFI、HLA-DR+MFI与LYMPH#、LYMPH%呈正相关(P<0.01),与NEUT#、NEUT%、NLR、MO#呈负相关(P<0.01),与MO%无相关性(P>0.05);单核细胞CD16 MFI和CD16+MFI与NEUT#、NEUT%、NLR、MO#呈正相关(P<0.01),与LYMPH#、LYMPH%呈负相关(P<0.01),与MO%无相关性(P>0.05)。单核细胞CD16+%与NEUT#、NLR、MO#、MO%呈正相关(P<0.05),与LYMPH#、LYMPH%呈负相关(P<0.05),与NEUT%无相关性(P>0.05)。见表3。
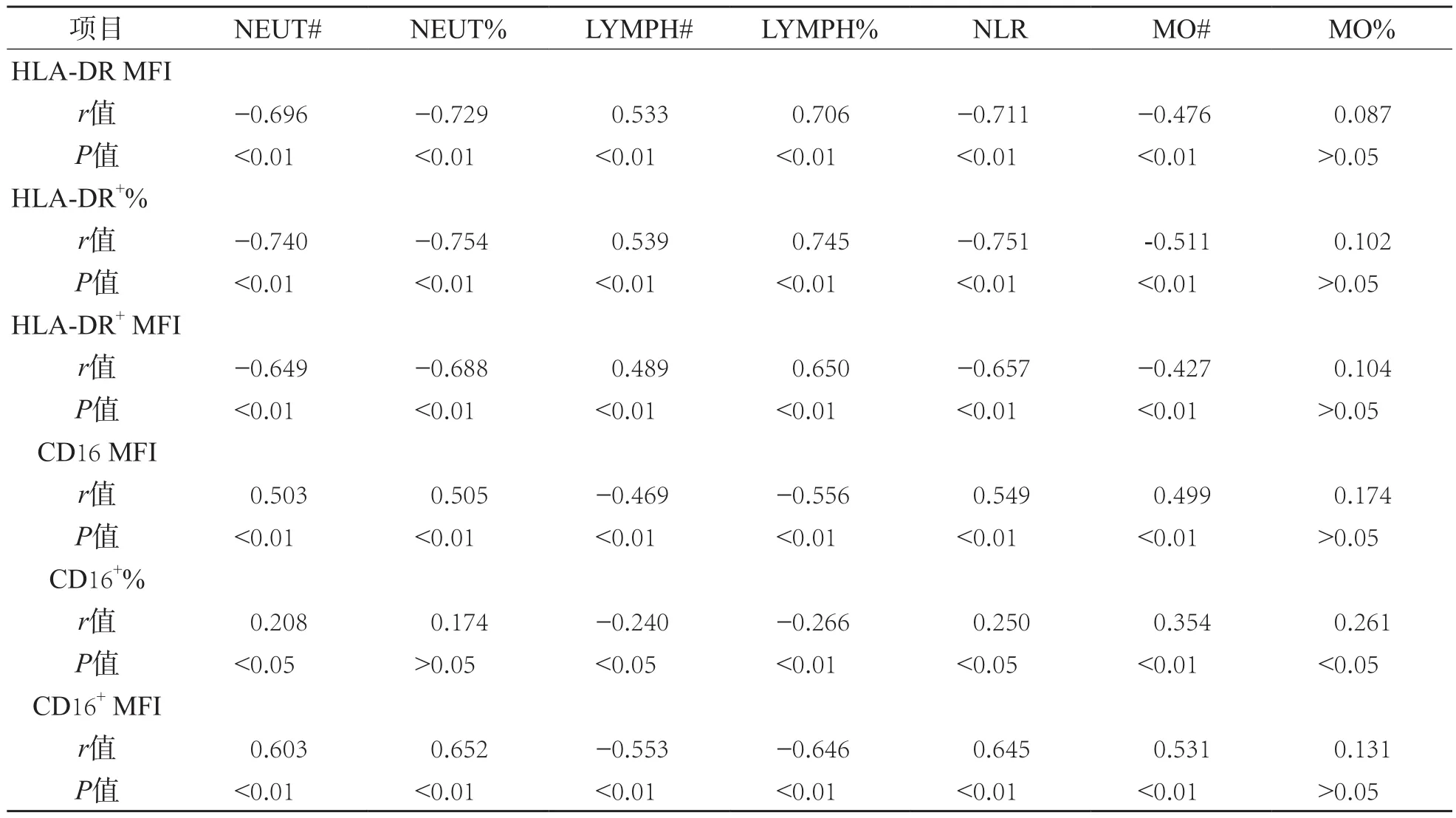
表3 单核细胞HLA-DR、CD16与白细胞各项指标的相关性分析
2.4 单核细胞HLA-DR MFI、HLA-DR+%、HLA-DR+ MFI、CD16 MFI、CD16+%和CD16+MFI诊断炎症性疾病的价值
ROC曲线分析显示,单核细胞HLA-DR MFI、HLA-DR+%、HLA-DR+MFI、CD16 MFI、CD16+%和CD16+MFI诊断炎症性疾病的曲线下面积(area under curve,AUC)分别为0.944、0.944、0.924、0.911、0.722、0.979。见表4、图1、图2。

表4 单核细胞HLA-DR、CD16诊断炎症性疾病的价值

图1 单核细胞HLA-DR MFI、HLA-DR+%和HLA-DR+MFI诊断炎症性疾病的ROC曲线

图2 单核细胞CD16 MFI、CD16+%、CD16+ MFI诊断炎症性疾病的ROC曲线
3 讨论
单核细胞来源于骨髓造血干细胞,在血液中停留几天后迁移到不同的周围组织中,分化为巨噬细胞或树突状细胞[4]。因此,作为巨噬细胞和树突状细胞的前体细胞,单核细胞在功能上兼具这2类细胞的特点,在炎症性疾病的发病机制中参与免疫防御、抗原提呈等环节而发挥作用。
根据细胞表面CD14和CD16表达的差异,可将血液中的单核细胞分为3个亚群:典型(CD14+CD16-)、中间型(CD14++CD16+)和非典型(CD14+CD16++)[4]。对于中间型和非典型单核细胞中哪一亚群与炎症因子的产生关系更密切,目前尚无定论[5]。本研究将单核细胞分为CD14+CD16-和CD14+CD16+2个亚群进行分析。结果显示炎症性疾病患者发病时外周血中CD14+CD16+单核细胞的比例明显增高。该群单核细胞在血管内皮爬行时,能及时感应到炎症或损伤发生的信号并快速迁移至组织中,分泌TNF-α、白细胞介素(interleukin,IL)-1β、IL-6、IL-8等多种细胞因子,从而增强局部的炎症反应[3,5]。而且CD14+CD16+单核细胞HLADR的表达强度比CD14+CD16-单核细胞更高,提示CD14+CD16+单核细胞具有更强的抗原提呈能力。另外,炎症性疾病患者单核细胞HLADR+%和HLA-DR MFI均显著降低。抗原提呈细胞上HLA-DR的低水平表达说明炎症性疾病发生时人体处于一定程度的免疫抑制状态。HLA-DR作为MHCⅡ类分子,其表达可受内毒素、TNF-α等刺激而下调[6],故炎症及感染状态下单核细胞HLA-DR的表达水平会下降。多项研究证实,危重患者中单核细胞HLA-DR的低表达与患者发生细菌感染、脓毒血症密切相关[7-9]。
本研究结果显示炎症性疾病患者单核细胞绝对数明显高于正常对照者,说明单核细胞在炎症反应过程中增殖并起重要作用。此外,单核细胞HLA-DR和CD16的表达与NEUT#、LYMPH#、LYMPH%、NLR等白细胞指标有较强的相关性(P<0.01),提示单核细胞HLADR、CD16很可能与中性粒细胞、NLR等常规指标类似,可反映炎症反应的严重程度。在炎症性疾病发生时,单核细胞HLA-DR表达降低和CD16表达升高很可能与粒细胞、淋巴细胞的变化同步发生,即这些细胞共同参与炎症反应过程中的免疫应答。ROC曲线分析显示,单核细胞HLA-DR MFI、HLA-DR+%、CD16 MFI和CD16+%对炎症性疾病的诊断具有较高的价值。由于不同荧光抗体或流式检测平台之间存在一定的差异,因此建议各实验室自行建立参考区间。
近年来,学者们相继开展了许多研究,发现了降钙素原、高敏C反应蛋白等生物标志物可作为诊断感染性疾病的有效指标[10-11]。感染是炎症性疾病的常见诱因。由于研究对象的选择有限,本研究结果主要反映了细菌感染型炎症性疾病的情况。虽然细菌是引起感染性疾病的主要病原体,但在病毒、真菌等微生物感染引起的炎症反应中单核细胞HLADR、CD16的表达是否会出现相应的变化,目前仍不甚明确。有研究指出CD14+CD16+单核细胞与乙型肝炎患者HBV病毒复制和疾病进程间存在相关性[12],但其对病情评估和预后判断的价值还有待研究。此外,本研究调查对象以急性炎症性疾病患者为主,且其中发生单一系统的局部炎症反应者居多,而单核细胞HLA-DR、CD16的表达水平在急性和慢性炎症反应、局部炎症反应和全身系统性炎症反应中是否存在差异,还需进一步研究加以验证。除了辅助诊断炎症性疾病外,单核细胞CD16和HLA-DR在其他疾病中的意义也被逐步研究并报道。CD14+CD16+单核细胞不但在感染性炎症反应中明显增殖,还与自身免疫性疾病、糖尿病、动脉粥样硬化等疾病的发生有关联[1,13-14]。单核细胞HLA-DR亦可作为创伤、手术、器官移植后机体免疫状态和疗效评价的指标[15-18]。
综上所述,单核细胞HLA-DR和CD16的表达变化与炎症性疾病的发病过程具有较好的相关性,可用于炎症性疾病的诊断,还可以辅助评估炎症反应程度并监测机体的免疫状态。

