猪繁殖与呼吸综合征与猪圆环病毒2型混合感染的病因分析及综合防控
康新华
(甘肃省动物疫病预防控制中心,甘肃兰州 730046)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种急性高致死性传染病,主要引发母猪繁殖障碍、仔猪肺炎等。此外,PRRSV具有高变异特性,可随时间变异出多种基因型的毒株[1],从而加大了其防治难度,给养猪业带来巨大的困扰和经济损失。猪圆环病毒2型(Porcine circovirus type 2,PCV2)是近年来发现的一种以猪为主要宿主的病原,目前已在全球范围内广泛流行,且危害严重。PCV2可造成猪断奶后多系统衰竭综合症(PMWS)、猪皮炎与肾炎综合症(PDNS)、繁殖障碍、A2型先天性震颤(CT)、猪增生性坏死性间质性肺炎(PNP)以及猪呼吸道病复合征(PRDC) 等疾病[2]。
临床上PCV2与其他病原混合感染的现象普遍存在。赵浩军等[3]对全国9个省份的733份病猪样品进行了PCV2检测,对鉴定为PCV2阳性的283份样品再进行PRRSV、猪细小病毒(PPV)和猪瘟病毒(CSFV)检测,发现PCV2与PRRSV、PPV和CSFV 3者混合感染的阳性率分别为33.2%、16.3%和26.1%,以PCV2和PRRSV双重感染最为突出。此外,大量研究表明,PCV2和PRRSV的混合感染已成为PMWS阳性猪的主要致病因素。如荷兰表现PMWS临床症状的猪群中PCV2与PRRSV混合感染率高达83%[4],美国为60%[5],中国为47.7%[6],由此可见,PRRSV与PCV2混合感染的病例在许多国家和地区的养殖场广泛存在,严重危害着养猪业的健康发展。本文主要对甘肃省某规模场一起PRRSV与PCV2混合感染的病例进行了诊断分析,并阐述了其发病情况及临床症状,进一步综述了两种病毒的协同致病机制,为该病的临床防治提供理论参考。
1 发病情况及临床症状
2018年3月,甘肃某规模猪场,不同胎次母猪出现流产,日流产2~4头,表现为早产、产死胎、木乃伊胎、畸形胎。母猪流产前体温升高到39.3~40.5℃,并伴有咳嗽、腹式呼吸,食欲不振,厌食并逐渐消瘦,流产后母猪开始采食。发病猪群精神沉郁、扎堆,腹股沟淋巴结、肠系膜淋巴结以及颌下淋巴结明显肿大,个别病猪胸腹部可见皮肤点状出血。在饲料中添加替米考星、磺胺、柴胡粉等药物5天,症状没有明显好转,1个月内死胎率为18%,木乃伊胎发生率为3%,平均死亡淘汰率高达20.05%。
2 病理学特征
病死猪尸体消瘦,对其进行剖检可见:胸腹腔有积液,呈现“绒毛心”;肺脏充血、淤血、肿胀,表面有纤维素性渗出和暗区,个别有散在肉变或胰变,按压无弹性;肝脏肿大、质脆;脾脏肿大,边缘梗死,有不规则出血点,质地变脆;肾脏出血较多;肠道黏膜、喉头、膀胱均有不同程度的点状出血;关节肿大,全身淋巴结肿大。
3 实验室诊断
分别采集7份流产胎儿组织样品,采用RT-PCR方法进行CSFV、PRRSV、PCV2、猪伪狂犬病毒(PRV)以及猪乙型脑炎病毒(JEV)的病原学检测,检测结果如图1(A~E)所示。同时随机抽取2份饲料样品,使用黄曲霉毒素B1胶体金快速检测卡,严格按照操作程序检测黄曲霉毒素含量,检测结果如图2所示。
检测结果表明:PRRSV、PCV2核酸检测为阳性,CSFV、PRV以及JEV核酸检测均为阴性;黄曲霉毒素检测C线、T线同时显色,表示样品中黄曲霉毒素B1残留量低于检测限量浓度(10 μg/kg),饲料中黄曲霉毒素未超标。综上所述,PRRSV与PCV2混合感染是导致该规模场母猪流产的主要原因。
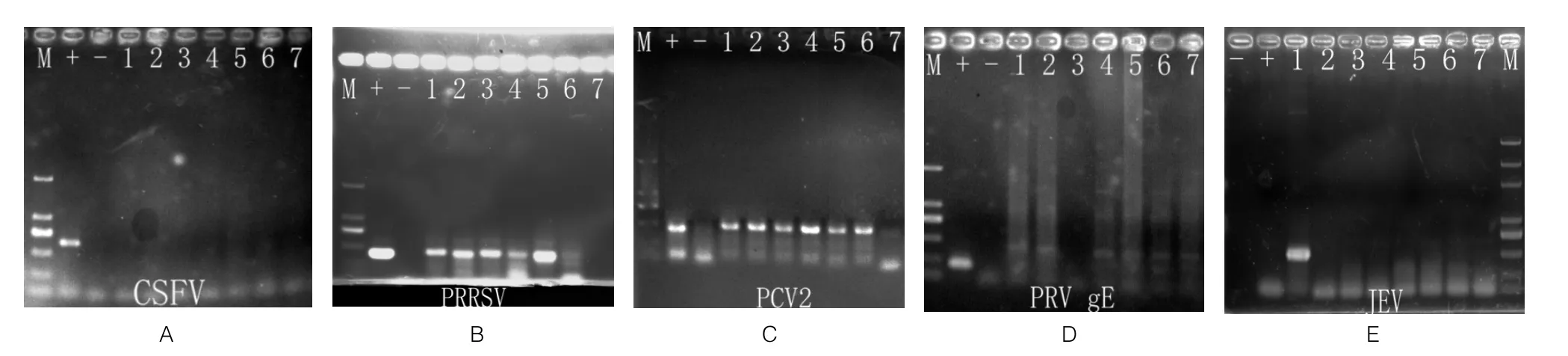
图1 CSFV、PRRSV、PCV2、PRV gE和JEV RT-PCR检测结果
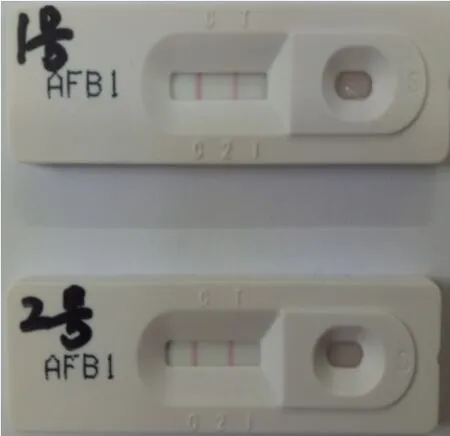
图2 饲料中黄曲霉毒素检测结果
4 分析讨论
4.1 PRRSV与PCV2混合感染的致病机理
PRRSV和PCV2都是制约养猪业健康发展的重要病原。临床上,这两种病原的混合感染现象较为普遍,且控制难度大,已成为世界养猪业的一大难题。造成这一局面的根本原因是PRRSV与PCV2都属于免疫抑制性病毒,其混合感染一方面会导致群体免疫力下降,对疾病的易感性增高[7];另一方面这两种病毒之间存在相互作用,使混合感染的病情更加严重。
首先,PRRSV可以使猪只的免疫调节紊乱,而PCV2则主要侵害机体内的单核细胞和巨噬细胞,从而造成免疫抑制,导致动物机体免疫应答能力下降,无法产生高水平抗体[8]。王天户等[9]研究表明,PRRSV和PCV2混合感染猪发生免疫抑制是由于病毒感染前期引发的广泛性淋巴细胞和巨噬细胞凋亡以及感染后期淋巴组织的广泛性坏死。其研究表明,PRRSV与PCV2混合感染组多处淋巴结指数显著高于PRRSV单独感染组,且混合感染加重了免疫器官、淋巴细胞及巨噬细胞的变性坏死,后期还可造成脾脏严重的淋巴滤泡缺失和淋巴结肉芽肿性炎症。两种感染均能引发淋巴结、脾、肺、肝和外周血淋巴细胞及巨噬细胞凋亡,但混合感染细胞凋亡更加严重且持续时间更长。且凋亡主要见于早期,后期则主要表现为坏死性病变,导致更加严重的免疫抑制。其次,早有研究证实了PRRSV与PCV2之间的相互关系,在混合感染猪中,PCV2不影响PRRSV的复制和损伤,而PRRSV能够增强血清中PCV2的DNA载量[10-11],并可以增加组织样品中PCV2的抗原水平[12],这会导致更加严重的PCV2联合损伤[13]。研究表明,PRRSV与PCV2混合感染组中脏器PCV2病毒载量高于单一感染组,表明PRRSV对PCV2的复制有增强作用。同时PRRSV与PCV2混合感染的仔猪,抗体产生晚于单一感染组,且抗体水平较低。PRRSV和PCV2能够协同作用,导致试验猪外周血中NK细胞、T细胞等免疫细胞减少。因此,PRRSV与PCV2混合感染更加严重地抑制了宿主的免疫反应,使猪只对其他病原的易感性增强。由于PCV2可诱导淋巴系统中B细胞凋亡,严重侵害猪的免疫系统,造成感染猪免疫功能降低[14]。
4.2 PRRSV与PCV2混合感染的综合防控
PRRSV和PCV2的混合感染在临床上普遍存在,由于其免疫抑制作用,以及两种病毒之间的相互作用,加大了防控难度。其综合防控措施主要从以下几方面着手:
4.2.1 混合感染的疫苗免疫
疫苗免疫是常用的最快捷有效的防治方法。但是关于混合感染的疫苗免疫,有研究表明PRRSV和PCV2疫苗之间也存在相互作用。在PRRSV和PCV2混合感染猪中,PCV2疫苗可以诱导免疫应答从而减少PCV2病毒血症、PCV2的组织损伤和PCV2抗原含量,且PCV2疫苗不影响PRRSV疫苗的免疫反应;而在混合感染猪中,PRRSV疫苗不能诱导免疫应答,或者说不能减少PRRSV病毒血症、PRRSV的组织损伤以及PRRSV抗原含量,且PRRSV疫苗可增强PCV2病毒血症、PCV2诱导的损伤以及PCV2抗原含量。因此,在PRRSV与PCV2混合感染猪中,PCV2疫苗可以减少由PRRSV增强的PCV2损伤,而PRRSV疫苗单独存在时并不能减少由PRRSV增强的PCV2损伤。这个模型显示,PRRSV疫苗或者是PRRSV本身可能会诱导PCV2加大复制,PCV2复制的增强可能会损害免疫系统。这项研究具有深远的临床意义,提示养猪从业者在注射PRRSV疫苗时,应首先检查猪只PCV2的感染状况,这样才能有效控制PRRSV。在混合感染中,使用PCV2疫苗控制PCV2感染时,PCV2疫苗的免疫反应肯定受到PRRSV疫苗的影响,制定合理的免疫程序是防治混合感染的关键[15]。
4.2.2 免疫抑制的消除
由于PRRSV和PCV2都属于免疫抑制性病毒,因此,其混合感染的防控应首先考虑避免或消减其免疫抑制问题。近年来免疫增效剂在此类疫病防控中得到了广泛应用,对其选择也逐渐趋于高活性、无污染残留和毒副作用的天然免疫增效剂,如中草药提取物及增益素等成为防控此类疫病的首选。
4.2.3 常规防控措施
造成PRRSV和PCV2混合感染的风险因素是多方面的,因此防控此类疫病也需从多方面入手。
首先,加强饲养管理,控制猪场环境。严格控制饲养密度,减少交叉哺乳,避免不同日龄和来源的猪只混群。提供合理全面的营养方案,严格把控饲料和饮水质量,定期检查、清理消毒,尽量减少猪群应激,采用“分阶段、全进全出”的饲养方式,确保每次转群或卖猪后,清空猪舍严格消毒。
其次,加强猪场生物安全监督,严格消毒灭菌。坚持引种检疫和隔离观察制度,坚持严格的消毒灭菌以及外来人员参观访问制度。加强猪场生物安全监督,减少病原传播几率。
最后,加强疫病的监测和免疫预防,定期开展常见疫病的监测。对已免疫疫病定期进行抗体检测以及抗体效果评价,掌握猪群疫病流行状况以及免疫效果。根据饲养情况、病原特征,制定合理的免疫程序,确定疫苗种类以及免疫时间。
总之,PRRSV与PCV2混合感染的现象普遍存在,由于两种病毒之间的相互作用以及相应疫苗之间的相互作用,加大了该类混合感染疾病的防控难度,其相互作用机理还需进一步深入研究。

