急性脑梗死患者血清超敏C-反应蛋白和纤维蛋白原检测的临床意义
魏东,杨宗军,王晓晶
(1嘉祥县妇幼保健计划生育服务中心,山东济宁 272400;2青岛市妇女儿童医院;3济宁市第一人民医院)
急性脑梗死是神经内科常见病之一,致残率和致死率均较高。急性脑梗死发生后梗死灶周围可出现局部炎性反应,产生大量炎性因子,炎性反应会进一步影响脑代谢异常及病理生理变化,进而加重脑梗死病情[1]。有研究显示,血清超敏C反应蛋白(hs-CRP)和纤维蛋白原(FIB)水平升高均是脑动脉粥样硬化血栓形成的高危因素,二者血清水平改变与患者脑梗死发生、发展密切相关。为此,本文98例急性脑梗死患者的血清hs-CRP、FIB水平进行检测,并分析脑梗死严重程度、病灶面积与血清hs-CRP、FIB水平变化的关系
1 资料与方法
1.1 临床资料 选择2015年10月~2017年10月济宁市第一人民医院收治的急性脑梗死患者98例(观察组),男56例、女42例,年龄41~80(53.5±6.2)岁。其中合并高血压者38例。冠心病者28例,糖尿病者16例。纳入标准:①患者均符合第四届全国脑血管病学术会议制定的急性脑梗死诊断标准[2],并经CT或(和)MRI等影像学检查确诊;②急性脑梗死均为首次发病。排除标准:①3个月内有急性创伤、感染或风湿等炎症性疾病、发热、动脉炎、血液系统疾病、肝肾功能障碍、癫痫、自身免疫性疾病;②合并严重心脑血管并发症;③合并严重心肝肾功能障碍;④近1个月内有外科手术治疗史;⑤近期服用降纤维药物;⑥正在参加其他药物的临床试验者;⑦病历资料不全者。参照全国第四届脑血管病学术会议制定的临床神经功能缺损程度评分标准,98例分为重度脑梗死28例(神经功能缺损程度评分 31~45分),中度脑梗死38例(神经功能缺损程度评分16~30分),轻度脑梗死32例(神经功能缺损程度评分0~15分)。结合CT/MRI扫描结果并按照Adama分类标准98例分为大面积脑梗死36例(病灶最大直径>5 cm),小面积脑梗死30例(病灶最大直径1.5~5 cm),腔隙性脑梗死32例(病灶最大直径<1.5 cm)。选择同期健康体检者49例作为对照组,男29例、女22例,年龄40~79(53.6±6.1)岁;与观察组比较,其性别、年龄构成差异无统计学意义(P均>0.05)。本研究经医院伦理委员会批准,患者及家属均对本次研究知情并签署知情同意书。
1.2 检测方法 两组均取清晨空腹状态下肘部静脉血5 mL,常规离心分离并收集血清,低温保存,检测两组血清hs-CRP、FIB水平以及观察组不同梗死程度、不同脑梗死面积患者血清hs-CRP、FIB水平。血清hs-CRP检测应用美国贝克曼AU5800全自动生化分析仪,选用原装试剂,采用速率透射免疫比浊法测定。血清FIB检测应用日本Sysmex CA-700全自动血凝仪检测,选用原装试剂,采用免疫比浊法测定。两者均严格按照仪器及试剂说明书操作,血清hs-CRP正常参考值为0~6 mg/L,血清FIB正常参考值为2.0~3.8 g/L。

2 结果
2.1 两组血清hs-CRP、FIB水平比较 观察组血清hs-CRP、FIB水平均高于对照组,差异有统计学意义(P均<0.05)。见表1。
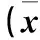
表1 两组血清hs-CRP、FIB水平比较±s)
注:与对照组比较,*P<0.05。
2.2 不同梗死程度患者血清hs-CRP、FIB水平比较 轻度、中度、重度脑梗死患者血清hs-CRP、FIB水平依次增高,不同梗死程度患者血清hs-CRP、FIB水平比较有统计学意义(P均<0.05)。见表2。
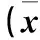
表2 不同梗死程度患者血清hs-CRP、FIB水平比较±s)
注:与中度脑梗死比较,*P<0.05;与重度脑梗死比较,**P<0.05。
2.3 不同脑梗死面积患者血清hs-CRP、FIB水平比较 大面积、小面积、腔隙性脑梗死患者血清hs-CRP、FIB水平依次增高,不同脑梗死面积患者血清hs-CRP、FIB水平比较有统计学意义(P均<0.05)。见表3。
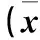
表3 不同脑梗死面积患者血清hs-CRP、FIB水平比较±s)
注:与小面积脑梗死比较,*P<0.05;与大面积脑梗死比较,**P<0.05。
3 讨论
研究显示,脂质物质在动脉壁沉积并形成斑块产生动脉粥样硬化是急性脑梗死重要的病理生理基础。动脉粥样硬化发生期间,血管内皮炎性反应发挥了重要作用;且急性脑梗死发病后,炎性反应还可进一步促进脑代谢异常等病理生理变化,进而加重缺血再灌注后继发性神经损伤,导致梗死病灶范围不断扩大[3]。因此,临床可通过检测血清各种炎性反应因子水平变化评估急性脑梗死病情进展情况。
hs-CRP是一种时相反应蛋白,是机体应激时肝脏在白细胞介素-1等炎性细胞因子作用下而合成的五聚蛋白,可反映机体内部炎症反应程度的变化[4]。大量临床研究证实[5,6],作为炎症标志物hs-CRP不但参与了机体炎症过程,而且与动脉粥样硬化的形成、分解及炎性损伤密切有关。hs-CRP可促进单核细胞释放组织因子,造成血管损伤[7];可激活补体系统,促进吞噬、调节免疫,增加动脉粥样硬化斑块局部炎性反应,造成局部斑块分裂破损[8];可造成血管内膜受损,增加血管通透性;可促进黏附分子分泌,使白细胞释放蛋白酶,诱导血管平滑肌硬化增生,进而可促进局部血栓形成,加重缺血[9,10]。本研究结果显示,急性脑梗死患者血清hs-CRP水平明显高于正常对照组;血清hs-CRP水平与急性脑梗死患者脑梗死面积大小及脑梗死严重程度相关,腔隙性脑梗死、小面积脑梗死、大面积脑梗死患者血清hs-CRP水平依次增高,轻度、中度、重度脑梗死患者的血清hs-CRP水平依次增高。因此,作为急性脑梗死发生发展的独立风险因素,血清hs-CRP水平可预测急性脑梗死患者的梗死面积大小及病情严重程度。
大量临床研究证实,FIB是一种急性时相蛋白,可反应机体的血凝状态。FIB在凝血酶作用下可转化为纤维蛋白,并沉积于血管内壁,成为早期动脉粥样硬化发生的危险性因素之一;血清FIB水平升高可促进局部血栓形成,并进一步加重血液黏稠度[11,12]。有研究报道,当血清FIB>5 g/L时,血栓形成的风险增加4~6倍[9]。另有研究发现,FIB还是一种炎症标记物,可沉积于血管壁并诱导平滑肌细胞向血管内膜迁移,对斑块内的泡沫细胞形成有重要作用;同时,FIB还会对血管内皮细胞造成损伤,通过胆固醇结晶浸润,加速动脉粥样斑块形成,并影响局部斑块稳定性[13,14]。据相关动物学模型研究表明,FIB可影响缺血性脑卒中大鼠的血液流动学变化,增加红细胞和血小板聚集性,参与内皮细胞增殖、分化等过程,导致血管内皮损伤加重,并增加血液黏稠度,从而形成血栓[15]。本研究结果显示,急性脑梗死患者血清FIB水平明显高于正常对照组;血清FIB水平与急性脑梗死患者脑梗死面积大小及脑梗死严重程度相关,腔隙性脑梗死、小面积脑梗死、大面积脑梗死患者血清FIB水平依次增高,轻度、中度、重度脑梗死患者的血清FIB水平依次增高。因此, 血清FIB水平作为诊断、预测急性脑梗死病情严重程度及梗死病灶大小的有效因子。
综上所述,血清hs-CRP、FIB水平变化与急性脑梗死患者的病情严重程度关系密切,检测急性脑梗死患者血清hs-CRP、FIB水平有助于判断病情变化,评估预后,值得临床应用和推广。

