复方贞术调脂方调节肝脏脂肪酸组成防治非酒精性脂肪肝*
王露莎,寇天顺,黄云翠,吴 琪,严诗楷,荣向路,郭 姣
(广东药科大学中医药研究院广东省代谢性疾病中西医结合研究中心 广州 510006)
随着高糖、高脂肪、高热量等不健康饮食习惯和久坐少动行为习惯的盛行,糖尿病、肥胖、高脂血症、脂肪肝等糖脂代谢紊乱疾病发病率越来越高。糖脂代谢病(Glucolipid Metabolic Disease,GLMD)是一种以糖、脂代谢紊乱为特征,由遗传、环境、精神等多种因素参与的疾病,以神经内分泌失调、胰岛素抵抗、氧化应激、炎症、肠道菌群失调为核心病理,以高血糖、血脂失调、非酒精性脂肪肝、超重、高血压及动脉粥样硬化等单一或合并出现为主要临床表现特点[1]。其中肝脏作为糖脂代谢紊乱的主要靶器官之一,肝脏脂肪性病变会出现肝细胞内脂肪过度沉积为主要特征的临床病理特征。
复方贞术调脂方(FTZ)由八味药组成,包括佛手、女贞子、杜仲、白术、三七、黄连等。其主要成分有小檗碱、巴马汀、丹酚酸B、红景天苷、特女贞苷、木兰碱、迷迭香酸、非洲防己碱、表小檗碱、药根碱、黄连碱、5,7-二甲氧基香豆素、人参皂苷Rg1、人参皂苷Rb1和齐墩果酸等[2,3]。前期研究表明,FTZ可降低血清中TC、TG、LDL-C水平,具有改善脂肪肝、降血脂、抗动脉粥样硬化、改善血液流变学等多重作用[4-9]。在此基础上,本研究基于肝脏脂肪酸代谢分析探讨FTZ对高脂饮食所致的脂代谢紊乱的影响,及其可能机制。
1 材料与方法
1.1 动物实验
1.1.1 动物分组与给药方式
8周龄C57BL/6j小鼠,购于广东省医学实验动物中心,SPF级,合格证号:44007200033452。广东药科大学实验动物中心SPF级饲养。根据小鼠体重、FPG、TC和TG等血液指标,将小鼠随机分为5组,分别设为正常对照组(Control)、模型组(Model)、二甲双胍阳性对照组(Metformin)、FTZ低剂量组(FTZ-L)、FTZ高剂量组(FTZ-H)。
饲养温度:20-25℃,湿度:40-70%,采用12 h:12 h昼夜间断照明;自由进食饮水。
干预方式:除正常对照组给予普通维持饲料外,模型组及给药组小鼠给予高脂饲料制备非酒精性脂肪肝小鼠模型,造模同时各给药组灌胃给予相应药物[4]。正常对照组、模型组给予5%阿拉伯树胶水溶液,阳性药二甲双胍组给予250 mg⋅kg-1二甲双胍溶液,FTZ低剂量组(FTZ-L)给予0.6 g⋅kg-1FTZ浸膏粉溶液,FTZ高剂量组(FTZ-H)给予1.2 g⋅kg-1FTZ浸膏粉溶液,以5%阿拉伯树胶水溶液为溶剂按10 mL⋅kg-1灌胃给药。
1.1.2 糖脂代谢相关血液指标
经乙醚麻醉,侧眼底静脉丛取血,肝素钠抗凝,离心取血浆,测定FPG、TG、TC、LDL-C水平、游离脂肪酸(NEFA)。利用Elisa测定血中FINS水平,计算胰岛素抵抗指数HOMA-IR值,HOMA-IR=FPG(mmol⋅L-1)×FINS(mIU ⋅L-1)/22.5[10]。
1.1.3 口服糖耐量实验(OGTT)
小鼠禁食16 h后眼底静脉丛取血,灌胃予20%葡萄糖溶液10 mL ⋅kg-1。灌胃后分别于20、60、120 min眼底静脉丛取血,测定血糖并计算AUC。
1.1.4 体脂比
利用小动物核磁共振全身成分分析仪测定小鼠脂肪以及瘦肉成分,通过对比体重计算相应的体脂比。
1.1.5 取材及肝脏病理学观察
给药16周后,经乙醚麻醉取血后脱颈椎处死小鼠,分离肝脏,称重后部分液氮冻存,于-80℃保存备用;部分经4%多聚甲醛固定,脱水,常规石蜡包埋切片,HE染色;部分经10%中性甲醛固定后,脱水,OCT包埋切片,油红O染色。多光谱显微镜明场下进行病理学观察。
1.2 GC-MS法分析肝脏脂肪酸组分[11]
1.2.1 色谱条件
色谱柱:DB-23石英毛细管柱(60 m×0.25 mm×0.15µm,);程序升温:初温50℃,保持0.5min,以20℃/min升至140℃,保持5 min,再以4℃/min升至240℃,保持5 min,后运行250℃,保持5 min;进样口温度250℃,分流比10∶1,进样量1.0µL;载气为高纯氦气,流速1mL/min。
1.2.2 质谱条件
电离方式:EI离子源;离子源温度230℃;电子能量:70 eV;四极杆温度150℃;溶剂延迟时间4.5 min;扫描范围m/z40~500 amu;选择离子扫描方式(扫描)。
1.2.3 供试品溶液的制备
取50 mg解冻后的小鼠肝脏组织,加入600µLCHCL3-MeOH(2∶1,v/v),匀浆(1 800 rpm,30 s);加入200µL超纯水涡旋30 s,室温下离心分离(10 000 rpm,5 min);取100µL的下层萃取液,室温下N2吹干;加入200µLCHCL3-MeOH(2∶1,v/v)复溶,加入40µL衍生化试剂混匀,静置1 h。移取上清液到内衬管中,供GC-MS分析。
1.3 仪器
小动物核磁共振全身成分分析仪(LF90II,Bruker),Vectra3.0定量病理成像系统(CLS142568,PerkinElmer)气相色谱质谱联用仪(Agilent7890B-5977B);SC-3610低速离心机(Zonkia,中国);D3024R型台式高速冷冻离心机(SCILOGEX,美国);GENIUS3型漩涡混合器(IKA,德国);HGC-24A型氮吹仪;BT125D型十万分之一分析天平(赛多利斯,德国)
1.4 试剂
D12451高脂饲料、D12450-B普通维持饲料(广东省医学实验动物中心),甘油三酯测定试剂盒、葡萄糖测定试剂盒、总胆固醇测定试剂盒(上海荣盛生物药业有限公司),insulin Elisa试剂盒(武汉华美生物工程有限公司);标准品:Supelco 37 Component FAME Mix(Sigma-Aldrich,CRM47885);
1.5 统计学方法
所有数据均采用均值±标准差(xˉ±SD)统计。采用IBM SPSS Statistics19版统计软件对数据进行分析,组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05显示具有统计学差异。
2 结果
2.1 糖脂代谢相关指标比较
给予高脂饲料16周,与正常对照组比较,模型组小鼠血浆中的FPG、TC、TG、LDL-C含量均明显上升;检测其血浆中的NEFA,模型组的NEFA含量比正常对照组明显升高。模型组小鼠FINS对比正常对照组含量增多,计算其HOMA-IR值,结果显示模型组的HOMA-IR平均值达到3.5。通过OGTT,发现模型组的糖耐量较于正常对照组明显减弱。提示长期高脂饮食的模型组小鼠有胰岛素抵抗、高血糖、高脂血症等病理特征。给予FTZ干预16周后,与模型组比较,FTZ高、低剂量组的FPG、TC、TG、LDL-C、NEFA均有不同程度的降低(图1,3),且有统计学意义。并且体内的FINS也有明显的下降,其HOMA-IR值亦明显降低(图2)。在OGTT实验中,FTZ高、低剂量给药组的糖耐量则有明显好转(图2)。统计其AUC发现,与模型组比较,FTZ高低剂量给药组OGTT实验的AUC明显减少。提示FTZ可以改善非酒精性脂肪肝模型小鼠的糖耐量。以上实验结果说明FTZ可以改善高脂饮食导致的脂代谢紊乱小鼠的高血糖、高血脂与胰岛素抵抗。
通过时域核磁共振(TD-NMR)技术无创检测小鼠体内脂肪含量,瘦肉含量(图3)。实验结果显示,经过16周高脂饲料喂养的模型组体内的脂肪含量明显升高(P<0.01),而瘦肉含量无明显差异,其体脂率(fat/lean值)明显上升(P<0.01),提示模型组小鼠体内脂肪蓄积过多。给药16周后,FTZ可以有效降低肥胖小鼠体内的脂肪含量和体脂率,并且维持体内的瘦肉含量无明显变化,提示FTZ可以有效改善脂代谢紊乱。
2.2 肝脏病理结果比较
给药10周后,HE染色观察,高脂饲料喂养的模型组小鼠可见大量不同程度的脂肪变性和肝细胞空泡变性,汇管区周围部分的组织最为明显。FTZ高、低剂量组与模型组相比,脂肪变性程度及肝细胞空泡症状减轻,胞内脂滴数量减少,体积变小(图4)。
为确认肝脏内脂质沉积的情况,进行油红O染色,油红O可以特异性使脂滴染成红色。实验结果显示,正常对照组小鼠的肝脏组织仅有少量细小脂滴,而模型组的肝细胞内有大量脂滴,具有肝脏脂肪性病变的表型;给药FTZ高剂量组和低剂量组的肝组织脂滴的大小和数量对比模型组均有不同程度的减少,差异有统计学意义(P<0.05)。
2.3 肝脏脂肪酸组分分析
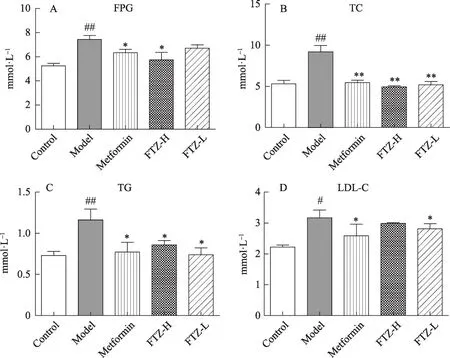
图1 FTZ可以改善HFD所致的脂代谢紊乱小鼠血循环糖脂代谢指标A-D.血浆中FPG、TC、TG、LDL-C浓度
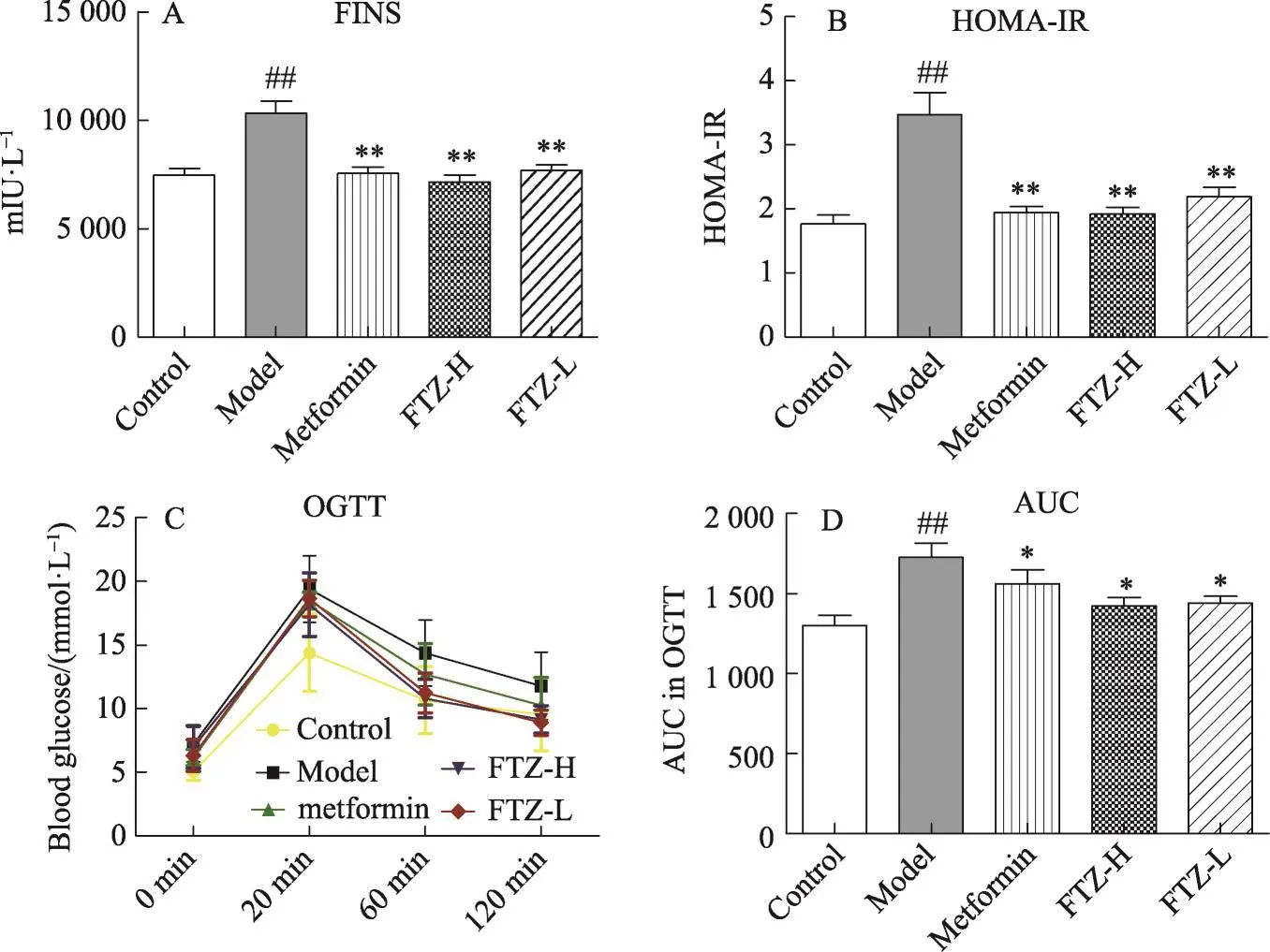
图2 FTZ可以改善HFD所致的脂代谢紊乱小鼠的胰岛素抵抗A.血浆中FINS浓度B.各组小鼠的HOMA-IR值C-D.OGTT实验各时间点血糖浓度及AUC值
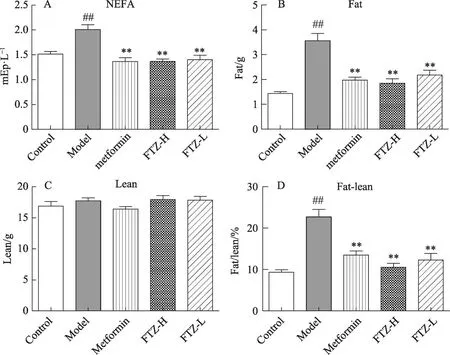
图3 FTZ可以改善HFD所致的脂代谢紊乱小鼠的脂代谢A.血浆中NEFA浓度B-D.各组小鼠体内脂肪、瘦肉含量及体脂率(fat/lean)
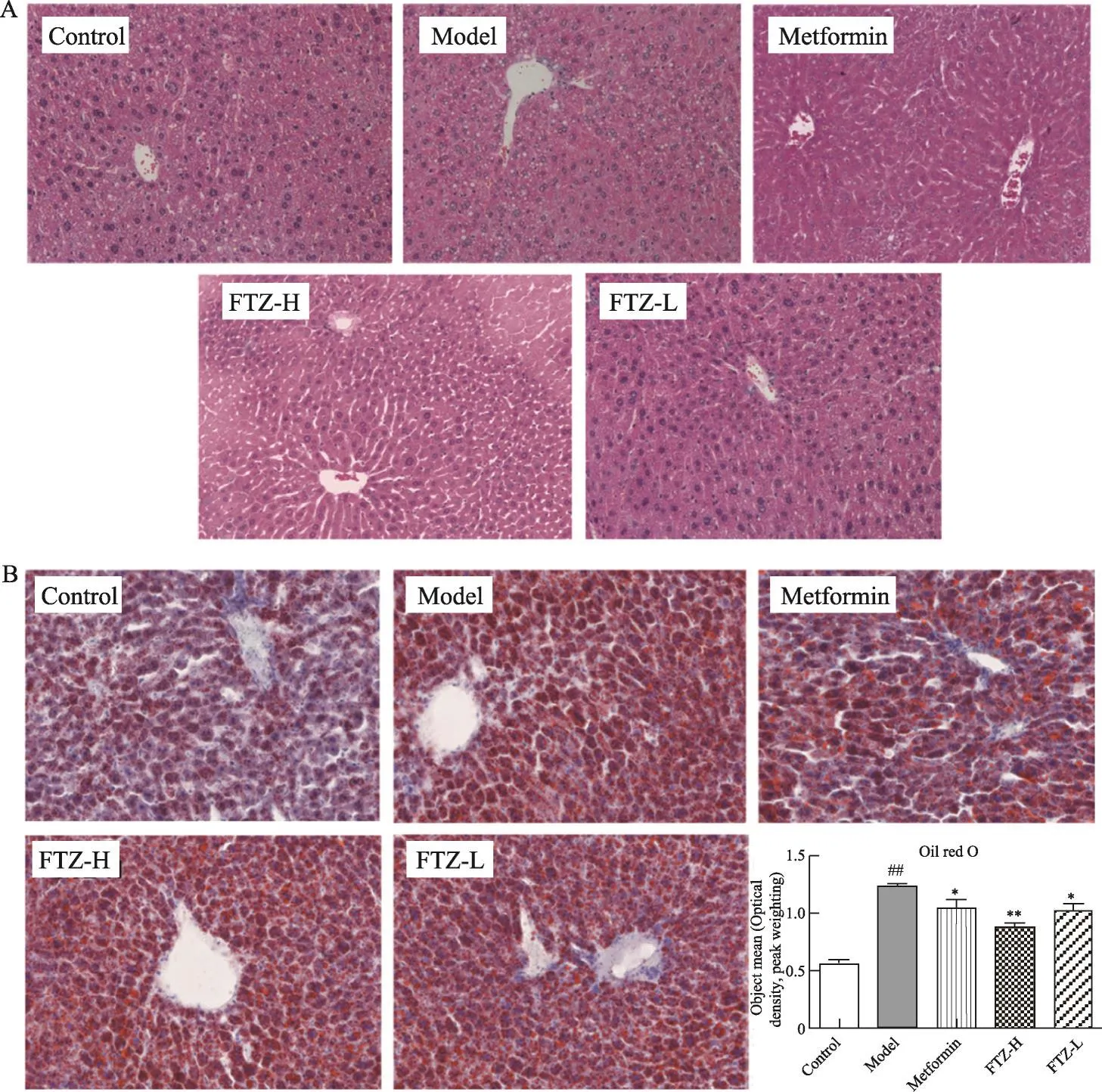
图4 FTZ减少肝脏的脂滴沉积A.肝脏HE染色(200×)B.肝脏油红O染色(200×)
通过GC-MS对小鼠肝脏脂肪酸的分析发现,与对照组相比,模型组小鼠肝中的总脂肪酸(TFA)含量明显升高(表1),其中C15∶0、C16∶0、C17∶0、C18∶0等饱和脂肪酸绝对含量显著升高(P<0.01),而给药高、低剂量组的C15∶0、C16∶0、C17∶0、C18∶0绝对含量明显降低,说明FTZ可以有效降低肥胖小鼠肝脏的饱和脂肪酸含量。该模型小鼠肝脏中大约35%的脂肪酸是单不饱和脂肪酸(Mono-Unsaturated Fatty Acids,MUFA),主要是C18∶1N9C。模型组的C16∶1、C18∶1N9C这2种MUFA含量与其占总脂肪酸的比值均明显升高,给药FTZ之后,其比值明显下降,趋于正常对照组。这些脂肪酸含量变化的差异可能是肝脏甘油三酯代谢和胆固醇代谢变化的结果。其中,模型组的C14∶1、C15∶1、C17∶1、C18∶1N9T、C20∶1、C24∶1、C22∶1 等 MUFA/TFA比值显著降低,给予FTZ干预16周后,其含量明显上升。与正常对照组相比,模型组的PUFA/TFA值明显下降,而给药FTZ高、低剂量组的PUFA/TFA值则明显回升(表2)。其中C20∶2、C22∶2、C18∶2N6T、C20∶3N6、C20∶4N6、C22∶6N3等PUFA/TFA值均有不同程度的升高且有统计学意义,提示FTZ改善脂代谢与升高肝脏PUFA的比重密切相关。
另外,C8∶0、C10∶0、C11∶0、C13∶0仅在少部分小鼠肝脏样本中有检测到,此部分不计入统计。
以上脂肪酸组分分析提示,FTZ可以降低高脂饮食导致的糖脂代谢紊乱模型小鼠肝脏中的饱和脂肪酸同时升高肝脏中不饱和脂肪酸,调节机体的甘油三酯代谢和胆固醇代谢,从而改善胰岛素抵抗、高血糖、高脂血症。
3 讨论
肝脏是脂质合成和利用的重要场所,也是胰岛素抵抗的重要靶器官之一。肝细胞脂肪性病变的主要机制是由于脂肪组织的脂质分解加速,使血循环中的NEFA增加,导致NEFA在肝脏中的沉积[12]。肝脏脂肪酸含量增多是糖脂代谢紊乱的重要危险因素,这主要是由于NEFA在肝细胞内沉积后转化为TG、神经酰胺等,其中TG以极低密度脂蛋白(very-low-density lipoprotein,VLDL)的形式从肝脏输出进入血循环,影响心血管系统,容易引起其他糖脂代谢疾病并发症[13]。不同类型的脂肪酸有着不同的功能,如在肝脏脂肪性病变过程中,具有促炎效应的花生四烯酸(C20∶4)增多,严重时会使肝脏发生炎症病变,也是机体脂代谢紊乱后会出现慢性炎症的原因之一[14];C14∶0可使肝脏脂肪酸合成增加,导致血脂升高;C18∶0含量过高会损害血管内皮细胞的功能,与动脉粥样硬化的发生相关[15];C16∶0可与血液中游离的铁离子结合使肝细胞内的铁过载,导致活性氧簇(reactive oxygen species,ROS)生产过量和脂质过氧化,破坏机体肝脏脂代谢平衡,导致胰岛素抵抗[16];C20∶3n-6、C20∶4n-6为前列腺素E1(Prostaglandin E1,PGE1)的合成前体[17]。
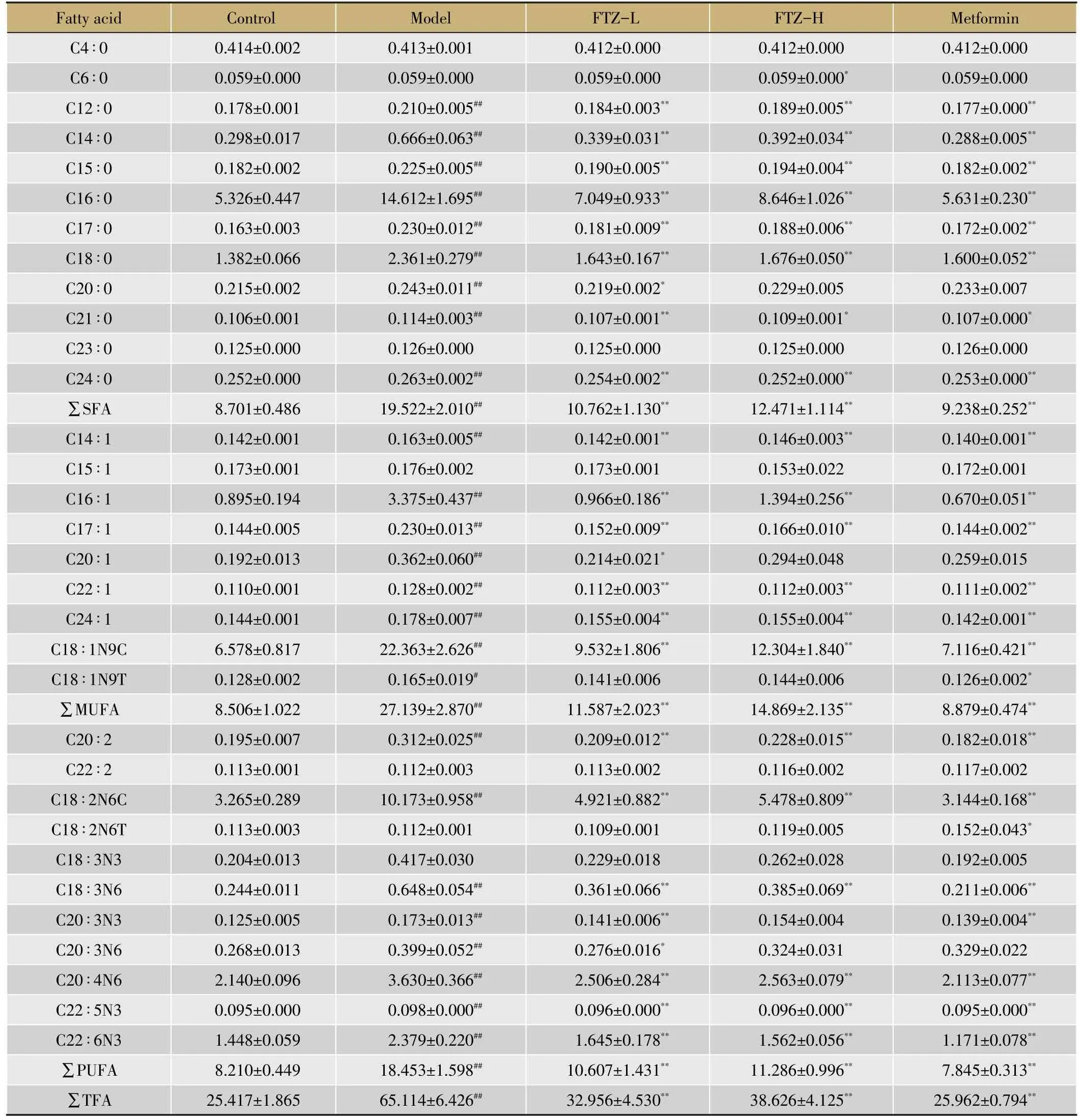
表1 给药16周后小鼠肝脏各脂肪酸组分含量(μg⋅mg-1)
本研究主要是观察FTZ对高脂饮食导致的脂代谢紊乱小鼠肝脏脂肪酸的代谢变化的影响。当肝细胞过度积累胆固醇时,将会通过激活C-Jun N端激酶1(c-Jun N-terminal kinase 1,JNK1)通路使细胞线粒体受损,导致肝细胞凋亡与坏死[18]。而FTZ可以降低血浆中的TC与LDL-C,减少胆固醇在肝脏积聚,降低肝损伤的发生,使肝脏保持良好的脂代谢功能。高热量饮食时肝脏内SFA含量的升高对肝细胞有直接的毒性作用,SFA在肝细胞内过量沉积,通过内质网和过氧化物酶体途径使氧化增加,使ROS生成增多,若超出肝脏产生的抗氧化物的能力,则可引起氧化应激反应[19]。模型组小鼠肝脏中SFA含量的增加,一方面与长期摄入高脂饲料有关,另一方面与机体的内分泌和代谢紊乱相关。高脂饲料可使血液中的NEFA浓度增加,使脂肪组织对胰岛素的敏感性下降,减弱胰岛素对脂肪
分解的抑制作用,使脂肪组织中TG分解为SFA增加。循环血中的SFA可通过调节主动脉平滑肌细胞内二酯酰甘油酰基转移酶2(Diglyceride acyltransferase,DGAT2)和蛋白激酶C(Protein kinase C,PKC)的活性影响TG的合成,从而加速动脉粥样硬化的形成[20]。前期研究显示有FTZ抗动脉粥样硬化的作用,其机制可能是与通过降低肝脏中的SFA含量,减少进入血循环血浆中的SFA,使SFA在主动脉平滑肌细胞沉积的风险减弱相关。
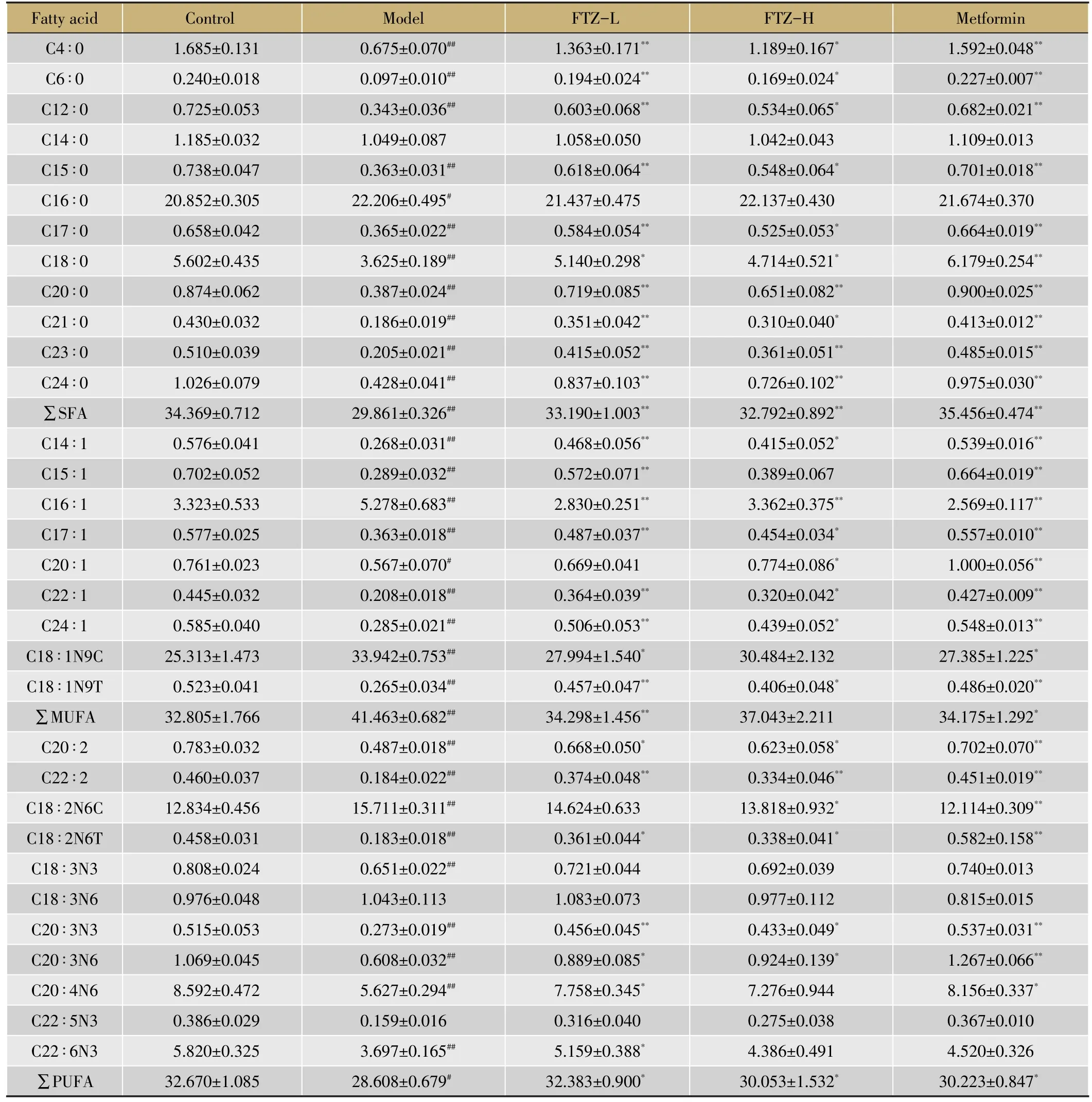
表2 给药16周后小鼠肝脏各脂肪酸占总脂肪酸的百分比(%of total)
不同的脂肪酸对机体脂代谢有不同的影响,FTZ可以降低肝脏中的SFA含量,并且升高MUFA、PUFA在TFA中的比重,逆转脂质异位沉积于肝脏的脂毒性(图5)。研究发现,无论是外源性给予还是内源性合成PUFA均能改善肝脏脂肪沉积状态。肝脏内源性合成的PUFA能够激活PPARα上调参与肝脏脂肪酸氧化的基因转录,抑制胆固醇调节元件结合蛋白-1c(Sterol-Regulatory Element Binding Protein 1c,SREBP-1c),下调参与肝脏脂肪合成的基因表达[13]。当PUFA减少时,可诱导SREBP-1c表达,以及增加其下游甘油-3-磷酸酰基转移酶1(Glycerol-3-Phosphate Acyltransferase 1,GPAT1)的表达,从而使VLDL的分泌增加,加重高甘油三酯血症[21]。而FTZ可以明显升高肝脏的PUFA,提示FTZ改善高甘油三酯血症的作用可能与下调SREBP-1c和GPAT1的mRNA表达,减少VLDL的分泌通路相关。在体内研究中,FTZ可下调大鼠肝组织中肝X受体(Liver X Receptor,LXR)和SREBP-1cmRNA的表达以降低非酒精性脂肪肝大鼠血循环中的TG、NEFA,具有调脂保肝作用。FTZ可使NAFLD小鼠血浆及肝组织中TC、TG含量均显著降低,下调肝脏中的SREBP-1c的mRNA表达量[22],并且上调肝脏PPARα及其下游基因肉碱棕榈酰转移酶1(Carnitine Palmitoyl Transferase 1,CPT1)的Mrna表达量[4]。Yoshikawa 等研究发现,PUFA通过抑制LXR及SREBP-1c表达调控脂质生成过程[23],提示FTZ可能是通过增加肝脏内PUFA含量改善体内的脂代谢。在体外研究中,FTZ可降低Hepg2细胞胰岛素抵抗模型上清液中葡萄糖含量,下调核因子活化B细胞Κ轻链增强子(Nuclear Factor Kappa-Light-Chain-Enhancer Of Activated B Cells,NFΚB)、肿瘤坏死因子α(Tumor Necrosis Factor,TNF-α)、白介素6(Interleukin-6IL-6)的蛋白表达,上调磷酸肌醇3激酶(Phosphoinositide 3-kinase,PI3K)、胰岛素受体底物1(Insulin Receptor Substrate 1,IRS1)和葡萄糖转运蛋白4(Glucose Transporter Type 4,GLUT4)的蛋白表达[24,25]。已有研究表明C20∶5n-3具有抑制白介素1β(IL-1β)、TNF-α和IL-6等促炎性炎症因子的作用[26]。Cheng等发现中枢细胞暴露于C20∶4中可引起瘦素抵抗,并伴PI3K相关信号传导缺陷[27];Gonzalez-Periz等发现膳食摄入N-3 PUFA可以通过参与葡萄糖转运(GLUT-4),胰岛素受体信号转导(IRS-1)增加肝脏的胰岛素敏感性并且减轻肝脏脂肪变性[28];提示FTZ改善肝脏的代谢功能可能与调控C20∶5n-3、C20∶4、N-3 PUFA等脂肪酸相关。FTZ除了可能通过调控不饱和脂肪酸代谢机制或者是通过调节不饱和脂肪酸的内源性生成机制,亦有可能是通过调节肠道菌群改变脂肪酸代谢等机制,FTZ调节体内脂肪酸代谢的具体机制还需要进一步探讨。

图5 FTZ通过调节脂肪酸组成改善肝脏脂代谢的潜在机制
中医药防治糖脂代谢病有着悠久的历史,大量的实验研究表明,有相当数量的中药及天然药物具有改善胰岛素抵抗、降血糖、降血脂、抗非酒精性脂肪肝等作用。中医药干预糖脂代谢紊乱具有多途径、多靶点、毒副作用小的作用特点。现代中医家多认为糖脂代谢紊乱的关键病机在于脾的分清泌浊功能失调和肾的气化功能失职,治疗上多从“脾”、“肾”论治[29-31]。FTZ作为郭姣教授基于“调肝启枢化浊”理论临床治疗糖脂代谢病的代表方,具有改善糖脂代谢紊乱、抗非酒精性脂肪肝、治疗高脂血症等临床药效。本研究主要是通过GC-MS检测肝脏脂肪酸组分,更精准地探索各类型的不同脂肪酸对机体的影响,并且给中医药复方方剂精准评价提供有效的依据。肝脏脂肪酸代谢作为肥胖、2型糖尿病、高脂血症、及动脉粥样硬化等糖脂代谢紊乱疾病发生与发展的重要机制之一,也是干预治疗糖脂代谢病的关键途径之一。本实验结果表明,FTZ可明显改善高脂饮食导致的脂代谢紊乱小鼠肝脏的脂肪酸代谢,其机制可能与降低其肝脏中的饱和脂肪酸、升高肝脏中的多不饱和脂肪酸相关,为进一步精准阐明FTZ调控体内脂肪酸代谢的作用机制提供基础依据。

