舒尼替尼对胃癌细胞BGC-823增殖的影响及机制
杨 旭 刘春灵 徐宛玲 马永超
(漯河医学高等专科学校, 漯河 462000)
胃癌在世界范围内,其发病率和死亡率分别居第4位和第2位[1],在中国其发病率和死亡率分别居第2位和第3位。仅2011年,全球范围内胃癌预测新发近100万例,死亡约70万例[2]。近些年来,多靶点抗癌药物研发已经成为新型肿瘤治疗药物研发的焦点。舒尼替尼(sunitinib)是一类口服的小分子多靶点受体酪氨酸激酶抑制剂,具有抗肿瘤血管生成和直接攻击肿瘤细胞的双重抗肿瘤作用[3]。已有研究表明,舒尼替尼在肾细胞癌和胃肠间质瘤,神经内分泌肿瘤、乳腺癌等实体肿瘤中显示出明显的抗肿瘤效应[5-6]。Notch信号通路是一类进化高度保守的细胞信号通路,其主要特点是通过细胞间的配体-受体相结合的方式发挥作用。Notch信号通路在维持细胞的自我更新、生长、分化等过程中发挥着重要作用,其在调控细胞的凋亡过程中亦起着极为重要的作用。但目前用舒尼替尼诱导胃癌细胞凋亡及对Notch信号通路影响的研究较少,本研究通过利用不同浓度舒尼替尼对胃癌细胞的增殖、凋亡及对Notch1基因表达的影响,为胃癌的临床治疗提供重要的实验理论基础,为Notch1信号通路作为潜在的治疗靶点提供理论支持。
1 材料和方法
1.1 化学物
舒尼替尼购自美国辉瑞,溶于二甲基亚砜(DMSO),母液浓度为100μmol/L。
1.2 细胞培养
人胃癌细胞系BGC-823培养于含有10%胎牛血清、100IU/ml青霉素、1μɡ/ml链霉素的DMEM的培养基中。置于含有5% CO2、37℃恒温培养箱。在16cm2的培养瓶中培养至细胞汇合度达到80%~90%,0.5%胰蛋白酶进行消化传代。取对数生长期的细胞进行实验。
1.3 MTT法检测BGC-823细胞的增殖
消化、收集细胞,细胞计数并调整细胞浓度为2×104,每孔取100μl接种于96孔板培养,待细胞贴壁后。加入终浓度分别为10、5、2.5、1.25、0.625、0.3125、0.15625μmol/L 的舒尼替尼每孔150μl,每个浓度设3个复孔,对照孔只加入等量的培养基即可,分别作用24、48、72、96h。加入20μl MTT(5mg/ml,Sigma公司)在37℃恒温培养箱继续孵育4h。之后,扣掉上清液,加入150μl DMSO,在摇床上缓慢震荡直至蓝色结晶充分溶解。利用全自动酶标仪检测细胞在490nm波长的吸光度(OD值)。公式: 细胞增殖抑制率(%)=[1-(实验组/对照组)]×100。计算50%细胞生长抑制所需的药物浓度(IC50)及不同浓度的舒尼替尼对细胞增殖的抑制效应。以药物浓度为X轴,细胞增殖抑制率为Y轴作图,从图中求出半数抑制浓度(IC50)。
1.4 免疫荧光法检测胃癌细胞中Notch-1的表达
对数生长期细胞接种至6孔中,加入3种药物浓度分别作用48h后,取出细胞爬片放入干净的6孔板中(注意正面朝上),用PBS洗涤盖玻片3次,加入4%多聚甲醛2ml室温静置约30min;PBS洗涤3次每次5min,缓摇。吸干PBS,加入含0.2% Triton X-100、1% BSA的PBS约1ml;冰上静置5min;PBS浸洗3次,每次5min。吸干PBS后于6孔板相应孔中加入1ml 1% BSA,室温封闭1h;PBS洗涤3次,每次5min。孵育一抗,各抗体使用1% BSA按适当滴度(1∶100)稀释滴在盖玻片上4℃缓摇过夜。阴性对照不加入一抗,使用PBS代替。孵育二抗,FITC荧光标记二抗用1%BSA按适当滴度(1∶500)稀释滴在盖玻片上,室温避光静置1h。加入5μg/ml DAPI染色2min,荧光显微镜下检测相应荧光强度。
1.5 蛋白质免疫印迹检测
收集不同舒尼替尼药物浓度干预48h的细胞,预冷PBS洗细胞2次,加入1×细胞裂解缓冲液RIPA 100μl,冰浴裂解细胞30min,每10min振动一下,12000r/min离心5min,加入等体积的蛋白变性剂,100℃作用5min,备用。湿转法转移凝胶中蛋白至PVDF膜上。5%脱脂奶粉4℃封闭过夜,TBST洗膜,加入兔抗人一抗(用封闭液按1∶200稀释)4℃孵育过夜(Notch-1、β-actin购自Sigma公司;caspase-3、caspase-9购自武汉博士德科技有限公司)。TBST洗膜3次,加入辣根过氧化物酶(HRP)标记的山羊抗兔二抗(按1∶5000稀释)室温孵育1h。等体积加入A液及B液,LAS3000显影曝光,图像经Image J软件分析测定蛋白丰度。
1.6 统计学处理
2 结果
2.1 不同浓度舒尼替尼、不同作用时间对细胞BGC-823增殖的抑制情况
舒尼替尼终浓度10、5、2.5、1.25、0.625、0.3125、0.15625μmol/L作用24、48、72、96h后显示舒尼替尼对BGC-823细胞生长具有增殖抑制作用(图1),抑制效果呈浓度依赖性,半数抑制率IC50为0.5928μmol/L,药物作用时间为48h,舒尼替尼不同浓度的增殖抑制率差异有统计学意义(P<0.05)。

图1 不同浓度舒尼替尼、不同作用时间对细胞增殖的影响
2.2 不同浓度舒尼替尼促进细胞BGC-823的凋亡情况
终浓度为0.25、0.50、1.00μmol/L舒尼替尼作用细胞株BGC-823 48h后,形态学及免疫荧光均显示细胞数目明显少于对照组,细胞核染色显示实验组随着药物浓度的增加,凋亡细胞明显增多,细胞出现核固缩、体积缩小或核碎裂的现象,出现较深的蓝色荧光。且随着药物浓度的增加,处于凋亡晚期细胞明显增多(图2)。通过选9个视野下的细胞进行细胞计数,统计细胞的凋亡情况,统计结果见表1。免疫荧光检测Notch-1蛋白表达实验结果表明,舒尼替尼抑制细胞增殖、诱导细胞凋亡可能是通过促进Notch-1蛋白表达发挥作用的。
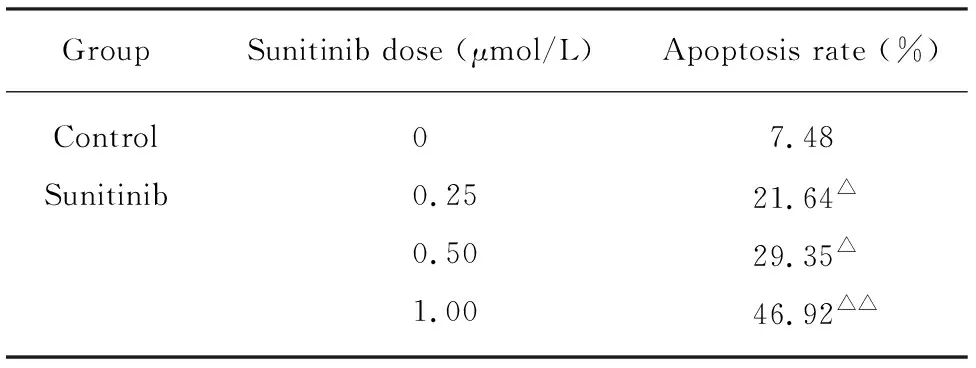
表1 舒尼替尼诱导细胞BGC-823的凋亡率
△P<0. 05,△△P<0. 01vscontrol group

图2 免疫荧光检测不同浓度舒尼替尼对细胞BGC-823凋亡和Notch-1蛋白表达的影响,×100
2.3 不同浓度舒尼替尼对凋亡信号通路相关蛋白Notch-1、caspase-3、caspase-9表达的影响
0.25、0.50、1.00μmol/L舒尼替尼作用BGC-823细胞48h后,Notch-1蛋白的表达量随药物浓度的增加而明显降低,同对照组相比,各浓度组舒尼替尼均能降低Notch-1蛋白的表达水平。同时,经过舒尼替尼处理后,BGC-823细胞凋亡相关基因caspase-9、caspase-3的蛋白表达水平随药物浓度的增加而增加,图像经Image J软件分析,结果显示,各组间比较差异均有统计学意义(P<0.05),表明了这些凋亡相关基因参与了细胞凋亡的过程,实验组与对照组相比凋亡相关蛋白表达均明显增多(图3)。
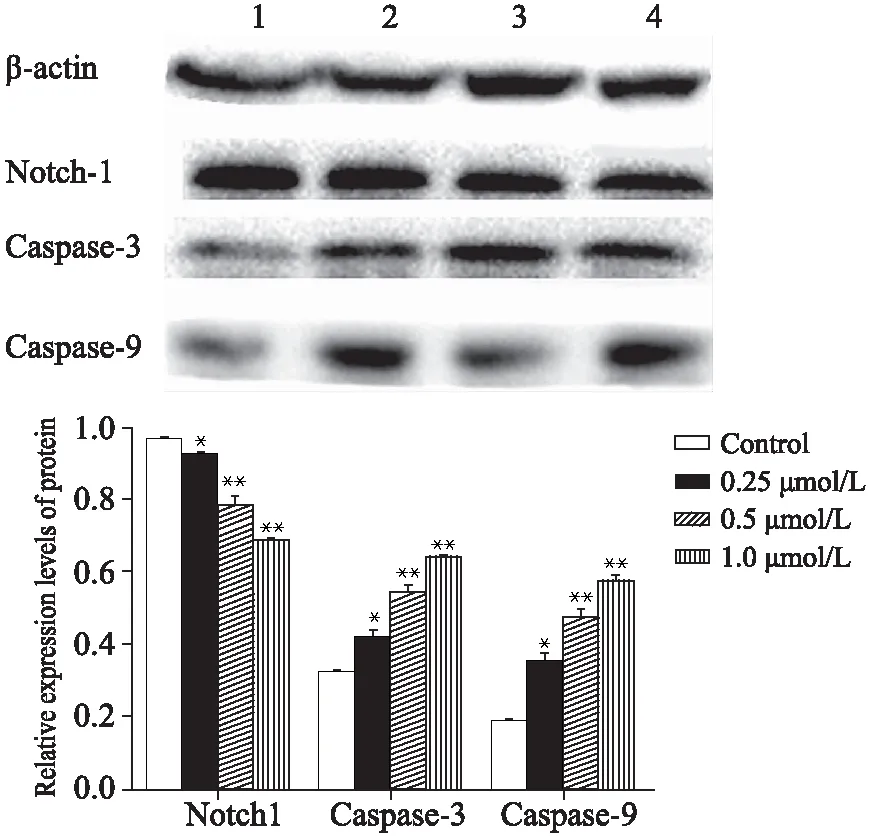
图3 不同浓度舒尼替尼对胃癌细胞BGC-823蛋白表达水平的影响
3 讨论
胃癌是一种源自胃部黏膜上皮的恶性肿瘤。手术治疗胃癌的5年生存率仅30%左右[7],目前为止多种酪氨酸激酶抑制剂不断大量的涌现,但肿瘤耐药为进一步的治疗效果带来了难题。舒尼替尼是一类新型的吲哚类口服类多靶点酪氨酸激酶抑制剂,已被用于治疗肾癌(晚期)和对伊马替尼抵抗或(失败)的胃肠道间质瘤[8],并且临床研究显示在乳腺癌、神经内分泌肿瘤、非小细胞肺癌等多种肿瘤中也具有明显的抗肿瘤效应[9-10]。
Notch信号通路是介导细胞和细胞之间直接接触的主要信号通路之一,调控细胞增殖、分化和凋亡,并有研究表明其失调与多种肿瘤的发生、发展密切相关,在多种肿瘤中由于其表达水平增高而起促癌的作用,如乳腺癌、神经胶质瘤等肿瘤;由于其复杂多样性,而在皮肤癌、甲状腺癌、宫颈癌等中却起到抑癌作用[11]。Notch基因是Morgan于1917年在果蝇体内发现的,Notch受体是由Notch基因编码的约300kD的单跨膜蛋白[12]。Notch信号通路由Notch受体、配体、CSL-DNA 结合蛋白等组成。细胞Notch受体和配体的结合引起Notch信号通路的激活。Notch的活化形式为胞内区域(notch intracellular domain, NICD),通过激活下游靶基因转录而发挥一连串的生物学作用[13]。
本研究MTT结果显示,不同终浓度舒尼替尼作用24、48、72、96h后显示,舒尼替尼对BGC-823细胞生长具有明显抑制作用,抑制效果呈浓度及一定的时间依赖性,不同浓度舒尼替尼的增殖抑制率差异有统计学意义(P<0.05),半数抑制率IC50为0.5928μmol/L。细胞形态学观察可见,随着药物浓度的增加,细胞数目明显减少,免疫荧光检测显示不同药物浓度组随着药物浓度的增加凋亡细胞明显增多,细胞出现核固缩、体积缩小或核碎裂的现象,出现较深的蓝色荧光。且随着药物浓度的增加,处于凋亡晚期的细胞明显增多。实验结果表明,舒尼替尼抑制细胞增殖可直接通过诱导细胞凋亡来实现。免疫印迹检测结果显示Notch-1蛋白的表达量随药物浓度的增加,灰度明显降低,同对照组相比,各浓度组舒尼替尼均能降低Notch-1蛋白的表达水平。同时,经过舒尼替尼处理后,BGC-823细胞凋亡相关基因caspase-9、caspase-3的蛋白表达水平条带灰度也随药物浓度的增加而加深,实验组与对照组相比凋亡相关蛋白表达均明显增多,实验结果提示舒尼替尼作用后可以调节Notch-1的表达,诱导凋亡相关蛋白的表达量增加,进而促进细胞的凋亡,其中caspase-9 0.5μmol/L浓度组蛋白灰度稍淡些,考虑可能是加样时造成的样品量减少而引起的。
综上所述,舒尼替尼作为一种口服酪氨酸激酶抑制剂可抑制多个靶点,通过对细胞BGC-823的Notch信号通路的调节,促进胃癌细胞的凋亡,但是由于Notch信号通路的复杂多样性,并参与多种病理和生理过程,其在不同起源的肿瘤或者同一肿瘤的不同阶段,可能发挥着不同的作用,其与疾病发生的某些分子机制目前还不太明确,所以需要进一步研究Notch信号通路在疾病中的分子作用机制,为疾病的靶向药物治疗提供新的指导思路。