干预膜联蛋白A4表达对结直肠癌细胞增殖、侵袭和转移能力的影响
孙 雨 张 静 赵咫龙 佟 青 李 博
(锦州医科大学附属第三医院普外科,辽宁 锦州 121000)
结直肠癌发病率在全球排名第三,每年的新增患者约130万例〔1,2〕。结直肠癌不仅受遗传、环境、生活方式、致癌物与饮食等多种因素的影响,同时也与癌基因、抑癌基因、信号传导通路、细胞增殖和细胞凋亡等异常关系密切。部分患者就诊时多为中晚期,常伴有淋巴结转移等现象,且错过了手术治疗的最佳时期,而放化疗也有自身的局限性,导致死亡率一直居高不下。膜联蛋白(ANX)家族是一种Ca2+依赖磷脂结合蛋白的超家族,在细胞增殖、侵袭和凋亡等生理活动中具有重要作用〔3~5〕。ANXA4是ANX家族中的重要成员,在肝门部胆管癌、卵巢癌和子宫内膜癌等肿瘤组织中高表达,且在细胞增殖和黏附等生理活动中发挥重要作用〔6~9〕。有研究指出ANXA4在结直肠癌中高表达,提示其可能在结直肠癌的发生发展中扮演重要角色〔10〕。本研究拟探讨干预ANXA4表达对结直肠癌细胞增殖、黏附、剥脱和侵袭能力的影响。
1 材料与方法
1.1细胞 正常结肠上皮NCM460细胞、结直肠癌HCT116细胞均购于美国ATCC。
1.2主要试剂 siRNA-ANXA4和阴性对照购于美国Origene公司。胰蛋白酶、胎牛血清(FBS)和无血清细胞培养基(RPMI)1640购于美国Gibco公司,聚偏氟乙烯(PVDF)膜购于Milipore 公司;四甲基偶氮唑盐(MTT)试剂、Trizol试剂和放射免疫沉淀法(RIPA)细胞裂解液购于上海碧云天公司,二喹啉甲酸(BCA)蛋白浓度测定试剂盒、逆转录试剂盒、电化学发光(ECL)检测试剂盒和lipofectamineTM2000购于美国Invitrogen公司。辣根过氧化物酶标记羊抗兔/鼠(HRP-IgG)二抗、ANXA4抗体、埃兹蛋白(Ezrin)抗体、骨桥蛋白(OPN)抗体、细胞表面黏附分子(CD44v6)抗体和β肌动蛋白(β-actin)抗体购自美国Santa Cruz公司。引物由上海生工合成。
1.3方法
1.3.1细胞培养 HCT116和NCM460细胞采用含10%FBS的RPMI1640培养液,于CO2浓度50 ml/L、温度37℃的恒温培养箱中培养。当细胞80%贴壁时,以浓度25 g/L胰蛋白酶消化传代。收集生长情况好HCT116和NCM460细胞进行实验。
1.3.2ANXA4 mRNA检测 采用Trizol法提取HCT116和NCM460细胞的总RNA,并用Nanodrop 2000对其进行定量。取2 μl RNA模板,采用逆转录试剂盒获取cDNA。先配制包含1 μl cDNA、1 μl正反向引物、10 μl 2×SYBR Premix Ex TaqⅡ和7 μl ddH2O的反应体系,上PCR仪,在循环参数95℃ 5 min(1×)、95℃ 30 s(35×)、60℃ 30 s(35×)、72℃ 30 s(35×)和72℃ 6 min(1×)条件下扩增,获取产物。每种细胞设置3个平行。以β-actin为内参,2-△△CT法计算ANXA4 mRNA的相对表达量。其中,ANXA4正向引物为5′-ACCAGCAGCAATATGGACGG-3′,反向引物为5′-TTCACCTCATCTGTCCCCCA-3′;β-actin正向引物为 5′-AGCGCAAGTACTCCGTGTG-3′;反向引物为 5′-AAGCAATGCTATCACCTCCC-3′。
1.3.3ANXA4蛋白检测 取HCT116和NCM460细胞,采用RIPA细胞裂解液提取两种细胞的总蛋白,并以BCA试剂盒定量。取变性后的总蛋白60 μg,每份设3个平行孔,上样至聚丙烯酰胺凝胶(浓度120 g/L)中电泳至分离。取出凝胶,以半干法转PVDF膜。经TBST(Tween+Tris-HCl缓冲盐溶液)封闭液处理后,加入ANXA4(1∶250稀释)和β-actin(1∶1 000稀释)一抗反应过夜,经TBST漂洗后,加入HRP-IgG(1∶2 000)二抗,待充分反应后洗膜。以ECL试剂盒显影,E-Gel Image凝胶成像系统成像,QuantityOne软件对ANXA4蛋白进行定量分析。
1.3.4分组和转染 取对数生长期的HCT116细胞,以胰酶消化后计数。配制成浓度为4×106个/ml的细胞悬液。取6孔细胞板,以每孔1 ml悬液接种。于第2日,以lipofectamineTM2000试剂按照下列分组进行转染。将HCT116细胞随机分为Control组、NC组和ANXA4组。将配制好的含有250 μl无血清培养液、20 μl lipofectamineTM2000和5 μl ANXA4-siRNA/阴性对照的混合液加入ANXA4组/NC组进行转染,Control组加入等量的无血清培养液和lipofectamineTM2000混合液。转染4 h后更换培养液,继续培养48 h后收集各组细胞,以1.3.2和1.3.3中的方法检测干预效果。
1.3.5细胞增殖实验 取上述实验中转染后培养48 h后的Control组、NC组和ANXA4组细胞,胰酶消化计数后,以每孔200 μl细胞悬液(浓度5×106个/ml)接种至96孔细胞板上。分别在培养48、72和96 h后,加入20 μl浓度为5 mg/ml MTT溶液,培养4 h后,加入150 μl二甲基亚砜,待充分震荡反应结束,以酶标仪检测各组HCT116细胞在490 nm处的吸光度(OD)值。
1.3.6细胞黏附实验 以Matrigel基质胶铺96孔板(每孔15 μl),加入小牛血清封闭。取对数生长期的Control组、NC组和ANXA4组细胞,制备浓度为5×105个/ml悬液,以每孔100 μl接种到经Matrigel基质胶包被的细胞板上。常温反应3 h后,以磷酸缓冲液洗涤,加入MTT溶液10 μl,培养4 h后,弃培养液。加入150 μl二甲基亚砜震荡溶解10 min。上酶标仪检测490 nm处的OD值。细胞黏附率=(实验组OD值/对照组OD值)×100%。每组设5个复孔。
1.3.7细胞剥脱实验 取转染后生长良好的Control组、NC组和ANXA4组细胞,常温下,以胰酶消化(浓度为0.02%)反应10 min,以磷酸缓冲液洗涤后,收集剥脱的HCT116细胞,统计剥脱及黏附细胞。细胞剥脱百分比=剥脱细胞数/(剥脱细胞数+黏附细胞数)。
1.3.8细胞侵袭实验 取Transwell小室,在上室膜内侧加入Matrigel基质胶30 μl,风干。收取Control组、NC组和ANXA4组细胞,以培养液调整细胞浓度后,在小室上室中加入200 μl浓度为5×105个/ml细胞悬液。在小室下室中,加入500 μl含10%FBS培养液。常规条件下培养1 d后,将Transwell小室上室细胞擦去,以4%甲醇固定并风干,加1%结晶紫进行染色。30 min后,洗膜。显微镜观察并统计细胞数(随机选取5个视野)。每组实验设3个平行实验。
1.3.9Ezrin、OPN和CD44v6蛋白检测 收集生长状况良好的Control组、NC组和ANXA4组细胞,经总蛋白提取、电泳、转膜和封闭后,加入Ezrin(1∶500稀释)、OPN(1∶800稀释)、CD44v6(1∶500稀释)和β-actin(1∶1 000稀释)一抗和HRP-IgG(1∶2 000)二抗,ECL显影曝光后,收集图片,以QuantityOne软件对各组细胞中Ezrin、OPN和CD44v6蛋白进行定量分析。步骤见1.3.3。
1.4统计学分析 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1ANXA4在HCT116细胞中的表达及转染效果鉴定 与正常结肠上皮NCM460细胞(1.03±0.12,4.85±0.56)相比,结直肠癌HCT116细胞中ANXA4 mRNA和蛋白表达(0.51±0.12,1.38±0.26)均显著降低(P<0.05)。见图1。转染后,ANXA4组HCT116细胞中ANXA4 mRNA和蛋白表达显著低于Control组(P<0.05);而NC组与Control组组间,差异无统计学意义(P>0.05)。见图2和表1。
2.2干预ANXA4表达对HCT116细胞增殖能力的影响 NC组与Control组OD值随时间延长差异无统计学意义(P>0.05)。48 h时,ANXA4组与Control组OD值差异无统计学意义(P>0.05),但在72和96 h时,OD值均显著低于Control组(P<0.05)。见表2。

图1 Western印迹检测各细胞ANXA4蛋白表达

图2 Western印迹检测转染后各组HCT116细胞中ANXA4蛋白表达结果
2.3干预ANXA4表达对HCT116细胞黏附和剥脱能力的影响 与Control组相比,NC组中HCT116细胞黏附率和剥脱百分比差异均无统计学意义(P>0.05),而ANXA4组均显著降低(P<0.05)。见表3。
2.4干预ANXA4表达对HCT116细胞侵袭的影响 ANXA4组侵袭细胞数〔(56.4±3.8)个〕明显少于Control组〔(145.5±8.3)个,P<0.05〕,而NC组〔(133.2±10.6)个〕较Control组差异无统计学意义(P>0.05)。
2.5干预ANXA4表达对HCT116细胞中Ezrin、OPN和CD44v6蛋白的影响 NC组细胞中Ezrin、OPN和CD44v6蛋白表达水平与Control组差异无统计学意义(P>0.05),而ANXA4组均显著低于Control组(P<0.05)。见图3和表4。
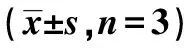
表1 各组ANXA4 mRNA和蛋白表达比较
与Control组比较:1)P<0.05;下表同

表2 干预ANXA4表达对各组HCT116细胞增殖的影响值)

表3 干预ANXA4表达对HCT116细胞黏附和剥脱能力的影响

图3 Western印迹检测各组细胞中CD44v6、OPN和Ezrin蛋白表达
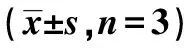
表4 各组细胞中CD44v6、OPN和Ezrin蛋白的相对表达量
3 讨 论
ANXA4可以同Ca2+结合,影响多种基因的转录活性,参与依赖于Ca2+途径的生物学活动,如细胞增殖、侵袭和转移等〔7〕。ANXA4在乳腺癌、肝癌和宫颈癌等多种肿瘤组织中高表达,与肿瘤转移和预后不良等关系密切〔11~13〕。李泰阶等〔9〕发现,在肝癌MHCC97H细胞中干扰ANXA4表达后,细胞黏附能力显著受到抑制。Kakubari等〔14〕和Mogami等〔15〕指出在卵巢癌细胞中,反义寡核苷酸Annexin A4或敲除ANXA4可以提高RMG-1细胞的顺铂耐药性,引起OVTOKO细胞生长迟缓、细胞迁移及侵袭能力下降。研究报道,Annexin A4在结直肠癌中表达上调〔16〕,但其对结直肠癌细胞生物学特性影响的报道较少,其作用机制也并不明确。本研究结果发现,干预ANXA4表达能够抑制结直肠癌HCT116细胞的增殖、黏附、剥脱和侵袭能力,且高表达的ANXA4在结肠癌的发生发展过程中发挥重要作用。
CD44家族是一类高度特异性的膜糖蛋白家族,在细胞的特异性黏附过程中发挥重要作用。CD44v6是CD44家族中研究较多的一种细胞表面黏附分子,与多种肿瘤黏附、侵袭和转移等关系密切。OPN是一种磷酸化的糖蛋白,可以与CD44结合,促进肿瘤细胞的转移。Ezrin蛋白是一种与膜连接的骨架蛋白,可以与CD44形成复合物,影响细胞间的黏附能力,进而影响细胞的浸润与转移。CD44V6、OPN和Ezrin在结直肠癌中均高表达,与浸润深度、淋巴结转移、早期复发和不良预后密切相关〔17~19〕。本研究提示,在结直肠癌中,ANXA4可能通过调控Ezrin、OPN和CD44v6蛋白表达促进细胞增殖、黏附、剥脱和侵袭等生物学行为。
综上,干预ANXA4表达能够抑制结直肠癌HCT116细胞的增殖、黏附、剥脱和侵袭能力,其分子机制可能与下调Ezrin、OPN和CD44v6蛋白表达有关。ANXA4可能是治疗结直肠癌复发和转移的有效靶点。

