西洛他唑对大鼠心室肌Ito及ICa-L离子通道的影响
吴英乐,李广平,何 蓉,李 健,董平栓
西洛他唑(cilostazol)是一种抗血小板聚集药物,最初是作为治疗间歇性跛行的药物,于1999年被美国FDA批准上市,其药理活性成分为其代谢产物3,4-二氢-西洛他唑和4’-顺式-羟基-西洛他唑,其通过高效选择性抑制磷酸二酯酶(phosphodiesterase, PDE)Ⅲ的活性,维持腺苷酸环化酶(adenylate cyclase, AC)活性,防止AC降解,使具有抗血小板聚集、扩张血管等作用的环磷酸腺苷(cyclic adenosine monophosphate, cAMP)含量升高[1],达到抗血小板聚集及防止血管堵塞的目的。在治疗慢心率房颤、病窦综合征及二度Ⅰ型房室传导阻滞的过程中,研究者发现西洛他唑可使心率有所提升,可明显改善心脏的自律性[2-7]。也有研究认为给予Brugada综合征患者西洛他唑药物治疗后,室颤的发生概率显著降低[8],而具体机制并不清楚。本研究通过不同给药方式,给予大鼠西洛他唑,监测大鼠心肌细胞瞬间外向钾电流(Ito)以及其L型钙离子流(ICa-L)的变化,探讨该药物在治疗心律失常方面的作用。
1 对象及方法
1.1对象
1.1.1实验动物清洁级健康雄性Spraque-Dawley大鼠(北医动物中心)20只,体质量300~350 g。
1.1.2实验分组雄性SD大鼠随机分组:对照组10只,正常喂养3~4周;观察组10只,在正常喂养基础上,使用灌胃法给予西洛他唑每日10 mg·kg-1(西洛他唑正常成人常规用量为100 mg·d-1,按照等效剂量换算,大鼠用量约为10 mg·kg-1),喂养3~4周。
1.2单个细胞分离方法
1.2.1溶液配制500 mL无钙台式液:10倍台式液母液50 mL,1 360 mM NaCl母液50 mL,HEPES 1.192 g,Glucose 0.901 g,pH值7.40(NaOH),50 mL无钙液2份、冷藏/冻存。 100 mL KB液:母液10 mL,Taurine 0.125 g,L-Glutamic Acid 1.029 9 g,EGTA 0.38 g,Glucose 0.18 g,pH用KOH调至7.40,后加入BSA 0.5 g。生理台式液500 mL:母液50 mL,1 360 mM NaCl 50 mL、HEPES 1.192 g、Glucose 0.901 g,1 M CaCl20.9 mL,pH用NaOH调至7.40。60 mL酶液:胶原酶Ⅱ0.02 g(worthington)、BSA 0.12 g、50 mM CaCl20.1 mL (Ca2+浓度50~80 μM),定容。西洛他唑(cilostazol)溶于二甲亚砜配制成母液,使用时再次稀释,西洛他唑浓度分别达到2 μmol·L-1及50 μmol·L-1。西洛他唑在人体内环境可达的最大血药浓度为2 μmol·L-1。
1.2.2心室肌细胞分离采用胶原酶Ⅱ酶解法:喂养3~4周后的两组大鼠使用10%水合氯醛300 mg·kg-1腹腔注射麻醉后开胸取心,主动脉插管,在通100%O2条件下进行灌流。依次用无钙台氏液(5~6 min )、含0.033%胶原酶Ⅱ(worthington)的无钙台式液(13~15 min)进行灌流。之后,取右心室心肌组织,将其置于KB溶液中剪碎、吹打并过滤,将滤出液用KB液稀释2倍后进行离心,后将细胞沉渣以KB液稀释至40 mL,置于50 mL小烧杯中,室温静置1h备用。高质量的单细胞标本可供8~12 h的膜片钳实验。
1.3心肌细胞离子通道记录方式①将大鼠右心室肌单细胞标本导入灌流池,使用膜片钳技术记录两组大鼠的心室肌细胞的Ito和ICa-L。②将浓度为50 μmol·L-1或2 μmol·L-1的Cilostazol溶液注入细胞外灌流液,进行灌流—洗脱实验,记录给药及洗脱后的Ito离子通道的变化。
1.4心肌细胞离子通道记录方案①Ito:钾电流电极内液及NMDG无钠液为细胞外液。HP:-40 mV失活钠电流,TP:-50 mV~+60 mV,阶跃+10 mV,Time 300 ms,刺激0.5 Hz,采样20 kHz,低通滤波频率5 kHz。②ICa-L记录方案:钙电流电极内液及生理台式液为细胞外液,HP:-40 mV,TP-50 mV~+60 mV,阶跃+10 mV,Time 200 ms,刺激0.2 Hz、采样20 kHz,低通滤波频率5 kHz,采用P/N漏减(n=4,滤波时间180 ms)。

2 结果
2.1急性药理学试验
2.1.150μmol·L-1西洛他唑对Ito的影响将浓度为50 μmol·L-1的西洛他唑加入灌流池,可以迅速阻滞大鼠心室肌的瞬间外向钾电流(Ito),3 min内达稳态,洗脱药物后,其可基本恢复到对照水平,见图1。
2.1.250μmol·L-1西洛他唑灌流前后对Ito平均电流密度的Ⅰ~Ⅴ曲线的影响将50 μmol·L-1西洛他唑加入细胞外液后数分钟的Ito变化(n=7),与对照组相比,自指令电压+10 mV至最大+60 mV测试电压范围内,西洛他唑灌流后瞬间外向钾电流(Ito)电流密度均小于灌流前,且差异均有统计学意义(P<0.05,n=7),在+60 mV时,两组Ito的电流密度分别为(21.55±2.61) pA/pF和(5.36±2.16) pA/pF(P<0.001),自指令电压+10 mV~+60 mV西洛他唑均可明显抑制Ito,见图2。

西洛他唑可逆性抑制Ito电流:A:给药前Ito基线;B:50 μmol·L-1西洛他唑加入3 min;>西洛他唑灌流—洗脱实验对一个大鼠右心室肌细胞(Cm=90 pF)Ito的影响

图2 50 μmol·L-1西洛他唑灌流前后对Ito平均电流密度的Ⅰ~Ⅴ曲线的影响(n=7)
2.1.32μmol·L-1西洛他唑灌流前后对Ito的影响将浓度为2 μmol·L-1的西洛他唑加入灌流池,此浓度为成人口服常规剂量的西洛他唑可达到的最大血药浓度,观察到西洛他唑可以阻滞大鼠右心室肌的瞬间外向钾电流(Ito),2 min内达稳态,药物洗脱后,Ito可部分恢复到正常水平,见图3。

A:给药前Ito基线;B:2 μmol·L-1 西洛他唑加入2 min;C:洗脱9 min;D:曲线图。图3 2 μmol·L-1西洛他唑灌流—洗脱实验对一个大鼠右心室肌细胞(Cm=140 pF)Ito的影响
2.1.42μmol·L-1西洛他唑灌流前后对Ito平均电流密度的Ⅰ~Ⅴ曲线的影响可见与对照组相比,自指令电压+30 mV至最大+60 mV测试电压范围内,给予西洛他唑灌流后,大鼠右心室肌瞬间外向钾电流(Ito)电流密度均小于灌流前,且均有统计学差异(P<0.05,n=5),在+60 mV时,两组电流密度分别为(18.64±7.89) pA/pF和(7.63±1.78) pA/pF(P=0.02),自指令电压+30 mV~+60 mV西洛他唑均可明显抑制Ito,见图4。
2.2西洛他唑对离子通道的影响
2.2.1西洛他唑对Ito的影响举例绘制观察组Ito电流图样,见图5。
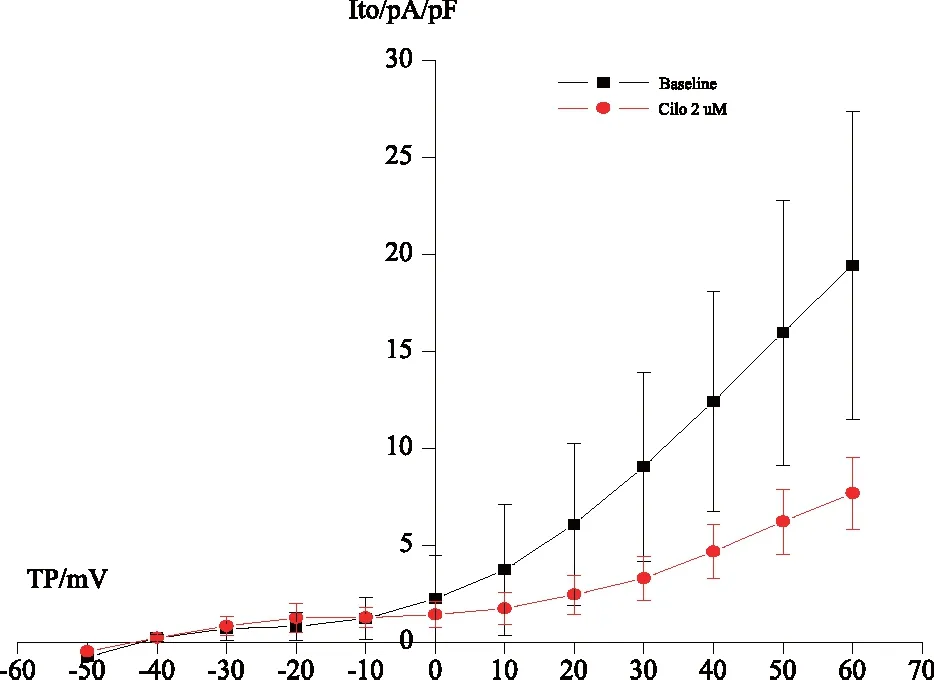
图4 2 μmol·L-1西洛他唑灌流前后对Ito平均电流密度的Ⅰ~Ⅴ曲线的影响(n=5)
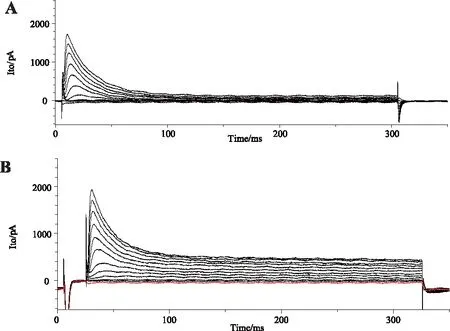
A:对照组(Cm=90 pF) ,B:观察组(Cm=100 pF)。图5 举例Ito电流图样
2.2.2西洛他唑对Ito平均电流密度的Ⅰ~Ⅴ曲线的影响在+60 mV时,对照组Ito电流密度为(20.23±5.64) pA/pF,观察组为(21.74±8.56) pA/pF,P>0.05,两组Ⅰ~Ⅴ曲线无统计学差异,见图6。
2.2.3西洛他唑对L型钙电流(ICa-L)的影响举例绘制对照组及观察组ICa-L电流图样,见图7。

图6 对照组及观察组Ito平均电流密度的Ⅰ~Ⅴ曲线

A: 对照组(Cm=90pF);B:观察组(Cm=100pF)。 图7 举例ICa-L电流图样
2.2.4西洛他唑对ICa-L平均电流密度的Ⅰ~Ⅴ曲线的影响在+10 mV时,对照组ICa-L电流密度为(-6.24±2.64) pA/pFh,观察组为(-5.18±1.35) pA/pF,西洛他唑对两组大鼠心肌的L-型钙通道电流(ICa-L)的Ⅰ~Ⅴ曲线的影响无统计学差异,(P>0.05),见图8。
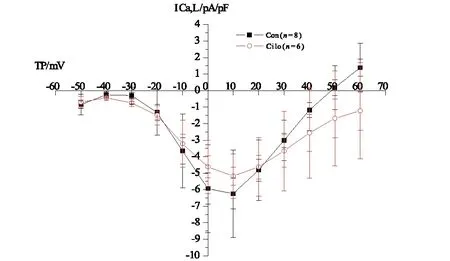
图8 对照组及观察组ICa-L平均电流密度的Ⅰ~Ⅴ曲线
3 讨论
Antzelevitch等[9-12]提出了2相折返(phase 2 reentry)的概念,研究提示室性心律失常可由2相折返引起,即心肌动作电位平台期局部电流可引起折返激动而诱发心律失常。Ito在心外膜和心肌层的密度比心内膜高,当Ito在心肌的这种异质分布因某种病理因素或药物的干预而出现变化时,引起心肌电异质性的增加,心外膜细胞动作电位圆顶消失、时程缩短、平台期消失,进而导致心室肌跨壁复极离散度增大,导致2相折返。目前研究认为Brugada综合征、特发性室速及心肌缺血再灌注性心律失常等多种心律失常均可能与2相折返关系密切。
在对Brugada综合征的研究中发现,心肌细胞内膜和外膜的Ito密度差异显著,外膜Ito密度显著高于心内膜,使得其电压梯度差增加,导致跨壁电流形成,反映在心电图上呈J波和J点抬高,ST段抬高。而后形成跨壁折返微环路正是由跨壁局部电流的作用导致局部的心肌细胞兴奋,外膜层细胞再次激动即2相折返,诱导恶性心律失常的发生。然而在目前的临床治疗中,对此类恶性心律失常唯一可靠的治疗方法仍是安置植入型除颤仪,相关药物治疗的研究进展相对缓慢。理论上,通过减少Ito离子通道电流或增强ICa-L增加内向电流,抑制2相折返的发生,即可维持心外膜动作电位的正常形态[8,13-14],达到预防此类恶性心律失常发生的目的。
有研究表明Brugada综合征患者的恶性心律失常可以被西洛他唑有效地预防[8,15],其机制可能是:①在起搏细胞中,ATP和腺嘌呤衍生物有潜在的增强负性变时作用,西洛他唑有提升心率的正性变时作用,其机制是使心肌细胞对腺苷摄取减少,在此基础上有效抑制了瞬间外向钾电流(Ito)。②瞬间外向钾电流(Ito)被抑制后,紧随其之后开放的离子通道都会延迟开放,达到延迟ADP的作用。③细胞内的磷酸二酯酶(PDE)Ⅲ的活性可被西洛他唑选择性抑制,PDEⅢ降解AC的作用减弱,维持细胞内较高的cAMP浓度又可通过cAMP/PKA通路增强钙离子电流;同时通过提升心率抑制Ito,也可以增强窦房结的ICa-L(8)。综上,西洛他唑一方面抑制 Ito,另一方面增强ICa-L,维持心肌动作电位同质性,预防2相折返的发生,预防此类恶性心律失常的发生。
但国内外对于使用膜片钳技术观察西洛他唑对Ito和ICa-L影响的相关报道较少。本实验通过急性药理试验(灌流—洗脱实验),利用全细胞膜片钳技术,监测Ito和ICa-L在西洛他唑影响下的变化情况,结果证明将浓度为50 μmol·L-1及2 μmol·L-1的西洛他唑加入细胞外灌流液,均可明显降低Ito的幅度值。分别由给药前的(21.55±2.61) pA/pF降至(5.36±2.16) pA/pF,及给药前的(18.64±7.89) pA/pF降至(7.63±1.78) pA/pF,差异均有统计学意义。且西洛他唑洗脱后,Ito幅值均可恢复,证明大鼠心室肌细胞Ito的幅值大小可直接受到西洛他唑的影响。其机制可能是直接作用于离子通道(降低活性、减少数量),改变其生物学功能。这说明西洛他唑通过抑制心肌细胞对腺苷的摄取,在提升心率的同时抑制Ito,只是其抑制Ito的继发原因之一。而由于大鼠右心室肌ICa-L自身衰减较快,且用全细胞膜片钳记录ICa-L通道所用的电极内液具有细胞毒性,不能确切记录西洛他唑对离子通道的影响,故本实验未通过急性药理试验来观察西洛他唑对大鼠右心室肌ICa-L的影响。
本实验结果显示,观察组与对照组相比,两组Ito及ICa-L差异无统计学意义(P>0.05)。分析可能是因为:①数据样本量不足,数据可能存在一定不稳定性,存在假阴性的可能。②药物作用于离子通道,改变其生物学功能,发挥其调控作用,是一个长期慢性的过程。本实验给予药物时间为3至4周,可能给药时间不足够长久,离子通道未发生显著的功能变化。③急性药理试验西洛他唑加入细胞外灌流液,直接作用于大鼠心肌细胞,影响其离子通道的开放;临床上患者口服用药在药物效能和作用时间上均达不到基础实验中直接作用于心肌细胞的效果,存在较大的差异性,因此仍需要大量临床及基础研究验证和探讨。
本研究存在一些局限性:①数据样本量不足,结论误差大,不排除假阴性的可能;②本实验仅使用正常大鼠心室肌细胞来观察西洛他唑对Ito和ICa-L离子通道的影响,未模拟心梗或心律失常等实验动物模型,仍需进一步完善。③本研究只观察了西洛他唑对大鼠右心室肌Ito和ICa-L两个离子通道的影响,探讨其可能的抗心律失常作用,然而心房肌细胞的离子通道很可能另有特点,因此仍需要大量科学论据来论证西洛他唑对心肌细胞离子通道的影响和机制。
总之,本实验证明将西洛他唑加入细胞外灌流液,使用膜片钳技术观察其直接作用于大鼠右心室肌细胞,可以抑制Ito,提示西洛他唑可能通过抑制Ito而恢复心肌动作电位平台期和维持动作电位的同质性,从而抑制以2相折返为基础恶性心律失常的发生。

