HMGB1 siRNA对缺氧复氧胃黏膜上皮细胞凋亡的影响及机制
胡 畔, 郭 凡
湖北中医药大学附属医院湖北省中医院&湖北省中医药研究院,湖北 武汉 430061
高迁移率族蛋白B1(high mobility group protein B1, HMGB1)是一种广泛分布于哺乳动物细胞中的高度保守的核蛋白,其可通过与Toll样受体4和晚期糖基化终末产物受体等细胞表面受体结合参与炎症反应,与多种炎症性疾病的发生和发展密切相关[1-3]。越来越多的研究[4-6]发现,HMGB1在肝脏、脑和心脏等器官的缺血再灌注损伤中异常高表达,与组织细胞的凋亡关系密切,但其对胃缺血再灌注损伤的研究较少。研究HMGB1对缺氧复氧胃黏膜上皮细胞凋亡的调控机制对临床防治胃缺血再灌注损伤具有重要意义。缺氧复氧细胞模型(A/R)是研究缺血再灌注损伤的经典细胞模型[7-8],本研究以人胃黏膜上皮GES-1细胞为研究对象,制备A/R细胞模型,利用RNA干扰技术下调GES-1细胞中HMGB1表达,观察HMGB1对缺氧复氧胃黏膜上皮细胞凋亡的影响,并探讨其可能的分子机制,旨在为胃缺血再灌注损伤的防治提供新线索。
1 材料与方法
1.1细胞与试剂人胃黏膜上皮细胞株GES-1购自美国ATCC,DMEM/F12培养基和脂质体2000购自美国Invitrogen公司,胎牛血清购自美国Gibco公司,HMGB1 siRNA和Control siRNA购自Thermo公司。MTT试剂和二甲基亚砜购自美国Sigma公司,NF-κB p65抗体和IκB-α抗体、Cleaved caspase-3抗体、Bcl-2抗体、β-actin抗体和HRP标记的二抗购自美国Santa Cruz公司。总蛋白提取试剂盒和AnnexinⅤ-FIFC/PI凋亡试剂盒购自上海凯基生物公司,LDH ELISA检测试剂盒购自南京建成生物工程研究所,BCA蛋白定量试剂盒购自美国ThermoScientific公司,ECL试剂盒购自美国Pierce公司。
1.2实验分组及处理实验分为4组:对照组、A/R组、A/R+siNC组、A/R+siHMGB1组。对照组:采用DMEM/F12培养基(含质量浓度为100 g/L的胎牛血清)于体积分数为5%的CO2、体积分数为20%的O2和温度为37 ℃的正常条件下培养GES-1细胞。A/R组:采用无糖Krebs-Ringer碳酸氢盐缓冲液于体积分数为5%的CO2、94%的N2、1%的O2和温度为37 ℃的三气培养箱进行缺氧培养。3 h后,改换成DMEM/F12培养基,于正常条件下复氧培养5 h。A/R+siNC组:正常条件下培养GES-1细胞至细胞融合度达75%时,参照转染试剂脂质体2000说明书步骤将Control siRNA转染至GES-1细胞。转染24 h后,参照A/R组的处理方式制备A/R损伤模型。A/R+siHMGB1组:正常条件下培养GES-1细胞至细胞融合度达75%时,参照转染试剂脂质体2000说明书步骤将HMGB1 siRNA转染至GES-1细胞。转染24 h后,参照A/R组的处理方式制备A/R损伤模型。每组实验均重复3次。
1.3MTT法检测细胞活力收集处理后的各组细胞,制备浓度为1×106个/ml的细胞悬液,以每孔2 ml种植于96孔板上。正常条件下培养24 h后,加入质量浓度为5 g/L的MTT溶液20 μl,反应4 h后,再加入二甲基亚枫150 μl震荡反应10 min。以酶标仪检测各组细胞在490 nm处的吸光度(OD)值,根据公式:细胞存活率(%)=(实验组OD值/对照组OD值)×100%计算各组细胞的存活率。
1.4流式细胞仪检测细胞凋亡收集处理后的各组细胞,以质量浓度为25 g/L的胰蛋白酶消化后,1 000 r/min离心5 min(离心半径为10 cm),并用磷酸缓冲液洗涤。加入1×结合缓冲液制备浓度为1×106个/ml的细胞悬液。在含有1×105个细胞的试管中分别加入5 μl Annexin V-FITC和5 μl PI避光反应10~15 min。再补加400 μl结合缓冲液,上流式细胞仪检测。
1.5ELISA法检测LDH含量收集处理后的对照组、A/R组、A/R+siNC组、A/R+siHMGB1组细胞,以每孔2 ml(浓度为1×106个/ml)种植于96孔板上,按照LDH ELISA检测试剂盒检测各组细胞中LDH含量。
1.6Westernblotting检测HMGB1、NF-κBp65和IκB-α、Bcl-2和Bax蛋白表达参照试剂盒步骤提取对照组、A/R组、A/R+siNC组、A/R+siHMGB1组的总蛋白,并进行定量。行SDS-PAGE凝胶电泳、转膜和封闭处理后,加入特异性一抗和HRP标记的二抗,充分反应后,以ECL显影,凝胶成像系统扫描分析。以目的蛋白的灰度值/内参β-actin的灰度值表示目的蛋白的相对表达量。
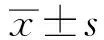
2 结果
2.1各组GES-1细胞中HMGB1的表达比较经A/R处理后,GES-1细胞中HMGB1表达较对照组明显升高,转染HMGB1 siRNA后HMGB1表达显著降低(P<0.05),而转染Control siRNA后未能改变HMGB1的表达(P>0.05)(见图1、表1)。

图1 Western blotting检测各组GES-1细胞中HMGB1蛋白的表达Fig 1 The expression of HMGB1 protein in GES-1 cells of each group detected by Western blotting
2.2各组GES-1细胞活力的比较与对照组相比,A/R处理后GES-1细胞的存活率明显降低,LDH含量明显升高(P<0.05);HMGB1 siRNA能抑制A/R引起的这一变化,使细胞存活率升高,LDH含量降低(P<0.05)(见表2)。

注:与对照组相比,*P<0.05;与A/R组相比,#P<0.05。
2.3各组细胞凋亡情况比较A/R处理后,GES-1细胞的凋亡率较对照组明显升高(P<0.05),HMGB1 siRNA则能够抑制A/R诱导的细胞凋亡(P<0.05)(见图2、表3)。

注:与对照组相比,*P<0.05;与A/R组相比,#P<0.05。

图2 流式细胞仪检测各组细胞的凋亡情况Fig 2 Cell apoptosis in each group detected by flow cytometry

注:与对照组相比,*P<0.05;与A/R组相比,#P<0.05。
2.4各组细胞中TLR4、Bcl-2和Cleavedcaspase-3蛋白表达的比较与对照组相比,经A/R处理后Bcl-2和IκB-α蛋白表达降低,Bax和NF-κB p65蛋白表达升高(P<0.05);而HMGB1 siRNA能够显著上调Bcl-2、IκB-α和下调Bax、NF-κB p65表达,减弱A/R的作用(P<0.05)(见图3、表4)。

图3 Western blotting检测各组细胞中Bcl-2、Bax、NF-κB p65和IκB-α蛋白的表达Fig 3 The expressions of Bcl-2, Bax, NF-κB p65 and IκB-α proteins in cells of each group measured by Western blotting

表4 各组细胞中Bcl-2、Bax、NF-κB p65和IκB-α蛋白的相对表达量Tab 4 The relative expressions of Bcl-2, Bax, NF-κB p65 and IκB-α proteins in each group
注:与对照组相比,*P<0.05;与A/R组相比,#P<0.05。
3 讨论
术后各种应激因素(如失血性休克、创伤和血管炎等)通过释放过量炎性介质引起的胃黏膜细胞自由基过多、钙超载和微循环障碍等胃黏膜损伤即为胃缺血再灌注损伤。探讨胃缺血再灌注损伤的发生机制和改善途径对各种术后并发症的防治具有重要的意义。HMGB1是一种非组蛋白,主要分布在细胞核内,当受到应激刺激时则会被释放到细胞外液中,参与新陈代谢、炎症反应、细胞的增殖、迁移和凋亡等过程;作为与炎症相关疾病关系密切的促炎因子,HMGB1一直是缺血再灌注损伤方面的研究热点。上调HMGB1表达可通过激活TLR4信号通路刺激小鼠的炎症反应和免疫反应,加重肾缺血再灌注损伤[9];而抑制HMGB1表达可减弱脑和肝缺血再灌注损伤[4-5]。HMGB1介导的细胞凋亡在缺血再灌注损伤过程中发挥着重要作用,调控HMGB1介导的细胞凋亡是改善缺血再灌注损伤重要策略。例如,HMGB1中和抗体可通过抑制炎性因子白细胞介素(IL)-1β、IL-6和肿瘤坏死因子-α的产生和逆转大鼠心脏组织中凋亡基因Bax和Bcl-2的表达,减轻失血性休克/复苏大鼠心脏损伤和细胞凋亡[10];此外,采用HMGB1中和抗体能够通过提高细胞活力,减少细胞凋亡改善缺氧复氧诱导的心肌细胞损伤[11]。目前,关于HMGB1与胃缺血再灌注损伤的研究较少。本研究为了探讨HMGB1在胃缺血再灌注损伤中的调控机制,以人胃黏膜上皮GES-1细胞为研究对象,制备A/R细胞模型。采用常规生物学手段检测发现,A/R处理后,GES-1细胞的存活率降低,HMGB1表达、LDH含量和细胞凋亡率升高。LDH是一种稳定的胞浆酶,当胞膜损伤时可被快速释放到细胞培养液中,可被作为判断细胞受损程度的重要指标。利用RNA干扰技术下调GES-1细胞中HMGB1表达后,发现GES-1细胞的存活率升高,HMGB1表达、LDH含量和细胞凋亡率降低。提示,HMGB1在胃缺血再灌注损伤过程中发挥着积极作用。
NF-κB是一种与炎症反应密切相关的核转录因子,NF-κB p65是其重要的成员之一,正常情况下NF-κB p65在细胞质中可与抑制蛋白IκB-α结合形成复合体,当受到外界刺激如缺血再灌注损伤时,IκB-α被磷酸化降解使NF-κB p65活化,激活NF-κB信号通路,调控多种基因的表达,参与细胞的增殖和凋亡等生理过程,与缺血再灌注损伤的发生、发展关系密切[12-14]。Bcl-2和Bax是Bcl-2家族中重要的抗凋亡因子和促细胞凋亡因子,两者在缺血再灌注损伤诱导的细胞凋亡过程中发挥着作用[15]。本研究在制备的A/R细胞模型中发现,Bcl-2和IκB-α蛋白表达下降,Bax和NF-κB p65蛋白表达升高;而转染HMGB1 siRNA后,A/R引起的这一变化得到部分缓解。已有研究[16-17]证实,下调HMGB1表达可抑制NF-κB信号通路的活化,减轻视网膜组织缺血损伤;也可通过上调Bcl-2和下调Caspase-3表达抑制缺氧/复氧的心肌细胞凋亡,改善心肌梗死后的组织损伤。结果提示,HMGB1可通过抑制NF-κB信号通路的活化改善缺氧复氧引起的胃黏膜上皮细胞损伤。
综上所述,缺氧复氧可引起胃黏膜上皮GES-1细胞中HMGB1表达升高,下调HMGB1表达可通过调控NF-κB信号通路抑制缺氧复氧诱导的细胞凋亡。HMGB1在胃缺血再灌注损伤中的扮演着重要角色,抑制HMGB1表达有望成为临床改善胃缺血再灌注损伤的有效途径。

