氯胺酮对帕金森病小鼠模型α-突触核蛋白表达的影响*
王丹丹, 宋俊杰, 慎晓飞, 洪道先, 韩 峰, 李会芳, 王 莹
(河南大学第一附属医院麻醉科, 河南 开封 475000)
帕金森病(Parkinson’s disease, PD)是一种好发于中老年人的进行性、病因不明的神经系统退行性疾病,临床症状以运动迟缓、姿势步态不稳、抑郁及睡眠障碍等为特征,病理显示脑内黑质区多巴胺能神经元减少[1-3],残存的多巴胺能神经元内出现含有不溶性淀粉样蛋白α-突触核蛋白(α-synuclein,α-Syn)包涵体[4],在基因突变和转基因过表达α-syn的小鼠模型中均观察到与PD疾病的密切相关性[5]。在临床观察的案例报告中发现,氯胺酮(ketamine,Ket)对帕金森病静止性震颤症状具有快速抑制作用[6];也有研究表明,氯胺酮不仅可以改善脑供血,还可以抑制中性粒细胞介导的炎症反应,减轻应激性激素和高代谢反应等,通过多种途径抑制小鼠脑中多巴胺能神经元的丢失,提供神经保护作用[7-8];这些作用的产生可能与氯胺酮药物本身高度的极化性、作用于JNK3通路以及NMDA受体功能有关[9-11]。但氯胺酮是否对帕金森病致病特征α-Syn的过表达及异常聚集产生影响未见报道。在啮齿类动物的研究中发现在给予低剂量(5~20 mg/kg)氯胺酮且分次注射时,产生了剂量依赖性增强的抗抑郁和抗运动功能障碍作用[12];也有研究表明,给予亚麻醉剂量氯胺酮(8 mg/kg)时,观察到PD小鼠黑质区酪氨酸羟化酶(tyrosine hydroxylase, TH)阳性神经元表达增多、自噬增强、运动功能改善及神经元保护作用的现象[13]。故本实验利用低剂量(25 mg/kg)的氯胺酮进行研究,旨在初步探讨氯胺酮对小鼠黑质区多巴胺能神经元内α-Syn表达的影响,为临床应用氯胺酮治疗帕金森病提供相关理论依据。
材 料 和 方 法
1 动物及分组
采用SPF级健康雄性C57BL/6小鼠48只,鼠龄8~12周,体重 22~32 g,由北京医科大学实验动物部供应,自由进食喂养,室温(23±2)℃,自然光照,实验前适应喂养2周。实验中小鼠随机均分为对照(NaCl)组、模型(1-甲基-4-苯基-1,2,3,6-四氢吡啶,1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)组和治疗(MPTP+Ket)组,各组分别给予不同的处理方式。
2 主要试剂
盐酸氯胺酮注射剂(ketamine, Ket)由上海第一制药厂提供;MPTP购自Sigma,使用生理盐水配制20 g/L MPTP储存液及2 g/L MPTP腹腔注射液;鼠抗TH单克隆抗体购自Abcam;鼠抗α-Syn单克隆抗体购自BD;鼠抗β-actin单克隆抗体和羊抗鼠Ⅱ抗购自康为世纪公司;HRP标记的羊抗鼠Ⅱ抗购自Boster。
3 主要方法
3.1MPTP-PD小鼠模型制备及动物给药 腹腔内注射神经毒素MPTP能够造成小鼠黑质纹状体区多巴胺能神经元和TH表达减少,并出现类似人类的运动功能障碍,是制备PD模型的常用方法[14-15]。实验小鼠随机均分为3组。MPTP+Ket组给予腹腔注射MPTP (25 mg/kg),30 min后腹腔注射Ket (25 mg/kg);MPTP组给予腹腔注射MPTP (25 mg/kg),30 min后注射与Ket等体积的生理盐水;NaCl组在同等时间给予腹腔注射与MPTP组等体积的生理盐水。3组小鼠连续处理7 d。
3.2Rotarod实验检测小鼠动作协调和平衡能力 将预训练的小鼠置于转杆上,开始爬行后自动记录转杆滚动圈数,至小鼠由转杆掉下来为止。Rotarod实验采用非连续性测量法,测定2次,2次相隔时间1 h。
3.3Gait analysis system检测小鼠步态的变化 将不透明跑道框(10 cm×10cm×50 cm)置于记录纸上,跑道终点侧2/3处有不透明顶盖。将小鼠前爪用棉签涂红墨水标记,后爪涂蓝墨水标记后放入跑道内,对记录纸上的后爪足迹进行分析。每一次实验记录开始后至少连续3步距离,测量连续的2个脚印点间距离及对侧脚印点到该连线的垂直距离,即分别为步长和步宽。
3.4脑组织切片的制备 各组小鼠喂养1个月后,每组随机取4只小鼠用于制作脑组织切片:将实验动物以戊巴比妥钠(10 mg/kg)腹腔注射麻醉,依次灌注生理盐水15 min 和多聚甲醛2 h。灌注完毕后迅速将小鼠置于冰上断头取脑,将脑组织置于4%多聚甲醛中,4 ℃固定24 h。使用振荡切片机将小鼠脑切至30 μm厚切片,置入0.1 mol/L PBS中-20 ℃保存。
3.5免疫组化染色检测小鼠黑质内TH蛋白表达的变化 振荡小鼠脑切片用0.2% Triton通透,10%山羊血清封闭后,加入鼠THⅠ抗(1∶500)室温孵育4 h,加入Ⅱ抗(1∶1 000),室温孵育1 h,DAB染色5~10 min;75%~100%乙醇、乙醇-甲醇混合液(100%乙醇∶甲醇=1∶1)、甲醇梯度脱水,树脂封片,成片于普通显微镜下观察拍照。
3.6免疫荧光染色分析α-Syn的表达 振荡小鼠脑切片用0.2% Triton通透,10%山羊血清室温封闭后,加入鼠α-Syn Ⅰ抗(1∶500)室温孵育4 h,加入Ⅱ抗(1∶1 000),室温避光孵育1 h,DAPI(1∶1 000)复染后于荧光显微镜下观察拍照,表达的α-Syn被荧光Ⅱ抗标记为红色,荧光越强表明α-Syn的表达越多。
3.7Western blot 检测α-Syn蛋白的表达 冠状切出包含黑质及纹状体的脑组织,然后进行匀浆裂解、离心,取上清,于-80 ℃保存,备用脑组织用于蛋白提取。SDS-PAGE分离提取的蛋白,每泳道总蛋白量200 μg。电泳结束后电转至PVDF膜,封闭液封闭1.5 h。α-Syn Ⅰ抗(1∶2 000)4 ℃孵育过夜,HRP标记的Ⅱ抗(1∶4 000)室温孵育1 h,X线胶片曝光,显影、定影。为了证实每个泳道总蛋白量相等,用剥脱液洗膜后,封闭液封闭1.5 h,以β-actin Ⅰ抗(1∶2 000)4 ℃孵育过夜,HRP标记的Ⅱ抗(1∶4 000)室温下孵育1 h,X线胶片曝光,显影、定影。用天能化学发光扫描仪对PVDF膜进行扫描。运用Quantity One系统软件分析条带吸光度。
4 统计学分析
采用SPSS 16.0软件进行统计学分析,计量资料数据均以均数±标准差(mean±SD)表示,多组数据的比较采用单因素方差分析,采用Bonferroni校正的t检验进行多重比较,以P<0.05 为差异有统计学意义。
结 果
1 低剂量氯胺酮改善PD小鼠行为运动特征
与NaCl组比较,小鼠腹腔注射MPTP后,出现了明显的姿势步态不稳、运动迟缓的症状,行为学测试结果显示转棒仪圈数减少,步距减小(P<0.05);与MPTP组比较,用低剂量氯胺酮处理后,PD小鼠姿势步态不稳、步距减少的症状得到明显改善(P<0.05)。Rotarod实验与gait analysis system结果相符,MPTP+Ket组的数据均明显优于MPTP组,见表1。
表1Rotarod转棒仪圈数与gaitanalysissystem步距结果
Table 1. The results of rotarod experiment and gait analysis system (Mean±SD.n=9)
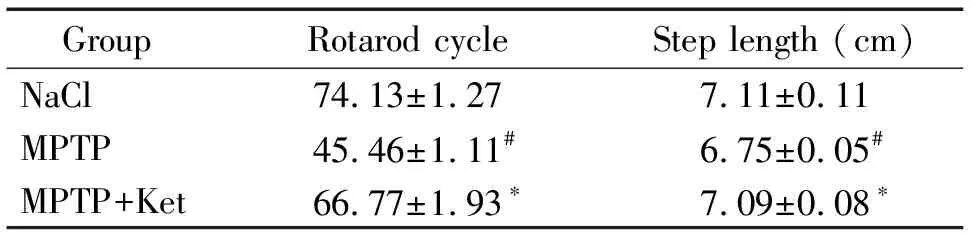
GroupRotarod cycle Step length (cm)NaCl74.13±1.277.11±0.11MPTP45.46±1.11#6.75±0.05#MPTP+Ket66.77±1.93∗7.09±0.08∗
#P<0.05vsNaCl group;*P<0.05vsMPTP group.
2 低剂量氯胺酮具有神经保护作用
MPTP腹腔注射造成小鼠的黑质区多巴胺能神经元丢失。统计分析显示,与NaCl组相比,MPTP组多巴胺能神经元数目明显减少(P<0.05);用低剂量氯胺酮处理后,MPTP+Ket组小鼠黑质区多巴胺能神经元增加,统计分析显示,与MPTP组相比,MPTP+Ket组的多巴胺能神经元数目明显增多(P<0.05),见图1。
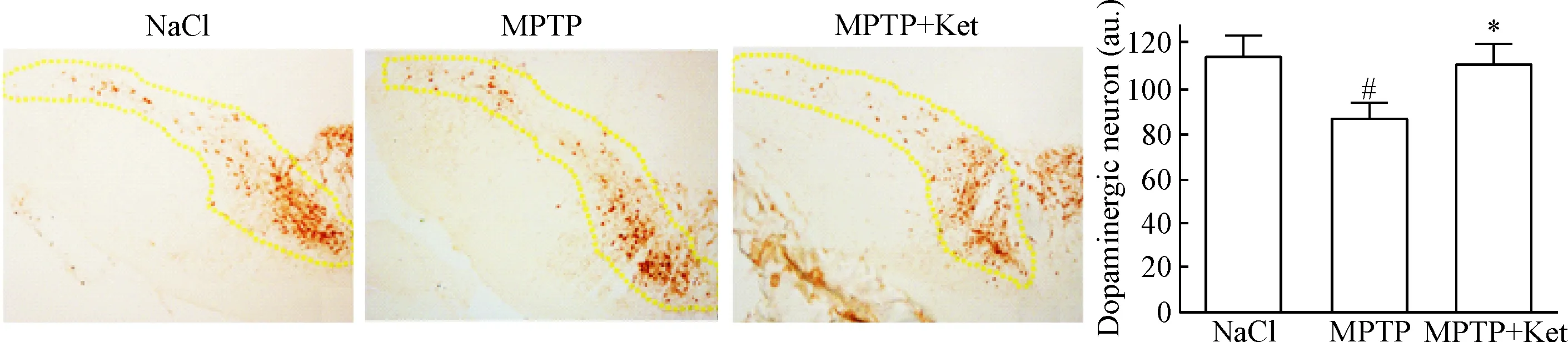
Figure 1. The changes of dopaminergic neurons in the substantia nigra (×10). Mean±SD.n=4.#P<0.05vsNaCl group;*P<0.05vsMPTP group.
图1小鼠黑质区多巴胺能神经元数目差异的比较
3 低剂量氯胺酮抑制小鼠黑质纹状体区α-Syn的异常表达
3.1低剂量氯胺酮抑制小鼠黑质纹状体区α-Syn异常表达 免疫荧光结果显示经MPTP腹腔注射的小鼠黑质纹状体区荧光强度较NaCl组明显增强(P<0.05),这表示MPTP组的α-Syn异常表达增多,与临床病理结果相符;用低剂量氯胺酮处理后,PD小鼠黑质纹状体区免疫荧光强度较MPTP组明显减弱(P<0.05),见图2、3。
3.2低剂量氯胺酮抑制小鼠黑质纹状体区α-Syn蛋白表达 Western blot实验结果显示,与NaCl组比较,经MPTP腹腔注射的小鼠黑质纹状体区α-Syn的表达量明显增加(P<0.05);低剂量氯胺酮处理后,PD小鼠黑质纹状体区的α-Syn表达量减少(P<0.05),支持免疫组化的结果,见图4。
讨 论
随着我国逐渐进入老龄化社会,PD患者将会急剧增长并长期维持在较高水平[16-17]。帕金森病患者生理指标有多种改变[18],但其病理特征表现为在残存的神经元胞体内出现以α-Syn的包涵体和神经突起[19]。目前认为,α-Syn是 PD发病机制中一种重要的蛋白,在α-Syn突变、过度表达的野生型及氧化应激等多种因素作用下,其异常聚集形成路易小体,并进一步损害多巴胺神经元[5, 20-21],与PD的发病密切相关。因此,治疗PD时,针对α-Syn异常聚集的干预显得尤为重要。氯胺酮常作为全身麻醉药物应用于临床,近年来临床病例观察和病例系统回顾发现[6, 22-23],在应用氯胺酮对帕金森病患者进行麻醉时,可产生快速抑制帕金森病静止性振颤的作用;体外及动物实验也观察到氯胺酮在多种帕金森病模型中均能产生神经保护作用,这种作用可能与改变大脑电活动、兴奋性神经递质传递、NMDA受体及多种信号通路有关[12, 24-26]。但有关氯胺酮对帕金森病典型致病标志α-Syn蛋白是否有影响却鲜有报道,本论文目的为利用MPTP小鼠模型研究氯胺酮对PD小鼠α-Syn的影响,为了解氯胺酮治疗帕金森病的可能性,指导临床用药。
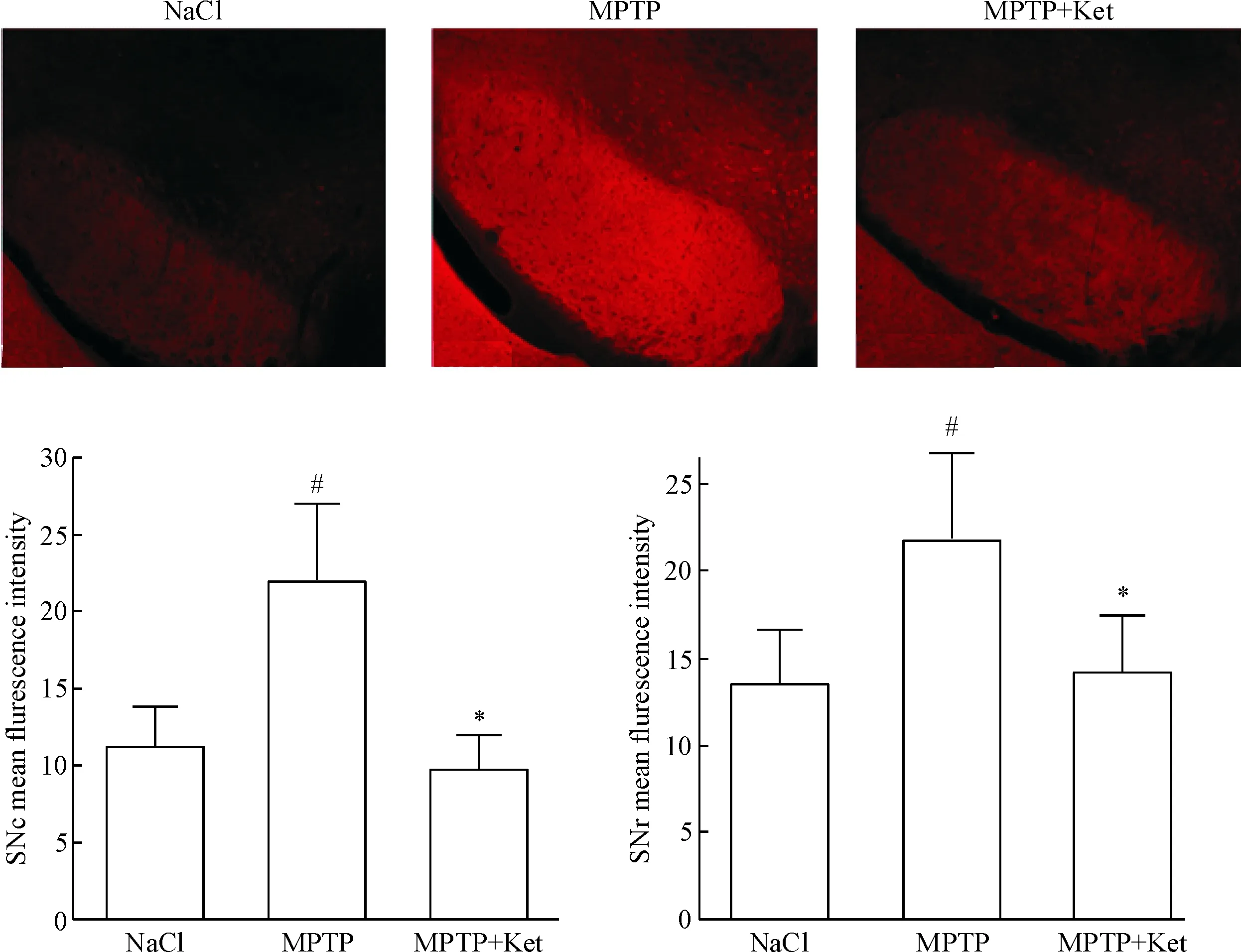
Figure 2. The effect of low-dose ketamine (Ket) on the expression and abnormal accumulation of α-Syn (red) in the substantia nigra (×10). SNc: substantia nigra, compact part; SNr: substantia nigra, reticular part. Mean±SD.n=4.#P<0.05vsNaCl group;*P<0.05vsMPTP group.
图2低剂量氯胺酮对PD小鼠黑质区α-Syn表达的影响
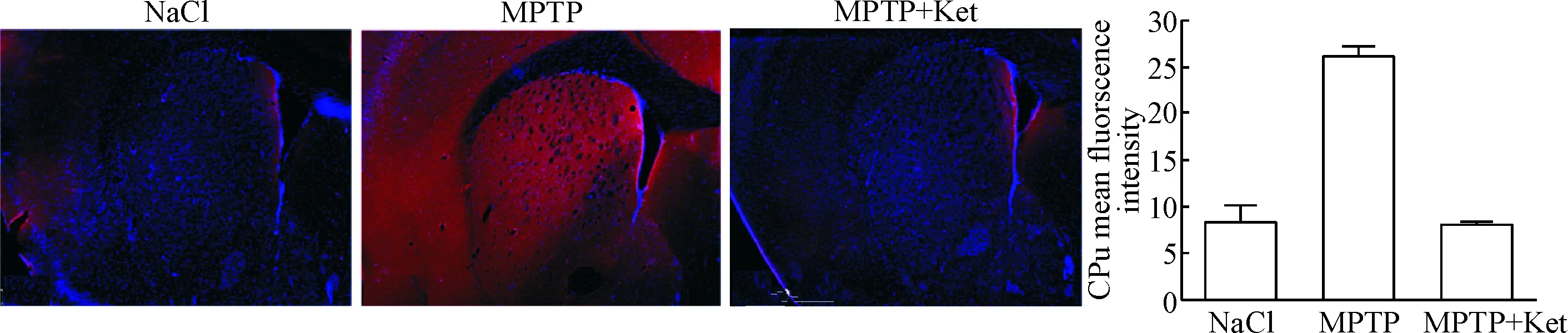
Figure 3. The effect of low-dose ketamine (Ket) on the expression and abnormal accumulation of α-Syn (red) in the caudate putamen (CPu, ×4). Mean±SD.n=4.#P<0.05vsNaCl group;*P<0.05vsMPTP group.
图3低剂量氯胺酮对PD小鼠纹状体区α-Syn表达的影响
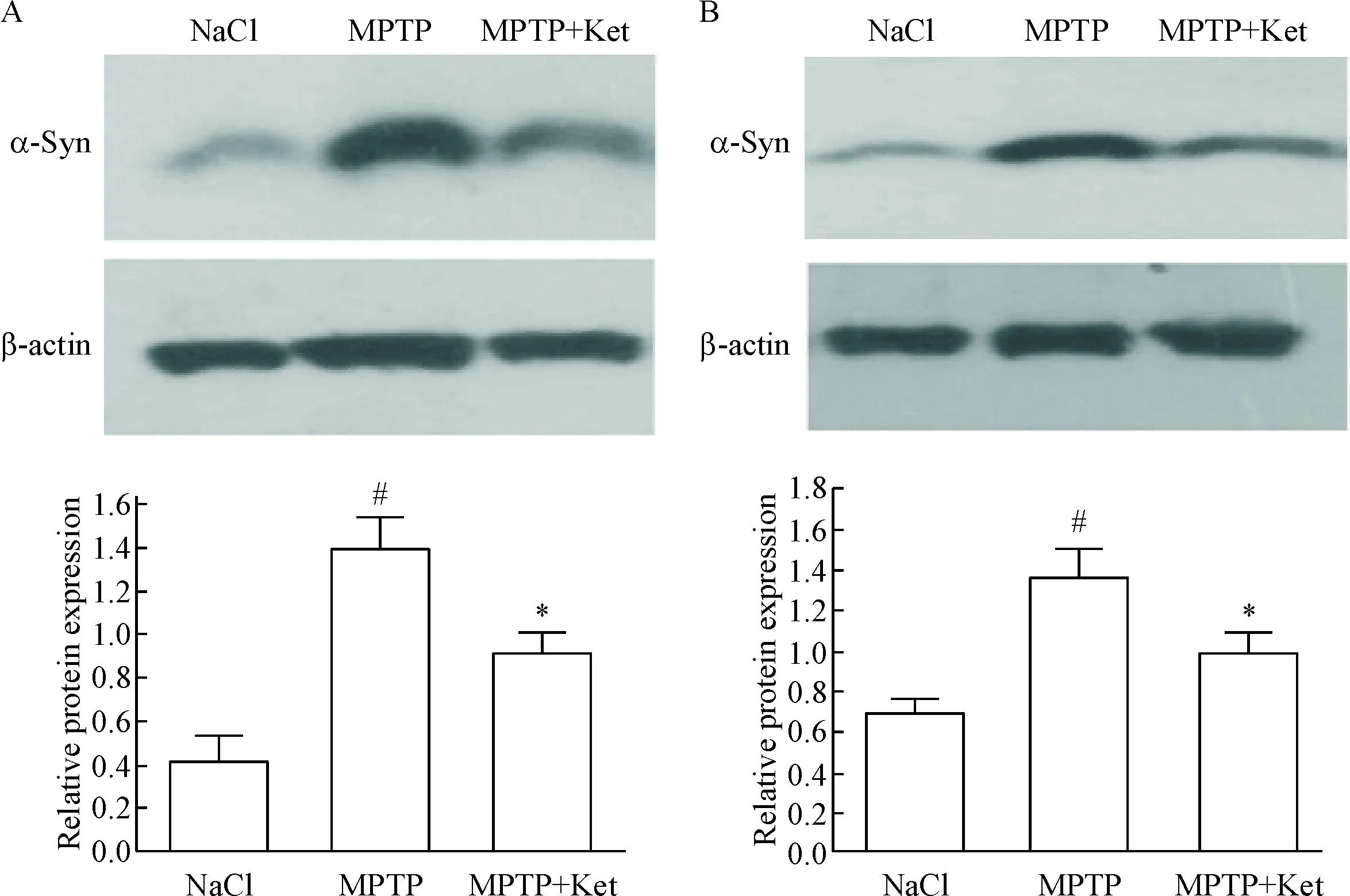
Figure 4. The results of Western blot. A: the protein expression of α-Syn in the substantia nigra; B: the protein expression of α-Syn in the CPu. Mean±SD.n=3.#P<0.05vsNaCl group;*P<0.05vsMPTP group.
图4Westernblot检测黑质纹状体区α-Syn的表达
PD模型有MPTP腹腔注射、6-OHDA和MPP+靶向注射等多种模型制备方式[15, 27-28],神经毒素 MPTP 腹腔注射 C57BL/6 小鼠被认为是较操作简单、制模理想的方法之一。本研究结果显示,MPTP组与 NaCl组行为学、免疫组化TH染色、α-Syn蛋白免疫荧光染色及Western blot的结果均存在统计学显著性,与前期文献[29-31]研究结果一致,说明本实验用 MPTP 诱发 C57BL/6 小鼠的PD复制方法简单有效。在本实验中,连续给予低剂量氯胺酮腹腔注射后,MPTP+Ket组与MPTP组小鼠在转棒仪上停留的时间明显延长,小鼠步距明显增大,表明小剂量氯胺酮对PD小鼠动作的协调性、姿势不稳及步距减小的行为学症状得到明显改善。免疫组化TH染色结果显示,经低剂量氯胺酮处理后MPTP+Ket组小鼠黑质区多巴胺能神经元数目明显增多,这说明低剂量氯胺酮减轻了MPTP导致的黑质区多巴胺能神经元的损伤。免疫荧光及Western blot检测均提示MPTP可以诱导小鼠黑质、纹状体区的α-Syn表达增多,证实了α-Syn的异常表达可以产生帕金森病症状;但经低剂量氯胺酮处理后,MPTP+Ket组小鼠黑质纹状体区荧光明显减弱,表明α-Syn表达量减少,与此相应PD小鼠的行为学症状改善相符合,表明低剂量氯胺酮干预可能是通过抑制α-Syn蛋白的过表达而改善帕金森病症状的,说明针对α-Syn的干预是有效的,但氯胺酮抑制α-Syn的作用机制仍需进一步研究。
综上所述,本研究重新探索了现已成熟应用的临床药物氯胺酮在麻醉以外的治疗应用,从帕金森病的关键发病机制——α-Syn异常聚集并损伤多巴胺神经元——出发,发现氯胺酮对PD小鼠黑质纹状体区α-Syn异常表达具有抑制作用,并认为通过改变α-Syn的表达可产生神经保护作用,为临床应用氯胺酮治疗帕金森病在一定程度上提供实验理论依据。

