有氧运动和补充魔芋葡甘聚糖通过调节PI3K/FoxO1通路有效预防高脂膳食大鼠肝脏胰岛素抵抗的形成
金其贯 张奥英 刘瑜 徐广艳 张瑜
1扬州大学体育学院(扬州 225127)
2玉溪师范学院(玉溪 653100)
肝脏是机体进行糖代谢,维持血糖稳定的主要器官[1,2]。当肝脏葡萄糖输出过多,不能被其他器官有效利用时,血糖升高,出现胰岛素抵抗(insulin resistance,IR)和2型糖尿病[3]。肝脏IR主要是指胰岛素抑制肝脏葡萄糖生成(hepatic glucose production,HGP)的能力下降,胰岛素抑制内源性葡萄糖生成的作用减弱和肝糖原合成减少是其主要特征。一旦高分泌的胰岛素也无法代偿,就会使空腹血糖(fasting plasma glucose,FPG)升高[4],是肥胖引起糖尿病、非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)等代谢综合征的主要发病机制。HGP增加来自糖异生和糖原分解两个方面,而糖异生的速度取决于葡萄糖6磷酸酶(glucose-6-phosphatase,G-6-Pase)和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)这2种关键酶转录的多少[4]。而磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸/苏氨酸蛋白激酶(Akt)是胰岛素在肝脏发挥生理效应的主要信号转导通路,叉头转录因子1(forkhead transcription factor 1,FoxO1)是PI3K/Akt信号的下游分子,是胰岛素活性的重要靶点,主要通过调控G-6-Pase和PEPCK的表达促进空腹时肝脏糖异生,增加HGP[5,6]。因此,FoxO1表达紊乱可以损伤胰岛素调节肝脏糖脂代谢的能力[7]。有研究发现,高脂饮食(high-fat diet,HFD)引起的肥胖大鼠出现肝细胞膜、肌肉细胞膜和脂肪细胞膜胰岛素受体结合力显著下降以及高胰岛素血症等IR的特征,而进行8周的耐力性运动干预后,肝细胞膜、肌肉细胞膜和脂肪细胞膜的胰岛素受体结合力均显著提高,血胰岛素水平显著下降,IR得到改善[8]。但有研究对NAFLD进行16周的运动干预后发现,运动锻炼有效地减少了NAFLD患者肝脏脂肪含量,改善了外周IR,但不足以改善肝脏IR[9]。因此,并不是所有个体都能得到运动提高胰岛素敏感性的预期效果,这些人被认为是运动抵抗。热量限制是一种提高运动增强外周和肝脏的胰岛素敏感性效应的方法,在运动后限制碳水化合物的摄入可对提高外周胰岛素的敏感性提供相加的效应[10]。24周的饮食和身体活动生活方式干预可降低慢性丙型肝炎肥胖患者的肝脏胰岛素抵抗[11]。而魔芋葡甘聚糖(konjac glucomannan,KGM)是魔芋的主要成分,能减少和延缓葡萄糖的吸收,具有良好的减肥、降脂、降糖和润肠通便的作用[12]。但是,目前KGM以及KGM联合有氧运动对肝脏IR的干预作用及其交互作用尚未见到研究报道。本研究通过对SD大鼠喂饲HFD诱导肝IR形成的同时进行有氧运动和/或补充KGM,观察肝脏PI3K/Akt/FoxO1及肝脏糖异生酶(G-6-Pase和PEPCK)的变化,探讨有氧运动或/和KGM对HFD大鼠肝脏IR形成的干预作用及其机制。
1 对象和方法
1.1 动物分组及实验方案
雄性SD大鼠50只,体重160~180 g,购于浙江省实验动物中心,动物生产许可证号:SCXK(浙)20080033。分笼饲养,每笼5只,室温20±2℃,光照12 h左右。大鼠适应性喂养1周后,随机分为正常对照组(NC组,n=10)、HFD对照组(HFC组,n=10)、HFD+KGM组(HFK,n=10)、HFD+运动组(HFE,n=10)、HFD+运动+KGM组(HFEK,n=10)5组。在实验期间,NC组大鼠喂饲普通饲料,HFC、HFE、HFK和HFEK组喂饲高脂饲料,高脂饲料按照66.5%普通饲料、20%蔗糖、10%猪油、2%猪胆酸盐和1.5%胆固醇的配方由南京市江宁区青龙山动物繁殖场加工制作。HFK和HFEK组每天以50 mg/kg体重的剂量灌服KGM,KGM购于合肥博美生物科技有限公司。HFE和HFEK组每天晚上进行60 min的无负重游泳运动训练,每周6次,共持续10周。游泳池为100 cm×70 cm×60 cm内壁光滑的塑料水桶,水深50 cm以上,水温32±1℃。实验过程中,由于操作不当,HEK组有1只大鼠死亡。
1.2 实验取材
动物在末次运动锻炼结束后的第二天上午取材,在取材前禁食8 h,依次按50 mg/kg的剂量腹腔注射2%的戊巴比妥钠进行腹腔麻醉,然后从腹主动脉抽取血液5 ml注入采血管中,放置1 h后离心(4000 rpmin,10 min)分离血清,在2 h内测定空腹血糖(FPG),其余保存于-40℃冰箱中,以备测胰岛素等指标。并取出部分肝组织,用锡箔纸包裹后放入液氮中速冻,并移入-40℃冰箱中保存,测试前用冰生理盐水制备成10%的组织匀浆,经4000 r/min离心10 min后,分离上清液用于测定PI3K、Akt、FoxO1、PEPCK、G-6-Pase蛋白含量。
1.3 指标的测定
FPG采用葡萄糖氧化酶法测定,测定仪器为日立全自动生化分析仪。血清FINS和肝组织PI3K、Akt、FoxO1、PEPCK、G-6-Pase蛋白含量采用ELISA测定,试剂盒购于美国R&B公司,测定仪器为ELX800型酶标仪,并根据公式FPG×FINS/22.5计算稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)。肝组织匀浆的总蛋白定量采用考马斯亮兰法,试剂盒购于南京建成生物研究所,测试仪器为722型紫外分光光度计。
1.4 统计学分析
实验数据使用SPSS17.0统计软件进行处理,结果用平均值 ±标准差表示。NC组和HFC组之间采用独立样本t检验,HFC、HFK、HFE和HFEK组之间采用双因素方差分析,P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2 结果
2.1 各组大鼠肝脏PEPCK、G-6-Psae蛋白含量的变化
由表1、2可见,与NC组相比,HFC组肝脏PEPCK和G-6-Pase含量极显著性升高(P<0.01);通过双因素方差分析可知,有氧运动和KGM可显著降低HFD大鼠肝脏PEPCK(P<0.05,P<0.01)和G-6-Pase(P<0.01)含量;有氧运动联合KGM对降低HFD大鼠肝脏PEPCK和G-6-Pase含量有显著性的交互作用(P<0.01,P<0.05)。
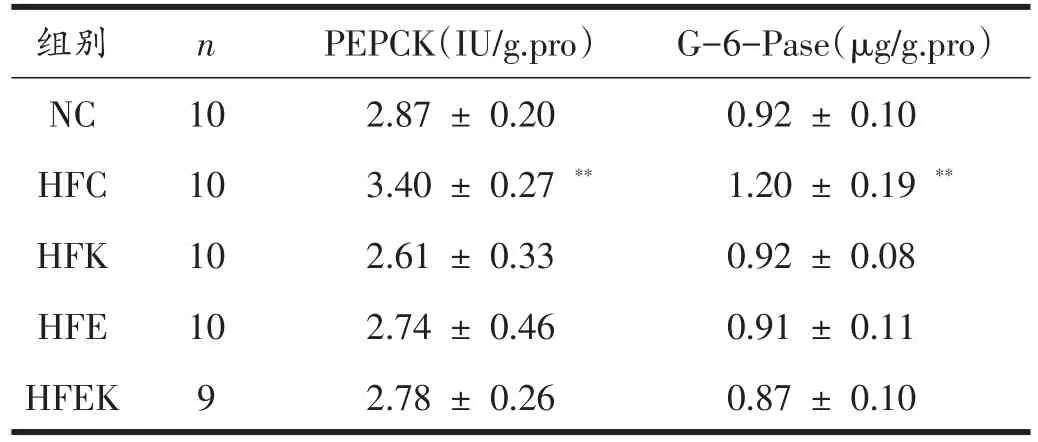
表1 各组大鼠PEPCK、G-6-Pase含量的变化
2.2 各组大鼠FPG、FINS和HOMA-IR的变化
由表3、4可见,与NC组相比,HF组大鼠FPG、FINS含量以及HOMA-IR极显著性升高(P<0.01);通过双因素方差分析可知,有氧运动和KGM均可降低HFD大鼠FPG(P<0.05)、FINS水平(P<0.01)和 HOMA-IR(P<0.01),而有氧运动联合KGM虽然对降低HFD大鼠FPG水平无显著性交互作用(P>0.05),但对降低FINS含量和HOMA-IR具有显著性的交互作用(P<0.01,P<0.05)。

表3 各组大鼠FPG、FINS、HOMA-IR水平的变化
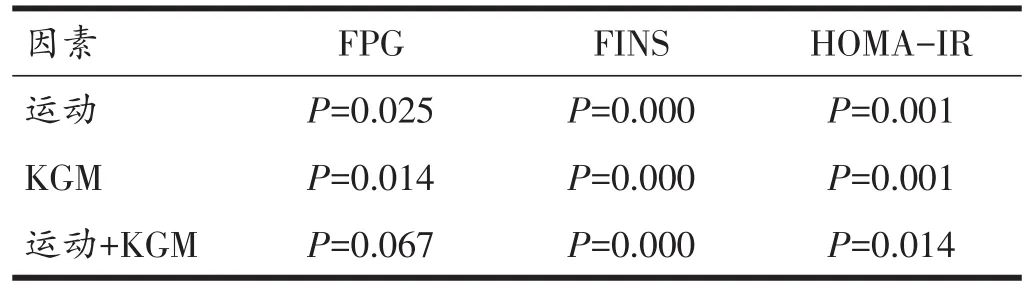
表4 各组大鼠FPG、FINS、HOMA-IR的双因素方差分析
2.3 各组大鼠肝脏PI3K、Akt、FoxO1蛋白含量的变化
由表5、6可见,与NC组相比,HFC组大鼠肝脏PI3K含量极显著性降低(P<0.01),Akt和FoxO1含量极显著性升高(P<0.01);通过双因素方差分析可知,有氧运动虽然不能显著性降低HFD大鼠肝脏Akt含量(P>0.05),但能显著性升高PI3K含量(P<0.01)、显著性降低FoxO1含量(P<0.05);KGM补充虽然不能显著性升高HFD大鼠肝脏PI3K含量(P>0.05),但可极显著性降低Akt和FoxO1含量(P<0.01);有氧运动联合KGM虽对降低Akt含量无显著性的交互作用(P>0.05),但对升高PI3K和降低FoxO1含量有显著性交互作用(P<0.05)。
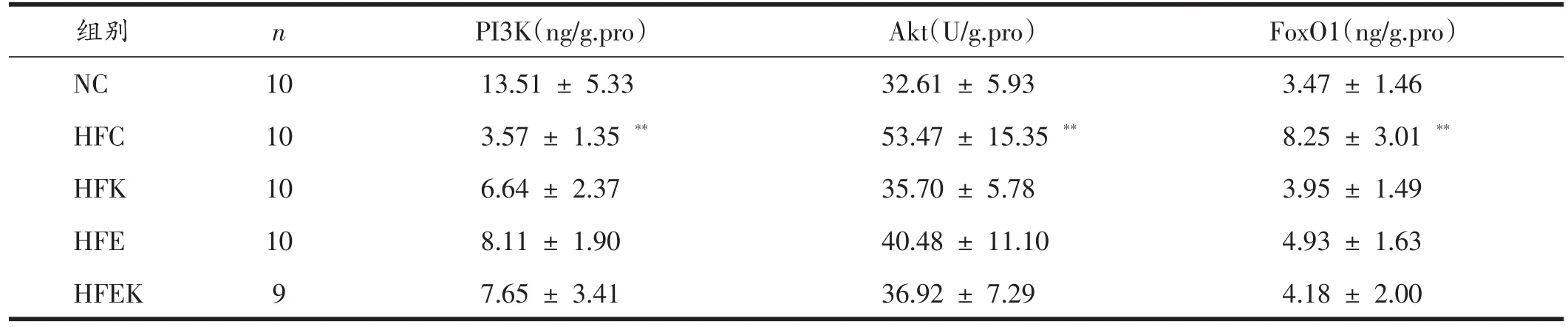
表5 各组大鼠PI3K、Akt、FoxO1含量的变化
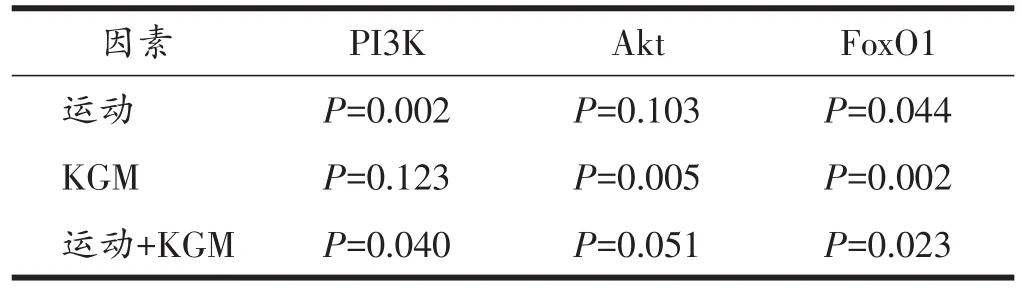
表6 各组大鼠PI3K、Akt和FoxO1的双因素方差分析
3 分析与讨论
研究证实,高血脂尤其是游离脂肪酸(FFA)和甘油三酯(TG)的升高是导致IR的重要原因[13]。大量脂肪的摄入会引起脂肪、肌肉和肝脏组织产生IR,导致胰岛素抑制内源性葡萄糖生成的机制受损。由于HFD引起的IR动物模型和人类肥胖引起的IR相似,故不少学者给正常大鼠喂饲HFD成功复制了肝脏IR动物模型[14,15]。目前,HGP的测量是评估肝脏IR的最普遍的方法[16],但其检测方法比较繁琐。由于HGP增加是增加肝脏葡萄糖输出的基础,而肝糖异生的增多是最主要的途径。PEPCK和G-6-Pase是决定着肝脏糖异生速度的两个关键酶,而且HOMA-IR与肝脏IR有良好的相关性(r=0.64)[17],是评价肝脏IR的指标之一。因此,本研究通过测定肝脏PEPCK和G-6-Pase的变化,结合HOMA-IR来评估肝脏IR的形成。结果发现,与NC组相比,HFC组大鼠肝脏PEPCK、G-6-Pase含量非常显著性升高(P<0.01)的同时,FPG、FINS以及HOMA-IR均非常显著性升高(P<0.01),从而说明10周的HFD可以引起大鼠肝脏IR的形成。
胰岛素是通过激活PI3K/Akt信号通路而发挥作用的,PI3K、Akt活性和(或)表达缺陷可能参与IR和2型糖尿病的发生[18-20]。FoxO1和Foxa2是肝脏监测血液中胰岛素水平与糖脂代谢的传感器(sensor)[5]。胰岛素通过激活PI3K/Akt信号转导通路,使FoxO1磷酸化,导致FoxO1失去转录活性,从而抑制G-6-Pase及PEPCK基因表达,促进空腹时肝脏糖异生,增加肝糖输出[21,22]。KKAy糖尿病小鼠肝脏和肌肉FoxO1的表达显著高于对照组[23,24]。肝脏中FoxO1过度表达时糖耐量出现损伤,肝脏糖原和脂肪沉积水平降低;而FoxO1功能丧失时肝脏糖异生的功能受到抑制,此时胰岛素敏感性增加,葡萄糖利用增强。无论是HFD诱导的肥胖小鼠还是糖尿病db/db鼠肝脏中FoxO1转录活性均明显增加,从而上调过氧化物酶体增殖物激活受体γ共激活因子1β(PGC-1β)、乙酰CoA羧化酶及脂肪酸合成酶的表达。因此,FoxO1有整合胰岛素信号和线粒体的功能,FoxO1表达紊乱可以损伤胰岛素调节肝脏糖脂代谢的能力[7],阻断FoxO1能改善IR和代谢综合症患者的肝糖脂代谢[25]。肝脏胰岛素信号传导途径的缺陷可能对糖异生抑制不足,导致空腹和饭后高血糖症。为了探讨HFD诱导大鼠肝脏IR形成的机制,本研究通过给大鼠喂饲HFD,10周后在测定肝脏组织中G-6-Pase和PEPCK含量的同时,测定了肝组织中PI3K、Akt和FoxO1的含量。结果发现,与NC组比较,HFC组大鼠肝组织中PI3K含量极显著性地降低(P<0.01),Akt、FoxO1含量显著升高(P<0.01)。从而进一步说明PI3K/Akt/FoxO1信号通路在HFD诱导的大鼠肝脏IR形成中发挥了非常重要的作用,即长期的HFD可能降低了肝脏胰岛素敏感性,抑制了PI3K活性,从而使FoxO1水平增加,刺激肝脏糖异生,增加肝脏内源性葡萄糖的生成,促进肝脏IR的形成。然而,本研究中PI3K和Akt的变化却出现了不一致的情况,其原因可能是长期的HFD降低了肝脏中PI3K活性,使Akt的磷酸化(p-Akt)减少,从而导致非磷酸化的Akt含量增加。因此,在研究肝脏的胰岛素传导通路时,要检测Akt和p-Akt的水平,才能完整分析清楚其传导过程及其机制。
有氧运动和饮食控制是预防和治疗IR和2型糖尿病的基本措施。正常动物或2型糖尿病人即使在一次急性运动后胰岛素抑制肝脏葡萄糖生成的能力就会得到显著提高[26,27]。而12周的运动训练联合低热量饮食可以使2型糖尿病病人肝脏胰岛素的敏感性显著提高27%,基础内源性葡糖糖的生成显著减少17%[28]。在不受饮食干预影响的条件下,运动可减少NAFLD患者肝细胞内甘油三酯含量,但是控制饮食联合运动比单独运动更加有效[29]。通过增加高蛋白质/低碳水化合物饮食的消耗来限制能量的摄入可特异性降低肝内甘油三酯含量[30]。而KGM是一种天然的膳食纤维,不易被消化吸收,热量极低,易溶于水,可以吸收自身体积100倍的水,具有极强的吸水膨胀性,增加饱腹感,且在胃肠道中能与胆固醇结合,促进其排泄增多[31],并能降低小肠粘膜Na+-K+-ATP酶活性,抑制肠道的吸收功能,延迟葡萄糖的吸收[32],从而改善2型糖尿病患者糖代谢紊乱状态,使 FPG和餐后血糖下降[33]。因此,KGM可以减少糖和脂肪的摄入,减少脂肪在肝组织中的沉积,改善组织对胰岛素的敏感性,调节糖脂代谢,是预防和治疗IR、脂肪肝、糖尿病等代谢综合征发生和发展的良好方法[12]。然而,补充KGM能否改善肝脏IR以及补充KGM联合运动能否产生协同效应,目前尚未见到研究报道。本研究在给大鼠喂饲HFD诱导肝脏IR形成的同时,分别进行运动训练和/或补充KGM。通过双因素方差分析发现,有氧运动和KGM可显著降低HFD大鼠肝脏PEPCK(P<0.05,P<0.01)和G-6-Pase(P<0.01)含量、FPG(P<0.05)、FINS水平(P<0.01)和HOMA-IR(P<0.01);有氧运动联合KGM虽然对降低HFD大鼠FPG水平无显著性交互作用(P>0.05),但对降低HFD大鼠肝脏PEPCK、G-6-Pase、FINS含量和HOMA-IR有显著性的交互作用(P<0.01,P<0.05,P<0.01,P<0.05)。从而说明有氧运动和补充KGM可以有效改善HFD大鼠胰岛素抑制肝脏糖异生的能力,减少HGP,降低FPG,从而有效地预防HFD大鼠肝脏IR的形成,且有氧运动联合KGM的干预效果比单纯进行有氧运动锻炼或KGM干预效果更好。
有关有氧运动或补充KGM对肝脏IR的干预机制目前还不完全清楚。有研究发现,有氧运动可能通过调节或减少脂肪在肝脏中的沉积增强肝脏胰岛素的作用[34]。但也有研究发现,4个月的抗阻训练可以显著增强老年女子胰岛素抑制内源性葡萄糖生成(EGP)的能力,但是不能改变肝脏和内脏脂肪对葡糖糖的摄取以及异位脂肪的数量[35]。而有氧运动可以通过激活PI3K/Akt通路改善机体对胰岛素的反应性[36]。高脂饮食致IR大鼠肝组织中的Akt蛋白表达显著降低,而6周游泳运动干预可显著提高IR大鼠肝组织中Akt蛋白的表达水平[37]。在2小时的耐力性游泳运动8小时后,在空腹条件下肥胖和糖尿病鼠肝脏中胰岛素信号转导显著改善,胰岛素刺激的Akt和Foxo1磷酸化显著增加,HNF-4α蛋白水平显著降低,伴随着糖异生基因PEPCK和G-6-Pase表达的显著降低,PI3K抑制剂LY292004可逆转运动对空腹高血糖症的急性作用,从而说明Foxo1和HNF-4α活性的调节是运动锻炼改善IR状态下葡萄糖稳态的重要机制[38]。而肝脏胰岛素作用的丧失与肥胖症条件下促炎生物分子的产生有关。TRB3蛋白能够抑制Akt活性并因此维持肝细胞核中的FoxO1活性,诱导高血糖症。而体育锻炼可以通过减少炎症过程,抑制TRB3的产生,抑制糖异生来改善肝脏IR[39]。而且运动锻炼可以降低肥胖小鼠肝脏中丝裂原活化蛋白激酶磷酸酶-3(MKP-3)和FoxO1/MKP-3关联表达,并能减少FoxO1磷酸化以及过氧化物酶体增殖物激活受体γ共激活因子1-α(PGC-1α)和糖异生酶(PEPCK和G6Pase)的蛋白水平[40]。为了探讨PI3K/Akt/FoxO1信号通路在有氧运动和KGM补充干预HFD大鼠肝脏IR形成中的作用,本研究在大鼠喂饲HFD的同时,进行60 min、每周6次的有氧运动锻炼和/或补充KGM,通过双因素方差分析发现,有氧运动可使HFD大鼠肝脏Akt含量无显著性降低(P>0.05),但可使PI3K含量显著性升高(P<0.01)、FoxO1含量显著性降低(P<0.05);KGM可使HFD大鼠肝脏PI3K含量无显著性升高(P>0.05),但可使Akt和FoxO1含量极显著性降低(P<0.01);有氧运动联合KGM虽对降低Akt含量无显著性的交互作用(P>0.05),但对升高PI3K和降低FoxO1含量有显著性交互作用(P<0.05)。从而说明长期的有氧运动或补充KGM能够改善HFD大鼠肝脏PI3K含量,进而降低FoxO1的蛋白含量来抑制肝脏的糖异生能力,减少肝糖的生成,有效地预防肝脏IR的发生。但是,肝脏中Akt仍出现与PI3K不一致的现象,我们推测可能是由于长期的有氧运动锻炼或补充KGM有效地提高了肝组织中PI3K活性,导致p-Akt生成增多,从而导致非磷酸化的Akt含量减少,其确切机制还有待于进一步研究。因此。长期的有氧运动和补充KGM可以增加脂肪的氧化和抑制脂肪的吸收,从而降低脂肪在肝脏的沉积,增加肝细胞对胰岛素的敏感性,改善HFD大鼠肝脏的胰岛素信号传导路径,增强胰岛素对肝脏糖异生的抑制能力,降低HGP,对有效预防肝脏IR和2型糖尿病的发生具有非常重要的作用。
4 结论
(1)长期的高脂膳食可以抑制肝脏PI3K/FoxO1信号通路,增加肝糖异生,诱导肝脏胰岛素抵抗的形成。
(2)有氧运动或补充魔芋葡甘聚糖可以通过改善肝脏PI3K/FoxO1信号通路,抑制肝糖异生,有效预防高脂膳食大鼠肝脏胰岛素抵抗的形成,维持空腹血糖的稳定。而且,魔芋葡甘聚糖的补充在一定程度上对有氧运动预防高脂膳食大鼠肝脏胰岛素抵抗的形成具有附加作用。

