有氧运动对Aβ1-42诱导阿尔茨海默病大鼠学习记忆能力及海马炎症状态的影响
付燕 张业廷 罗笑 胡小勇 谢璐霜 袁琼嘉
1成都体育学院运动医学与健康学院(成都 610041)
2西南民族大学体育学院(成都 610041)
3成都中医药大学(成都 610041)
阿尔茨海默病(Alzheimer's disease,AD)主要表现为学习、记忆以及其它认知功能进行性损毁,是引起老年人痴呆的最主要原因[1-3]。随着全世界老年人口不断增长,AD已经成为一个日益严峻的公共健康问题。AD的主要病理学特征是脑组织神经元胞外β-淀粉样蛋白(β-amyloid peptide,Aβ)沉积形成的老年斑、神经元胞内神经原纤维缠结以及神经元死亡和突触丢失,学习与记忆的关键脑区海马等部位的病变尤为明显[2,4]。尽管AD发病的确切原因与机制尚未完全阐明,但随着相关研究的不断深入,人们逐渐认识到脑组织内Aβ沉积诱发的免疫炎症级联反应在AD慢性进行性病变中发挥着重要作用[5-8]。因此,抑制脑组织炎症反应被认为是降低AD风险的潜在治疗目标。但目前没有任何具有抗炎作用的药物被批准用于治疗持续性的炎症性病变,更没有任何方法可以治愈AD。
近些年来的许多研究表明,定期规律的有氧运动是可以预防或缓解与慢性低水平系统性炎症有关疾病的一种有效手段[9-11]。而来自人体流行病学调查与干预性实验以及动物实验的数据提示长期规律的运动,尤其是有氧运动,对预防AD发生或延缓其病程具有积极作用[12-16]。我们推测,这种积极作用可能与有氧运动调控AD患者脑组织中Aβ沉积诱发的炎症反应有关。本研究采用直接经双侧海马注射凝聚态的Aβ1-42(一种体内神经毒性和致炎作用最强的Aβ肽链)的方式以诱导AD脑组织病理模型,并在Aβ1-42注射后给予大鼠规律的有氧运动干预,然后观察大鼠学习记忆能力的变化,并检测海马组织超微结构以及促炎细胞因子、抗炎细胞因子的表达情况,探讨有氧运动能否通过调控Aβ诱发的海马组织炎症反应状态进而发挥神经保护作用,阻止AD的发生或延缓AD病变的进程,改善其学习记忆等认知功能受损。
1 材料与方法
1.1 动物与分组
3月龄SPF级健康雄性SD大鼠52只,购于成都达硕实验动物有限公司(动物生产许可证:SCXK[川]2015-030;动物使用许可证:SYXK[川]2014-189)。大鼠饲养于成都体育学院动物实验室,室温25±2℃,相对湿度40%~60%,自然光照,分笼饲养(3~4只/笼),自由摄取国家标准啮齿类动物饲料和饮用冷开水。大鼠适应性喂养7天后被随机分成4组:空白对照组(K组),生理盐水对照组(S组)、Aβ1-42诱导AD模型组(A组)、Aβ1-42+有氧运动组(AE组),每组13只。A组和AE组大鼠被给予双侧海马注射凝聚态Aβ1-42(Sigma),S组大鼠则按同种方式注射同容积剂量生理盐水(normal saline,NS),K组大鼠自然喂养。AE组大鼠Aβ1-42注射后第2天即开始进行有氧运动。
1.2 海马A Aβ 1 1--4242/NS/NS注射方法
腹腔注射4%水合氯醛(10 ml/kg)将大鼠麻醉后固定于大鼠脑立体定位仪上;头顶前后囟区域去毛后常规消毒,用眼科剪沿正中矢状轴方向剪开头皮0.5~1.0 cm,剥离骨膜,暴露出前囟及矢状缝;参照诸葛启钏翻译的《大鼠脑立体定位仪图谱》定位双侧海马体注射点(定位坐标:前囟后3.0 mm,颅矢状缝左右各旁开2 mm),用牙科钻在左右定位处各钻1小孔;将装有Aβ1-42的10 μl微量注射器连接于固定在脑立体定位仪的微量推进器上,从坐标处垂直入颅,缓慢进针至颅骨表面下4 mm;以0.5 μl/min的速度缓慢注入凝聚态的Aβ1-42或NS,每侧各5 μl;注药完毕后留针10 min再缓慢退针拔出;常规消毒、缝合,每天创口涂擦红霉素软膏至完全愈合。
1.3 有氧运动方案
AE组大鼠于海马注射Aβ1-42前在电动跑台上进行适应性跑台运动 3天,8~10 m/min,15~20 min/d。正式跑台运动训练于海马注射Aβ1-42后第2天开始,每日晚上8~10点进行,共持续5周,每周训练6天,休息1天。训练第1周的前3天跑台速度6~8 m/min,持续时间10~20 min/d;第1周的后3天跑台速度10~12 m/min,持续时间30 min/d;第2~5周则在热身运动(8~10 m/min,5 min)后将速度设置为15 m/min,持续时间 30 min/d。运动方案参考 Schefer等的文献[17,18]制定。
1.4 Morrisorris水迷宫实验检测大鼠空间学习与记忆能力
在海马注射Aβ1-42/NS后第5周,按文献[19,20]中的方法进行Morris水迷宫(Morris water maze,MWM)实验以检测大鼠空间学习与记忆能力。MWM实验装置由一个内表面为黑色的圆形水池(直径150 cm,高度60 cm)和信息采集分析系统组成。水池被平分为4个象限(分别标注为Ⅰ、Ⅱ、Ⅲ、Ⅳ),其中象限Ⅳ(称为“目标象限”)中装有一位置固定的圆形平台(直径9 cm,高度30 cm)。池水用无毒墨汁调为不透明状态,水深没过平台1.5±0.5 cm,水温22±1℃。水池的四周壁上贴有位置固定的方形、心形、三角形、圆形图片为大鼠寻找水下平台提供视觉线索。水池上方正中的摄像机同步采集大鼠的游泳轨迹,由水迷宫信息分析系统自动分析记录相关数据。MWM实验的前6天,每天进行4次定位航行训练,即将各大鼠头朝下、面朝池壁分别从四个象限的边缘中点放入水池,记录大鼠的平均逃避潜伏期(大鼠从4个象限入水至爬上平台的平均时间)以及游泳速度。如果训练时大鼠超过120 s尚未寻到水下平台,实验者会将其引至平台并让其在平台上停留10 s,此时逃避潜伏期记录为120 s。MWM实验的第7天,最后1次定位航行训练结束24 h后进行空间探索实验,即拆除目标象限中的水下平台,按照定位航行训练的方式将大鼠从水池第Ⅱ象限边缘中点放入水池,记录大鼠60 s内在目标象限中的时间以及穿越原平台所在区域的次数。
1.5 脑组织样本采集和指标检测
脑组织样本采集在Morris水迷宫空间探索实验结束后24~48 h进行。每组随机取3只用于电镜技术检测,5只用于免疫荧光实验,5只用于免疫印迹(western blot)分析。
1.5.1 超薄切片制作和电镜技术检测海马组织超微结构
使用10%水合氯醛(5 ml/kg体重)腹腔注射将大鼠麻醉后开胸,暴露心脏,将灌注针头迅速插入大鼠左心室并剪开右心耳,经左心室快速灌注NS,直至剪开的右心耳处流出液体变清亮后慢速灌注3%戊二醛溶液(4℃);待大鼠四肢和尾巴强直僵硬后,断头取脑,冰上快速分离出海马;在3%戊二醛中将海马CA1区修成1 mm×1 mm×1 mm组织块,放入尖头EP管中,加满3%戊二醛,4℃固定过夜;0.01 M PBS充分冲洗后用1%四氧化锇后固定2 h;用30~100%丙酮逐级脱水后将组织块用Epon812包埋;半薄切片(0.5 μm)光学定位后进行超薄切片(100 nm),超薄切片安装于铜网格上用醋酸铀及枸橼酸铅进行双重染色;透射电镜(日立H-600IV)观察并7000×倍数下采集图片。
1.5.2 冰冻脑切片制作和免疫荧光实验检测促炎细胞因子(TNF-TNF-α 、IL-IL-1 1β )、抗炎细胞因子(TGF-TGF-β 、IL-IL-1010)的表达
使用10%水合氯醛(5 ml/kg体重)腹腔注射将大鼠麻醉后开胸,暴露心脏,将灌注针头迅速插入大鼠左心室并剪开右心耳,经左心室快速灌注NS,直至剪开的右心耳处流出液体变清亮后慢速灌注4%多聚甲醛(4℃)至大鼠四肢僵硬,断头取出大脑,放入装有预冷4%多聚甲醛的EP管中(4℃,>4 h);用10%、20%、30%蔗糖溶液进行梯度脱水后将脑组织用OCT包埋剂进行包埋;冠状位连续切片至完整海马脑区,厚度5 μm;将切片粘附在用明胶处理过的成品载玻片上,充分干燥;0.01M PBS浸泡洗涤5 min×3次后用5%小牛血清封闭液室温封闭1 h后滴加一抗工作液(TNF-α,1∶300,Abcam;IL-1β,1∶200,Abcam;TGF-β,1∶200,Abcam;IL-10,1∶400,Abcam),4℃孵育过夜;0.01 M PBS洗涤5 min×3次后加入FITC标记的二抗IgG(1∶1000,北京中杉),湿盒中室温避光孵育2 h;0.01 M PBS避光洗涤10 min×3次后滴加DAPI工作液(1∶1000,北京中杉),37℃避光条件下孵育10 min;0.01M PBS避光漂洗5 min×3次后滴加抗荧光淬灭封片剂覆盖封片,荧光共聚焦显微镜下进行观察并采集图像。每个指标每个样本取5张切片(隔4取1),200×倍数下选取海马互不重叠的3个视野进行照相,用Image pro plus 6.0软件分析平均荧光强度(mean fluorescence intensity,MFI)。
1.5.3 海马蛋白质提取和Western Blot Blot分析促炎细胞因子(TNF-TNF-α 、IL-IL-1 1β )、抗炎细胞因子(TGF-TGF-β 、IL-IL-1010)的表达
将大鼠断头取脑,4℃生理盐水清洗后在冰上快速分离出右侧海马组织放入尖头EP管内,按照每1 mg组织加入4℃的10 μl RIPA 裂解缓冲液(每1 ml RIPA 裂解液中加入40 μl蛋白酶抑制剂和10 μl PMSF溶液)中匀浆,12000 rpm/min、4℃离心10 min后取上清;采用BCA法检测各样本上清中的蛋白浓度;每个样本取含定量蛋白的上清经加热变性处理后用SDS-PAGE凝胶(8~10%分离胶+5%浓缩胶)垂直电泳分离蛋白;电泳完成后将分离出的目标蛋白转移至硝酸纤维素(PVDF)膜上;将PVDF膜用5%脱脂奶粉封闭处理后用一抗工作液(TNF-α,1∶200,Abcam;IL-1β,1∶200,Abcam;IL-10,1∶400,Abcam;TGF-β,1∶400,Abcam)孵育,4 ℃过夜;TBST液充分洗涤后用辣根酶标记的二抗工作液(山羊抗鼠IgG,1∶2000,北京中杉)室温孵育2 h;再TBST液充分洗涤后进行化学发光、显影、定影,获得目标蛋白的印迹图像。β-actin作为内参。使用凝胶分析软件Quantity One(Bio-Rad)对免疫印迹条带进行光密度分析,以目标蛋白印迹条带光密度值与内参蛋白β-actin印迹条带光密度值的比值作为目标蛋白相对表达量。
1.5.4 数据分析
采用SPSS 19.0软件单因素方差分析对数据进行统计学分析,各组相关指标值用平均值 ±标准差(M±SD)表示。P<0.05被认为组间差异具有显著性意义。
2 结果
2.1 大鼠空间学习与记忆能力变化情况
在定位航行训练中,随着训练次数增加,各组大鼠平均逃避潜伏期时间均逐渐缩短,其中K组、S组在第3天表现出最优异成绩,即逃避潜伏期降到最短,随后几天与前1天相比没出现显著性差异,AE组和A组则分别在第4天和第5天后趋于稳定(图1a)。对各组大鼠每天的平均逃避潜伏期进行比较分析发现,K组和S组在整个定位航行训练期间均无统计学差异;A组从第2天起至训练结束,逃避潜伏期均显著性长于S组(第2、3、4天,P<0.01;第5、6天,P<0.05,图1a);AE组则在第2、4、5、6天显著性短于A组(P<0.05,图1a)。在MWM空间探索实验中,A组大鼠在60 s内穿越原有平台区域的次数与在目标象限中停留的时间均比S组显著性减少(P<0.01),而S组和K组之间无统计学差异;与A组相比,AE组大鼠在目标象限中停留的时间和穿越平台的次数有所增加(P<0.05)(图1c、图1d、图1e)。而不管是在定位航行训练期间还是在空间探索实验中,各组间大鼠游泳速度均无显著性差异(P>0.05,图1b),这排除了在MWM实验中的行为学差异是由于运动障碍造成的可能性。
2.2 大鼠海马神经元超微结构变化情况
在电镜下可观察到:K组和S组大鼠海马CA1区神经元分布规整,胞膜结构完整,胞质中线粒体、内质网以及高尔基复合体等细胞器含量丰富,结构正常,偶可见溶酶体,微丝微管排列规整;胞核形状规则,核膜光滑完整,核仁清晰可见(图2A、2B);神经突触较多,结构完整清晰,突触囊泡密集而均匀(图2a、2b)。A组神经元胞膜有溶解断裂现象,胞质中线粒体、内质网、高尔基复合体等细胞器数量明显减少,线粒体出现肿胀与空泡,部分线粒体嵴溶解消失;核膜皱缩、内陷呈锯齿样变,染色质固缩边聚,并可见凋亡小体形成(图2C);神经突触分布较为稀少,部分突触界限模糊,突触囊泡稀疏(图2c);AE组神经元结构较A组有明显改善,结构完整的线粒体增多,仍有肿胀,但较A组有所减轻(图2D);突触数量有所增加,突触轮廓较为清晰,突触间隙融合现象减轻,突触囊泡增多(图2d)。
2.3 大鼠海马促炎细胞因子TNF-TNF-α 、IL-IL-1 1β 的表达情况
在免疫荧光显微镜下观察,肿瘤坏死因子(tumor necrosis factor,TNF-α)和白介素-1β(interleukin-1β,IL-1β)荧光阳性物质在S组与K组大鼠的海马组织非常稀疏,而在A组和AE组的分布则较为密集,荧光强度明显增加(图3a,200倍)。对TNF-α和IL-1β的MFI进行分析发现,S组与K组均无显著性差异;与S组相比,A组与AE组两者的MFI明显增高(P<0.01);而AE组较A组有所降低(P<0.05,图3b)。通过Western Blot对TNF-α和IL-1β进行定量分析也支持这一变化趋势(图3c)。Western Blot分析结果显示,A组TNF-α和IL-1β相对表达量分别较S组提高306.9%和 255.6%,AE组则分别提高179.3%、147.8% ;AE组TNF-α和IL-1β的相对表达量较A组分别降低了31.4%、25.0%。

图1 Morris水迷宫实验结果

图2 海马组织电镜检测结果(7000×)
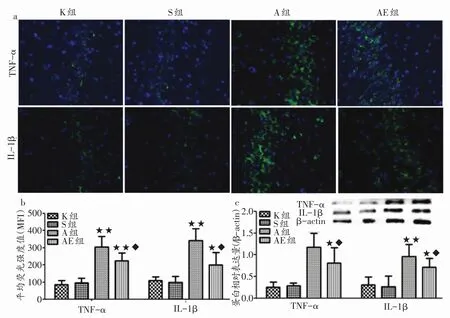
图3 大鼠海马促炎因子TNF-α、IL-1β的表达
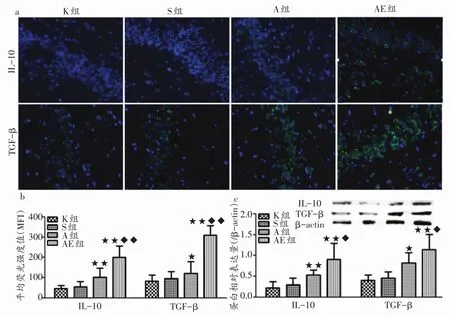
图4 大鼠海马抗炎因子IL-10和TGF-β表达
2.4 大鼠海马抗炎细胞因子IL-IL-1010和TGF-TGF-β 的表达情况
在免疫荧光显微镜下观察,白介素-10(interleukin-10,IL-10)和转化 生 长 因 子 -β(transforming growth factor-β,TGF-β)免疫荧光阳性物质在S组与K组大鼠的海马组织分布稀疏分布,荧光强度较弱;而在A组和AE组,免疫荧光阳性物质明显增加,除分布更为密集外,亮度也有所增强(图4a,200倍)。对MFI进行统计分析显示:在S组与K组之间,IL-10和TGF-β的MFI均无统计学差异;与S组相比,A组两种分子的MFI有所增加(IL-10,P<0.01;TGF-β,P<0.05),而AE组大鼠则较A组大鼠出现进一步增高(P<0.01,图4b)。Western Blot技术对IL-10和TGF-β进行定量分析显示同样变化趋势(图4c),其中A组IL-10和TGF-β相对表达量比S组分别提高80.0%、78.3%;AE组比S组分别提高203.3%、147.8%,比A组则提高68.5%、39.0%。
3 讨论
学习与记忆能力受损是AD病变最早出现的症状之一[1,2],而导致AD患者学习记忆受损的原因与机制目前尚不完全清楚。不过随着近年来研究的不断深入,人们已逐渐认识到Aβ沉积对脑组织神经元的毒性作用可能是学习记忆受损的重要原因[8,21-24]。Aβ由淀粉样前体蛋白(amyloid precursor protein,APP)在β、γ分泌酶的作用下剪切而成[23,24]。正常情况下Aβ可以被及时降解和清除,而病理情况下(如脑老化、基因突变、APP代谢异常、脑损伤等)Aβ产生过多或者不能被及时清除时,就容易沉淀、聚集形成寡聚体和原纤维,引起不可逆性神经元及其突触的退化、死亡、消失,使患者脑信息处理和传递能力降低,突触结构和功能可塑性下降,最终导致学习与记忆功能障碍而引起痴呆[8,21-24]。脑组织中内源性Aβ主要有 Aβ1-40和 Aβ1-42两种形式,其中Aβ1-40含量最多,但Aβ1~42因其更难溶解、更容易积聚形成原纤维和寡聚体而具有更强的神经毒性[24]。研究发现,向脑组织内直接注射Aβ可使动物产生学习和记忆功能障碍,出现行为学改变,并产生与AD相似的神经病理变[25]。因此,向脑组织内直接注射Aβ,被认为能够诱导AD脑组织病理的动物模型并被广泛用于AD防治策略及其神经机制探讨的相关研究中[26-28]。本实验在直接向大鼠双侧海马注射Aβ1-42后第5周所进行的MWM水迷宫实验结果显示,与生理盐水对照组(S组)大鼠相比,海马注射Aβ1-42的大鼠(A组)不管是空间参考学习能力还是记忆提取能力均表现出明显下降。而众所周知,海马是空间学习与记忆功能的关键脑区。随后对大鼠海马组织进行电镜技术观察则发现,A组大鼠海马CA1区出现明显的神经细胞受损,神经突触数量减少,突触囊泡稀疏。而同样方式注射生理盐水的大鼠(S组)则没有观察到明显的海马神经元和突触受损现象。这提示本实验采用的双侧海马直接注射Aβ1-42成功地诱导出AD海马组织病理模型。
越来越多的证据显示,AD患者的脑组织中伴随着慢性进行性炎症反应,并且这些炎症反应在AD病理变化中发挥重要作用[5,29]。AD患者和相关动物模型的脑组织检测均发现,一些炎症介质,如TNF-α、IL-1β、白介素-6(interleukin-6,IL-6)等促炎症细胞因子在AD患者脑组织中明显增加[5,29]。TNF-α和IL-1β被证实不仅直接对神经元产生毒性作用,还是免疫反应的发起者和关键介质,可以进一步激活免疫细胞,促进其它促炎因子和趋化因子的产生,启动多种介质的级联反应,形成恶性循环,产生慢性进行性炎症反应,导致不可逆性神经元退化、突触结构与功能受损[30,31]。来自体内外的实验资料显示,Aβ对神经元的毒性作用就与这些炎症细胞因子的产生以及炎症级联反应的激活有关[30-32]。本研究采用免疫荧光检测以及Western Blot分析发现,与S组相比,A组大鼠海马的炎症因子TNF-α和IL-1β的表达水平均呈倍数增加,提示 Aβ1-42可引起海马组织TNF-α和IL-1β促炎因子表达,使其处于炎症状态。值得注意的是,在促炎细胞因子表达水平升高的同时,A组大鼠海马组织的TGF-β和IL-10的表达水平也有所上调。TGF-β和IL-10等因能抑制促炎细胞因子的产生及其活性而被通称为抗炎细胞因子,它们的上调可以部分地抵消促炎细胞因子的作用,发挥神经保护功能[30]。但由于抗炎细胞因子表达水平相对较低,并不足以抗衡促炎细胞因子所诱导的炎症反应过程及其神经毒性作用,最终导致疾病慢性进行性发展。
不管是AD还是其他神经退行性疾病,由慢性炎症过程介导的恶性破坏性循环被证明是难以遏制的,因而到目前为止尚未寻到治愈这类疾病的有效方法。不过有大样本量的观察性研究数据显示,身体活动水平和机体炎症生物标记物之间存在高度负相关关系[33,34],并且一些干预性实验研究也表明规律的有氧运动可以减少循环系统C反应蛋白(C reactive protein,CRP)、IL-6、TNF-α等炎症标志分子浓度,使IL-4、IL-10、TGF-β等抗炎性细胞因子水平升高[35-38],有效抑制身体各系统的慢性炎症反应,尤其是患有慢性疾病者。那么,有氧运动能否调控AD患者脑组织中Aβ沉积诱发的炎症反应进而对AD发挥神经保护作用,改善认知功能?
来自人体流行病学数据提示,长期规律的运动,尤其是有氧运动对预防AD的发生或延缓其病程具有积极作用[13,14]。动物研究也表明,运动对几种AD动物模型学习和记忆缺陷具有预防作用,如TgCRND8小鼠[39]、APP/PS1老鼠[15]、3×Tg-AD小鼠[40]、侧脑室注射Aβ25-35诱导的AD模型[41]。本研究中,我们采用双侧海马Aβ1-42注射以诱导AD模型,在给予大鼠双侧海马Aβ1-42注射后即让其进行规律的从低到中等负荷的跑台运动,运动持续第5周时进行的MWM水迷宫实验结果显示,与生理盐水对照组(S组)相比,进行规律有氧跑台运动组的大鼠(AE组)虽然空间学习与记忆能力依然有明显受损,但显著优于没有进行运动干预的Aβ1-42模型组大鼠(A组);而且,在电镜下观察,AE组大鼠海马神经元结构较A组有明显改善,突触数量也有所增加,突触轮廓较为清晰,突触囊泡较多。这表明规律的有氧运动对Aβ1-42的毒性作用具有一定抑制效应,可减轻因Aβ1-42毒性作用导致的神经元受损及其空间学习记忆能力障碍程度。
有文献报道了规律的有氧运动可以减少AD患者血清中IL-6、TNF-α等促炎因子的浓度[42],但有氧运动对AD病变脑组织部位过量的Aβ诱发的炎症反应的影响尚不清楚。为观察有氧运动对Aβ诱发的炎症反应的影响,我们对海马部位的促炎因子TNF-α和IL-1β以及抗炎因子IL-10、TGF-β等的表达情况进行了检测和分析。不管是免疫荧光阳性物质分布及荧光强度值,还是Western Blot对这些蛋白相对表达量的分析,结果均显示AE组大鼠海马组织的促炎细胞因子TNF-α和IL-1β表达水平比A组出现了明显下调,而具有抗炎作用和神经保护作用的抗炎细胞因子IL-10和TGF-β表达水平均则出现了显著性增高。这表明5周规律的有氧运动不仅可一定程度抑制炎症细胞因子的表达,还可促进抗炎细胞因子TGF-β、IL-10的表达,从而可在更高程度上抵消促炎细胞因子的炎症损伤作用,调节机体免疫反应的平衡。这可能是本实验中有氧运动使Aβ1-42诱导的毒性反应减弱,最终减轻因Aβ1-42毒性作用导致的海马神经元受损以及空间学习记忆能力障碍程度的机制之一。
4 结论
本实验采用的双侧海马直接注射Aβ1-42成功地诱导出AD海马组织病理模型;长期规律的有氧运动对Aβ1-42的毒性作用具有一定抑制效应,进而减轻因Aβ1-42毒性作用导致的海马神经元受损及其空间学习记忆能力障碍程度;这种作用可能与有氧运动能抑制炎症因子并同时促进抗炎因子的表达,从而可在更高程度上抑制或抵消炎症反应,调节免疫平衡有关。有氧运动通过什么途径抑制促炎细胞因子、促进抗炎细胞因子的表达进而发挥炎症反应的调控作用机理有待进一步研究。

