发酵豆粕对大黄鱼生长、肠道结构及肠道微生物菌群的研究
何娇娇 王 萍, 冯 建 娄宇栋
(1. 浙江海洋大学,浙江省海洋养殖装备与工程技术重点室,舟山 316000; 2. 宁波大学海洋学院,宁波 315211)
大黄鱼(Larimichthys Crocea), 俗称黄花鱼。自1985年以来, 我国大黄鱼养殖业取得了很大的成就,但由于鲜杂鱼饵的病原性及进口鱼粉高昂的价格,显著影响了大黄鱼养殖业的发展[1]。因此, 基于当今鱼类营养饲料研究的发展趋势, 开发新型蛋白源用以满足不同养殖鱼类生长的需求是目前水产养殖饲料工业发展的必然[2]。近年来, 不乏学者用植物蛋白源对鱼粉进行了替代研究, 研究结果表明,植物蛋白源的可替代性与实验对象及实验设计相关[3]。本文以抗原含量较低且蛋白质优质的发酵豆粕为主要植物蛋白源。研究表明, 发酵豆粕中有大量的益生素、乳酸及未知生长因子等物质[4]。对石斑鱼(Epinephelus coioides)[5]、南美白对虾(Penaeus vannameiBoone)[6]、方正鲫(Carassius auratus)[7]的研究证实: 发酵豆粕在水产动物饲料利用上有较好效果。
肠道是集消化、吸收、代谢、免疫、内分泌于一体的特殊的“微生物摇篮”, 菌群数量众多, 各菌种之间互相制约, 互相依存, 达成一种生态平衡[8]。研究表明, 鱼类肠道菌群随鱼类的生长和饵料的改变而发生改变[9]。如钟蕾等[10]通过传统方法PCRDGGE分析了人工配合饲料和冰鲜鱼2种不同的饵料对鳡(Elopichthys bambusa)肠道菌群的影响。此前, 不少学者基于传统方法进行了肠道菌群的研究,如周志刚等[11]运用PCR-DGGE指纹图谱对川纹笛鲷(Lutjanus sebae)和圆白鲳(Ephippus orbis)消化道壁的优势菌群结构进行了比较分析; 李学梅等[12]运用PCR-DGGE技术研究了3种室内饲养鱼类肠道微生物群落。然而随着微生物领域的发展, 高通量技术突破了传统的研究方法, 为肠道微生物领域研究注入了一股新的活力。如赵晓伟等[13]运用MiSeq测序技术分析了红鳍东方鲀(Takifugu rubripes)养殖环境菌群的多样性; Wu等[14]运用Roche 454高通量测序的方法对异育银鲫(Carassius auratus gibelio)肠道菌群多样性及菌群来源进行了研究。显然,高通量技术已经成为研究肠道菌群的主流方法, 然而鲜见将大黄鱼肠道菌群用于评估发酵豆粕可利用性的文献报道。因此, 本文研究在养殖过程中发酵豆粕对大黄鱼幼鱼生长、肠道组织结构及肠道菌群的影响, 对于人工养殖技术的提高有着积极的意义, 可以有效地提高养殖动物的产量和养殖经济效益。

表1 实验饲料及营养水平(干物质基础)Tab. 1 Composition and nutrient levels of basal diets (dry matter basis) (%)
1 材料与方法
1.1 实验设计与实验饲料
实验饲料组(表1)中分别添加0 (FSM0)、15%(FSM15)、30% (FSM30)、45% (FSM45)、60%(FSM60)和75% (FSM75)发酵豆粕替代鱼粉组的基础饲料, 配制等氮等脂(蛋白水平为45%; 脂肪水平为10%)的6种实验用配合饲料。此外, 在基础饲料中以对照组(FSM0)的饲料赖氨酸、蛋氨酸含量为基准, 分别添加相应水平的晶体赖氨酸和蛋氨酸的五组实验饲料, 各实验组营养成分见表2, 其试验饲料制作过程及方法参照冯建等[15]试验方法。
1.2 实验用鱼和养殖过程
实验大黄鱼幼鱼(10.49±0.03) g均采自浙江省象山县西沪港区养殖场的同一批鱼种, 其试验管理参考冯建等[15]的方法进行。
1.3 样品采集和分析
参照冯建等[15]方法对每处理3个重复组样品进行9个样品的采集。从每个网箱随机取3尾体格健康的鱼, 活体解剖, 取出后肠组织于甲醛溶液中固定36h, 然后转入70%乙醇中保存, 用于后肠组织切片分析。应用Nikon ECLIPSE Ci (显微镜型号)对组织切片进行观察拍照, 运用Image-Pro Plus6.0软件测量分析肠组织的黏膜厚度, 黏膜皱褶高度, 并计数杯状细胞的数量及绒毛数量以及使用软件SPSS20对肠道指标进行方差分析。此外, 每个网箱随机另取5尾体格健康的大黄鱼幼鱼, 于无菌操作台上进行后肠取样, 用75%酒精擦拭肠道外壁, 用镊子去除附着表面的脂肪; 用磷酸盐缓冲液(pH 7.2)轻柔漂洗3次, 将肠道壁漂净后剪碎放入灭菌50 mL EP管中, 来源于同一网箱的5个样本混匀, 先放入液氮罐保存待带回实验室于–20℃保存用肠道菌群研究。

表2 实验饲料氨基酸组成(干物质基础)Tab. 2 Amino acid composition of the experimental diets (dry matter) (%)
1.4 Illumina-MiSeq宏基因组测序
肠道菌群总DNA的提取及PCR扩增肠道细菌总DNA的提取采用bacterial DNA Kit试剂盒(Omega, 美国), 具体步骤参照试剂盒说明。以提取的基因组DNA作为模板进行16S rRNA基因V4—V5区扩增特异区域, 其引物为515F (5′-GTGC CAGCMGCGCGG-3′)和907R (5′-CCGTCAATTCM TTTRAGTTT-3′)。PCR反应体系为(50 μL):10×PCR缓冲液5 μL, dNTPs mixture (各2.5 mmol/L)4 μL, 引物(10 mmol/L)各2 μL, 模板DNA 10 ng, ExTaq酶(TaKaRa, 大连) 1.5 U, 灭菌双蒸水补足至50 μL。PCR反应条件: 94℃ 5min; 94℃ 1min, 55℃ 45s,72℃ 1min, 35个循环; 72℃ 10min (PCR仪为ABI Gene-Amp 9700 型)。扩增好的DNA序列, 经琼脂糖电泳检测阳性后交由南京集思慧远生物科技有限公司用Illumina MiSeq (Illu-mina, 美国)高通量测序技术进行序列测定和分析。
富集并扩增DNA文库将每一个样品DNA等量混合后, 采用标准的Illumina Tru Seq DNA文库制备试验流程构建所需的宏基因组上机文库, 并在Illumina MiSeq基因组分析平台上进行Barcoded Illumina MiSeq测序, 采用PE2500测序策略, 每个样品完成1个PE的文库构建, PE library Insert size为500 bp; 每个样品产出最低不少于2万对reads, Clean date测序质量Q30>75%。试验流程为: 在3′—5′核酸外切酶及聚合酶的共同作用, 修复带有突出末端的DNA片段, 在修复平整的DNA片段3′末端引入单碱基A, 接头的3′末端含有单碱基T, 从而保证DNA片段和接头能通过A和T配对连接。利用PCR选择性地富集两端连有接头的DNA片段, 同时扩增DNA文库。
1.5 数据处理及统计分析
生长数据处理
存活率(Survival) (%)=100×Nt/N0;
增重率(Weight gain rate,WGR) (%)=100×(Wt–W0)/W0;
特定生长率(Specific growth rate,SGR) (%)=100×(lnWt–lnW0)/t;
饲料系数(Feed conversion ratio,FCR)(%)=(T–S)/(Wt–W0);
摄食率(Feed intake,FI)(%)=100×dry feed intake×2/[(Wt+W0)×t]。
上述公式中W0、Wt分别表示实验鱼初始体重和终末体重;N0、Nt分别表示养殖实验开始时网箱中鱼的尾数和养殖试验结束时网箱中鱼的尾数;t表示实验天数;T、S分别表示总饲料量和剩余饲料量。
Illumina Miseq 测序数据处理Illumina Miseq测序所得原始测序序列经去除primer并按barcode切分, 同时进行质控, 过滤掉碱基平均质量值小于20的reads; 序列长度小于200的reads。用usearch软件对数据进行去嵌合体和聚类的操作。usearch聚类时, 先将reads按照丰度从大到小排序,通过97%相似度的标准聚类, 得到OTU (Operational Taxonomic Units)。在聚类过程中利用denovo方法去除嵌合体(Chimeras)。接下来对每个样品的tags进行随机抽平处理, 并在各个水平上统计每个样品的群落组成。然后使用Qiime软件, 做alpha多样性指数的稀释曲线, 分别利用物种丰富度指数(Chao1)、香农指数(Shannon)和辛普森指数(Simpson)公式计算细菌生态多样性指数; 利用Mothur软件制作柱状图、Venn图及盒子图以作OTU分析。
采用SPSS20.0软件对文中所得数据进行单因素方差分析(ANOVA), 差异显著后进行Tukey’S多重比较, 显著性水平设为P<0.05; 实验结果以平均值±标准差表示。
2 结果
2.1 发酵豆粕替代鱼粉对大黄鱼幼鱼生长的影响
从表3中可以看出, 各处理组大黄鱼幼鱼的存活率无显著性差异(P>0.05), 但有下降趋势; FSM60和FSM75组特定生长率(SGR)、增重率(WGR)显著低于FM0组(P<0.05); 饲料系数(FCR)以FM0组最低, 显著低于FSM60和FSM75组(P<0.05)。
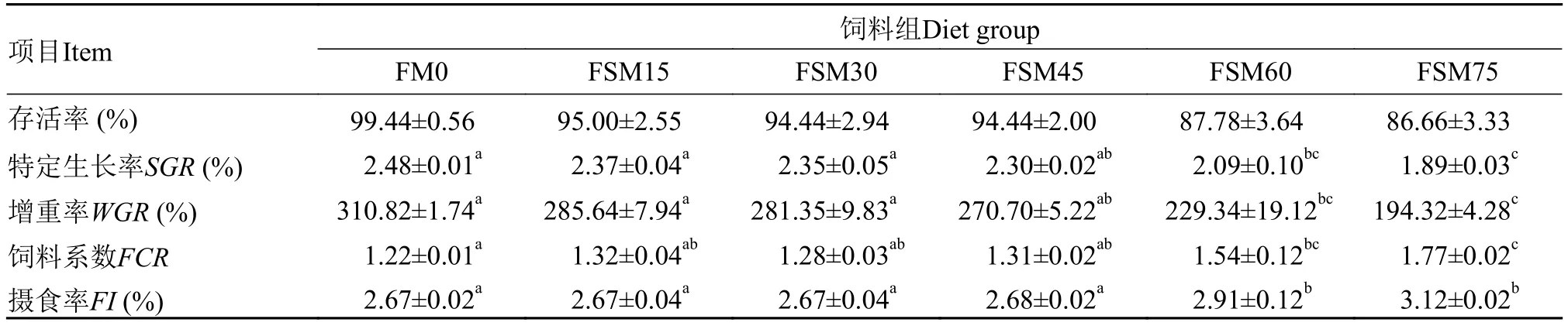
表3 FSM替代鱼粉对大黄鱼幼鱼生长的影响Tab. 3 Effects of FSM on the growth of juvenile large yellow croaker
2.2 发酵豆粕替代鱼粉对大黄鱼幼鱼肠道形态的影响
由表4、图1可以看出, 各处理组肠道组织结构后肠黏膜厚度、皱襞高度、固有膜宽度和杯状细胞个数与对照组均无显著差异性(P>0.05)。
2.3 发酵豆粕替代鱼粉对大黄鱼幼鱼肠道菌群的结构分析
16S rRNA 基因测序结果分析运用usearch进行聚类划分可操作分类单元(OTU), FSM0(TC)、FSM45(TB)和FSM75 (TW) 9个样品共产生119个OTU。香农指数(Shannon)(图2A)用于反映样品中菌群多样性指数, 本实验9个样品起初曲线上升比较迅速, 随着测序的深入, 所有样品测序所得序列的数值升高直至曲线平滑, 最后可以看到各样品曲线趋于平坦, 可以反映出大黄鱼幼鱼后肠样品中绝大多数菌种信息。通过计算在同一样本中检测到的随机选择扩增子序列的覆盖率(Goods coverage)来评估抽样的完整性, goods coverage (图2B)指数反应了测序的深度, 指数越接近于1, 说明测序深度已经基本覆盖到样品中所有的物种, 此研究中各样品如表5中所示各样品覆盖指数均在0.99, 覆盖率水平表明此研究中各样品中的微生物种类几乎都被检测到了。
细菌多样性及相关性分析3组测序样品的序列进行比对, 在生物分类学门的水平进行分类,共有9个门的细菌被发现。如图3所示, 其中厚壁菌门(Firmicutes)占绝对优势地位。在属水平, 对微生物群落结构与不同样品间的差异进行分析, 可以得到20个不同的属(图3), 其中类芽孢杆菌(Paenibacillus)占绝对优势。基于以上门、属水平分析表明不同处理的大黄鱼幼鱼肠道菌群中优势菌种类相同。
以各样品中分布的OTU数为计算依据, 用MO-THUR软件中的venn命令对各样品中菌群菌种的多样性进行分析并构建韦恩图(图4)。依据图中的数据, 仅从样品中细菌类别的多样性角度进行定性分析, 不同处理组的大黄鱼幼鱼后肠肠道菌群结构具有一定的保守性。研究结果表明大黄鱼幼鱼后肠肠道内含物样品的9个克隆文库一共119个OTUs,其中59个共同OTUs, 占三者OTU总数的49.58%;TB与TC共有62个OTU, 占两者OTU总数的52.10%;TW与TC共有71个OTU, 占两者OTU总数的59.66%; TB与TW共有71个OTU, 占两者OTU总数的59.66%。从大黄鱼幼鱼后肠肠道样本的菌群相似性来看, 说明尽管是不同发酵豆粕替代水平的饲料其在相同养殖环境下大黄鱼幼鱼后肠肠道细菌群落的相似性较高, 具有一个核心的微生物菌群。
各处理在属水平的差异本实验中如图5,较TW组, TB和TC组均显著增加了类芽孢杆菌(Paenibacillus)和嗜碱菌属(Alkaliphilus)的物种丰度(P<0.05); 与TW组相比, TB组水栖菌属(Enhydrobacter)和TC组副球菌属(Paracoccus)的物种丰度均显著降低(P<0.05)。

表4 饲料中FSM对大黄鱼幼鱼肠道显微结构指标的影响Tab. 4 The effects of FSM on intestinal microscopic structure
3 讨论
3.1 发酵豆粕替代鱼粉对大黄鱼幼鱼生长的影响

图1 饲料中FSM对大黄鱼幼鱼肠道形态的影响 (后肠, 100×)Fig. 1 The effects of FSM on the intestinal morphology of juvenile large yellow croaker (posterior intestine, 100×)

图2 大黄鱼幼鱼后肠样品测序序列香农指数(A)、覆盖率(B)稀释曲线(相似度: 97%)Fig. 2 Shannon index (left) and good coverage (right) rarefaction curves of sequenced reads in posterior intestine of large yellow croaker(The rightsimilarity: 97%)
发酵豆粕采用微生物发酵后, 有效降低了豆粕中抗营养因子的含量[16], 使之更容易被水产动物所吸收。通过豆粕和发酵豆粕替代鱼粉的对比试验,刘兴旺等[17]发现: 替代卵形鲳鲹(Trachinotus ovatus)相同水平的饲料鱼粉, 发酵豆粕组的增重率和饲料利用率显著高于普通豆粕替代组。Sharawy等[16]用酿酒酵母固态发酵豆粕对在印度明对虾(Fenneropenaeus indicus)饲料配方中的鱼粉进行了替代研究, 其结果显示, 酿酒酵母固态发酵豆粕可以应用于印度明对虾的养殖实践, 但是随着替代比例的增加, 印度名对虾的SR、SGR显著下降, 完全替代组(FS100)达到最低水平(SR为90%和SGR为4.92)。本实验也得到了相似结果, 虽然各替代水平的大黄鱼幼鱼存活率并无显著差异, 但有明显的下降趋势。从表4的数据中可以看到: 与对照组相比, 发酵豆粕替代45%以下水平的饲料鱼粉, 其SR、SGR、WGR和FCR并无显著差异(P>0.05), 但超过45%的替代水平,SGR、WGR显著低于对照组,FCR显著高于对照组(P<0.05), 这表明大黄鱼幼鱼饲料中发酵豆粕的适宜比例为45%, 超过45%则会对其生长产生不利影响, 这与牙鲆(Paralichthys olivaceus)的适宜替代比例相同[18]。而淡水的黄金鲫(Carassius auratus)对发酵豆粕表现出更强的适应性, 其替代比例可达52.5%[19]。在本实验中, 发酵豆粕替代鱼粉超过45%后, FI反常的显著高于对照组, 原因可能是投饵时大黄鱼幼鱼虚假抢食, 造成误判而过度饵料, 导致了FI的升高。

表5 样品的多样性指数Tab. 5 Alpha-diversity of samples

图3 在生物分类学门、属的水平对组测序样品序列进行分类Fig. 3 The relative abundance of posterior intestine from large yellow croaker with different diets, by phylum and genus
3.2 发酵豆粕替代鱼粉对大黄鱼幼鱼肠道组织结构的影响
肠道是营养物质消化吸收的重要部位, 其营养消化吸收原理与肠道黏膜具有的生化屏障和免疫屏障功能息息相关[20]。大黄鱼肠道黏膜层形成许多纵行褶皱, 皱襞为消化管较大的突起, 使消化吸收面积大大增加[21]。目前鱼类肠道组织的研究主要集中在组织学上, 关于发酵豆粕对鱼类肠道形态结构影响的研究较少。在本试验条件下, 大黄鱼幼鱼发酵豆粕各处理组黏膜厚度、皱襞高度、固有宽度和杯状细胞个数与对照组均无显著差异性, 这与Couto[22]、Gao[23]和Zhou等[24]研究结果类似。然而, 在Venold等[25]对投喂豆粕的虹鳟(Oncorhynchus mykiss)研究发现, 其肠道形态与对照组有显著差异; 吴莉芳等[26]研究去皮豆粕投喂埃及胡子鲇(Clarias lazera)时发现其替代鱼粉比例超过45%时肠道皱襞高度均显著下降; 张锦绣等[27]研究去皮豆粕替代鱼粉喂养幼建鲤(Cyprinus carpiovar.jian)时发现会导致其前后肠皱襞高度显著下降。目前,普遍认为豆粕中的凝集素、抗原蛋白、大豆皂苷等会破坏鱼类的消化道结构, 使肠道受伤害, 但豆粕经发酵处理后能消除大分子抗原蛋白和有效降低胰蛋白酶抑制因子[28]。程璐[29]在异育银鲫(Carassius auratus gibelio)饲料的研究中添加不同比例的发酵谷物蛋白, 其结果表明, 发酵谷物蛋白各试验组的异育银鲫前肠的黏膜褶高度和宽度与鱼粉对照组均无显著性差异, 其研究结果与本试验相似。本实验肠道形态结构未受到显著影响, 一方面可能是因为豆粕经微生物发酵后抗营养因子减少, 减轻了肠道的过敏反应, 维持肠道结构的完整性; 另一方面, 经微生物发酵后的豆粕富含生物活性物质, 可以促进肠道内营养物质的消化吸收。

图4 不同处理组的共同OTU分析Fig. 4 Shared OTU analysis of different groups

图5 各处理在属水平的差异比较Fig. 5 Comparison of effects with different treatments in the level of Genus
3.3 发酵豆粕替代鱼粉对大黄鱼幼鱼肠道微生物的影响
水产动物的肠道中有大量的微生物, 它们在长期的历史进化过程中形成了一个动态的复杂的微环境, 在这个微环境中, 肠道微生物是否维持稳态,直接影响着鱼体的消化吸收、防御及生长发育[30]。因此, 建立健康的肠道微生物区系, 有助于提高水产动物的生产性能。本实验采用Illumina高通量测序技术比较了不同发酵豆粕替代鱼粉水平对大黄鱼幼鱼肠道细菌群落结构和多样性的影响, 发现处于门和属的分类水平上, 不同处理的大黄鱼幼鱼肠道菌群中优势菌群种类相同, 其门水平上的厚壁菌门(Firmicutes)和属水平中类芽孢杆菌属(Paenibacillus)占绝对优势, 推测这些优势菌群可能和其在苗种阶段就已经定值的菌群相关。Michelle等[31]认为处于孵化阶段的幼鱼, 其所需营养物质来源于卵黄, 当其孵化出来, 由于其消化道发育不全, 消化道内处于无菌状态, 当其接触到水生环境及饵料时,多种细菌就会进入到肠道, 最初进入到肠道的微生物适应环境后定植于肠道上皮, 维持动态平衡, 与鱼体形成互利共生关系且在生长过程中优势菌群并不会随环境和其他因素发生明显的变化。通过ven图分析发现在相同养殖环境下, 不同发酵豆粕替代水平饲料对大黄鱼幼鱼后肠肠道细菌群落的相似性影响不大, 具有一个核心的微生物菌群。这与Wong等[32]研究了不同饲料组分下虹鳟鱼的肠道微生物具有一个核心的微生物菌群结果类似。
类芽孢杆菌属(Paenibacillus)源于芽孢杆菌属(Bacillus), 是一类重要的防治病害的微生物, 其能产生抗菌蛋白质或酶等抗菌物质诱导宿主的抗病能力[33]。水栖菌属(Enhydrobacter)是γ-变形菌纲(Gammaproteobacteria)的弧菌科, 弧菌是海水养殖动物的主要病原菌之一。副球菌属(Paracoccus)其为球形, 呈单个、成对或堆存在, 是a-变形菌纲(Alphaproteobacteria)的红杆菌科(Rhodobacteraceae)其为兼性厌氧菌[34]。本试验结果表明, 使用高替代量的发酵豆粕后, 大黄鱼幼鱼肠内类芽孢杆菌丰度TW组显著低于TC和TB组, 而水栖菌属(Enhydrobacter)物种丰度TB组显著低于TW组, 副球菌属(Paracoccus)物种丰度TC组显著低于TW组, 这可能与发酵豆粕营养特性有关。有研究表明, 发酵豆粕中含有大量有益微生物(如乳酸菌)及具有类抗生素作用的代谢物, 适量的替代量在一定程度上能有效抑制肠道有害菌的增殖[35]。然而豆粕经过发酵工艺后, 由于抗营养因子在发酵过程中因钝化机理、加工程度不同导致其消除程度有所差异[36], 使得高发酵豆粕替代组受某些抗营养因子(如大豆球蛋白等)的影响, 打破肠道菌群的稳态, 阻碍益生菌的生长, 使得变形菌门(Proteobacteria)物种丰度增加[37],这与张振男等[38]研究的摄食高蚕豆组的草鱼肠道中有益菌物种丰度减少, 条件致病菌物种丰度增多结果类似。推测摄食高发酵豆粕组大黄鱼肠道菌群生态系统稳态遭到破坏, 可能会引发肠道感染,从而影响到鱼体生长。
4 总结
本实验用发酵豆粕对大黄鱼幼鱼饲料鱼粉进行替代研究, 发现FSM替代45%的鱼粉不会影响其生长、肠道组织结构及优势菌群变化, 但是随着替代水平的进一步升高, 存活率、特定生长率下降,因此, 在本实验条件下, FSM替代饲料(含40%鱼粉)45%的鱼粉较为适宜。

