捞刀河浏阳段河蚬的遗传多样性及生殖特征研究
王剑平 李德亮, 曾 聪, 朱鹏飞 占江凡
(1. 湖南农业大学, 湖南省特色水产资源利用工程技术研究中心, 长沙 410128;2. 水产高效健康生产湖南省协同创新中心, 常德 415000)
河蚬Corbicula fluminea原产于亚洲、非洲、澳洲和中东地区, 后扩散到北美、南美和欧洲, 成为世界知名的入侵种, 且对入侵地的经济和生态分别造成严重的危害[1]。我国是河蚬重要的原产区,河蚬因其丰富的营养价值和药用价值历来深受我国东南沿海民众的喜爱, 且是重要的渔业对象之一[2,3]。据记载[4]蚬肉具有开胃、明目、止咳、化痰和解酒等功效, 是重要的中药材。此外, 河蚬还是人类重要的副食品, 也是畜禽类和鱼类的天然饵料[5,6]。近年来, 随着采捕强度的增加, 天然河蚬资源衰退趋势剧增[7,8], 故其资源状况与遗传多样性评价也逐渐受到重视, 以期为其资源的合理开发和有效保护提供参考。已有的研究分别采用微卫星、细胞色素氧化酶Ⅰ(COⅠ)和细胞色素b(Cytb)分子标记分析了洪泽湖河蚬的遗传多样性和群体遗传结构, 证实洪泽湖河蚬种群具有较高的遗传多样性水平, 种质资源较为丰富, 且不同湖区河蚬群体间没有形成显著的遗传结构, 遗传分化较低[9—11]。
大量研究[12]证实, 河蚬存在有性生殖和无性生殖两种生殖方式, 无性生殖即专性雄核生殖。北美、南美和欧洲等入侵地的蚬均营专性雄核生殖,而原产地的蚬则两种生殖方式并存。雌雄同体和双鞭毛精子被认为是雄核生殖方式的典型特征[13]。目前, 我国学者先后对淀山湖[14]、辽宁大洋河[15]、黄河三角洲[16]和洪泽湖[17]河蚬的生殖特征进行研究, 证实河蚬为雌雄异体[16]或以雌雄异体为主, 存在少量雌雄同体个体[14,15,17]。张健[18]发现大通湖河蚬以雌雄同体个体为主, 雌雄同体、雄性和雌性的比例为25∶1∶11。尽管如此, 国内有关河蚬精子形态特征(尤其是双鞭毛精子)的相关报道较少。
捞刀河是湘江的一级支流河, 发源于浏阳市石柱峰北麓, 流经浏阳市、长沙县和长沙市区, 最终于长沙市开福区汇入湘江, 全长共141 km, 流域面积2543 km2, 为长沙市第二大内河, 河中拥有较为丰富的河蚬资源。本研究以线粒体细胞色素氧化酶Ⅰ (COⅠ)部分序列为分子标记, 对捞刀河浏阳段河蚬的种群遗传多样性进行评价, 并分别从性腺组织学和精子形态学方面分析其生殖特征, 以期丰富河蚬的繁殖生物学信息, 并为开展其人工繁殖及资源保护提供参考。
1 材料与方法
1.1 实验材料
河蚬样品采自捞刀河浏阳段(乌龙渔场: 113.429°E,28.289°N), 共计40个, 壳长21.60—31.79 mm; 壳宽12.20—17.25 mm; 壳高18.33—25.86 mm。
1.2 DNA提取
采用海洋动物组织基因组DNA提取试剂盒(TIANamp Marine Animals DNA Kit)提取新鲜河蚬外套膜DNA后, 使用核酸蛋白仪(Eppendorf, 德国)测定DNA的OD值, 确定DNA浓度, 再用1% 琼脂糖凝胶电泳检测DNA质量, 剩余样品DNA于–20℃保存备用。
1.3 PCR扩增与测序
线粒体细胞色素氧化酶Ⅰ(COⅠ)序列扩增的通用引物为LCO 1490 (5′-GGTCAACAAATCA TAAAGATATTGG-3′)和HCO 2198 (5′-TAAAC TTCAGGGTGACCAAAAAATCA-3′)[19], 由武汉奥科鼎盛生物科技有限公司合成。PCR反应体系为25 μL, 包括: DNA模板1 μL (100 ng/μL), 2.5 μL的10×TaqBuffer, 上下游引物LCO 1490、HCO 2198各(10 μmoL/L) 1 μL, 2 μL的dNTP,TaqDNA聚合酶0.2 μL及17.3 μL的ddH2O。PCR反应条件程序为94℃预变性5min, 94℃变性1min, 52℃退火45s,72℃延伸1min, 共35个循环, 最后72℃延伸5min。取5 μL扩增产物进行1% 琼脂糖凝胶电泳检测, 在凝胶成像系统下确定PCR产物为目的条带后, 用琼脂糖凝胶DNA回收试剂盒(TIANgel Midi Purification Kit)纯化目标产物, 并及时送于武汉奥科鼎盛生物科技有限公司进行测序。
1.4 精子形态分析
解剖并剪取上述已去除外套膜的河蚬性腺, 蒸馏水冲洗, 轻挤压出精液, 蒸馏水稀释精液, 稀释后的精液与伊红染液等体积混合, 涂片镜检。将挤压后的性腺置于酒精醋酸福尔马林混合固定液中保存, 备做组织学分析。
1.5 组织学分析
取酒精醋酸福尔马林混合固定液保存的性腺标本, 经酒精脱水、二甲苯透明及透蜡, 于石蜡包埋和切片, HE染色后封片, 镜检。
1.6 数据处理与分析
测序所得序列分别与GenBank[20]中其他蚬属贝类线粒体COⅠ基因序列比对后, 使用Geneious R11 软件[21]对其进行编辑、排序和手动校对。序列的多重比对采用MEGA 6.0软件[22]中的Clustal W软件包[23]进行, 并计算序列碱基组成、变异位点数等。利用DnaSP 5.0软件[24]分析样品线粒体COⅠ基因序列的单倍型, 并计算种群的单倍型多样性(h)、核苷酸多样性(π)和平均核苷酸差异数(k)。
2 结果
2.1 种群遗传多样性
经过对捞刀河浏阳段河蚬线粒体COⅠ基因序列排序、校对和剪辑, 获得614 bp的基因序列, 其中, A、T、C和G四种碱基平均含量分别为22.70%、41.60%、14.50%和21.20%, A+T的含量(64.30%)明显高于C+G的含量(35.70%)。40条COⅠ序列检出17个变异位点, 约占基因序列的2.76%, 定义4种单倍型(图1), 分别为hap1 (Gen-Bank登录号为KT893373, 下同)、hap2 (MG595699)、hap3 (MG595700)和hap4 (KT893357)。该河段河蚬种群的平均单倍型多样性为0.664±0.042, 平均核苷酸多样性为0.014±0.006, 平均核苷酸差异数为8.595。
2.2 性腺组织学特征
捞刀河浏阳段40个河蚬中, 存在雌雄同体个体27个(占67.50%) (图2c-f)、雄性(图2a)个体10个(占25.00%)和雌性(图2b)个体3个(占7.50%), 三者的比例约为6∶3∶1。在对雌雄同体个体的性腺切片观察中发现存在雌性生殖细胞的滤泡数量明显多于雄性生殖细胞滤泡数量(图2c)或雄性生殖细胞的滤泡数量明显多于雌性生殖滤泡(图2d)数量的现象。此外, 其滤泡存在2种类型: 滤泡并存型即精卵细胞分布于不同的滤泡中(图2e); 滤泡混合型即精卵细胞分布于同一滤泡中(图2f)。
2.3 精子形态特征
在34个进行精子形态分析的河蚬中, 雌雄同体个体23个, 雄性8个, 雌性3个。其中, 雌雄同体和雄性个体精子均具有双鞭毛(图3)。
3 讨论
3.1 种群遗传多样性
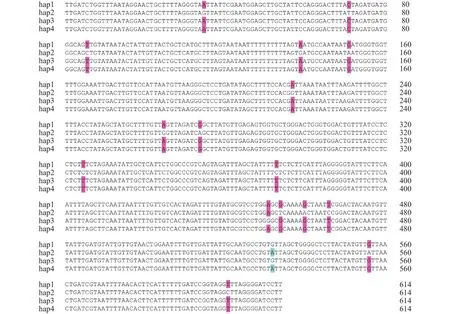
图1 捞刀河浏阳段河蚬线粒体COⅠ部分序列4个单倍型与可变位点Fig. 1 Detection of 4 haplotypes and 17 variable sites in partial mitochondrial COⅠ sequences of Corbicula fluminea from the Laodao River in Liuyang city

图2 捞刀河浏阳段河蚬性腺组织学显微结构图(a. 雄性; b. 雌性; c—f. 雌雄同体)Fig. 2 Photomicrographs of sections of the gonads of Corbicula fluminea from the Laodao River in Liuyang city (a. male; b. female; c—f.hermaphrodites)
捞刀河40个河蚬COⅠ基因序列(614 bp)中,A、T、C和G四种碱基平均含量分别为22.70%、41.60%、14.50%和21.20%, A+T的含量(64.30%)高于C+G的含量(35.70%)。洪泽湖[10]河蚬线粒体COⅠ序列中A+T含量(65.00%)也高于C+G含量(35.00%)。因此, 本研究结果再次证明线粒体DNA序列碱基组成的不均一性, 具有很强的偏倚性[25]。单倍型多样性和核苷酸多样性是衡量物种遗传多样性的两个重要指标[26]。Grant等[27]根据线粒体DNA序列的遗传变异, 将不同单倍型多样性指数(h)和核苷酸多样性指数(π)间的组合分成4 种类型: 低h(<0.5)与低π(<0.005); 高h(>0.5)与低π(<0.005); 低h(<0.5)与高π(>0.005); 高h(>0.5)与高π(>0.005)。本研究中40个河蚬共检出4 种单倍型和17个变异位点, 平均单倍型多样性指数(h)为0.664,平均核苷酸多样性指数(π)为0.014, 符合高h与高π类型。尽管如此, 本研究的结果均低于以COⅠ为分子标记(614 bp)所计算的洪泽湖[10,11]河蚬种群的结果。李大命等[10,11]分别在50个和77个洪泽湖河蚬中发现单倍型15个和22个, 核苷酸变异位点67个和73个, 平均单倍型多样性指数0.870 和0.889, 平均核苷酸多样性指数0.045 和0.04499。这种差异或许是由于2个区域河蚬的性别系统和生殖方式不同所造成的。浏阳河河蚬以雌雄同体为主, 而洪泽湖河蚬一般雌雄异体, 偶见少量雌雄同体[17]。大量研究[12]证实, 雌雄同体河蚬可以通过自体受精或者异体受精(雌雄同体个体之间或雄性与雌雄同体个体之间)方式来完成生殖, 而自体受精则必然导致种群遗传多样性降低[13]。因此, 推测雌雄同体个体的自体受精或许是造成捞刀河浏阳段河蚬种群遗传多样性相对较低的主要原因之一。尽管如此, 该推论还有待于更进一步地分析和证实。

图3 捞刀河浏阳段河蚬的精子形态Fig. 3 Sperm morphology of Corbicula fluminea from the Laodao River in Liuyang city
3.2 种群生殖特征
本研究中捞刀河浏阳段河蚬存在雌雄同体、雄性和雌性个体, 三者比例约为6∶3∶1, 其中雌雄同体个体占半数以上, 雌性个体最少。该研究结果与张健等[18]对湖南大通湖河蚬性别特征分析的结果相似, 同时也表明捞刀河浏阳段河蚬种群存在雌雄同体和雌雄异体两种性别系统。但研究发现鄱阳湖[28]和黄河三角洲[16]的河蚬均为雌雄异体, 且性别比为1∶1。此外, 淀山湖[14]、辽宁大洋河[15]和洪泽湖[17]的河蚬也均以雌雄异体为主, 但存在少量雌雄同体个体。可见河蚬的性别系统在不同水域具有较大的差异。某些学者[13,29]提出河蚬的性别机制与其栖息环境有关, 不同地区性别表现不同, 并且无法从外形上区分性别。文献报道[14]软体动物的雌性生殖细胞的分化是自动分化, 而雄性生殖细胞分化是由雄性激素等因子所调控的, 推测河蚬雌雄同体个体的出现可能与该类因子的影响有关。尽管如此, 河蚬多样化的性别机制还有待于进一步深入分析研究。本研究中河蚬雌雄同体个体的生殖滤泡存在两种类型: 一是滤泡混合型, 即精卵细胞分布于同一滤泡中; 二是滤泡并存型, 即精卵细胞分布于不同的滤泡中, 并存于性腺中的不同区域。该2种生殖滤泡分布方式与毕婷婷[17]在洪泽湖河蚬和张健[18]在大通湖河蚬中的研究结果相似。
本研究结果显示, 捞刀河浏阳段雌雄同体和雄性河蚬的精子均为双鞭毛。类似的结果在日本也有报道, 志贺县栗东市野洲河Corbicula leana雄性个体的精子均具有双鞭毛, 并推测该雄性个体可能源自同种的雌雄同体个体[26]。Pignuer等[13]研究证实, 雌雄同体和双鞭毛精子是雄核生殖方式的典型特征。故推测捞刀河浏阳段河蚬主要的生殖方式为雄核生殖, 其次是有性生殖。雄核生殖过程是指精子和卵子受精后, 合子在发育过程中卵原核以两个极体的方式被完全排出, 而合子的细胞核仅仅由精子原核发育而成[30—32]。因具有该生殖方式河蚬产生的精子均是未减数的, 即DNA含量与父本一致, 而非正常两性生殖中精子染色体数目和DNA含量均为父本的一半, 故雄核生殖后代完全是父本的克隆[26]。尽管雄核生殖后代的细胞核来源于父本,但线粒体基因组则完全来源于母本。由于营雄核生殖的河蚬一般都是雌雄同体, 且主要通过自交或同种杂交的方式繁殖, 故后代细胞质和细胞核基因组来源不同往往没有较大的特殊意义, 而当杂交发生在不同蚬属种类之间时, 就会造成后代细胞质基因组信息与细胞核基因组信息的错配[26]。因此, 捞刀河浏阳段河蚬的专性雄核生殖特征及其在种群进化进程中的生物学意义还有待进一步深入分析研究。

