慢性阻塞性肺疾病合并肺炎患者凝血功能的变化
许 文,杨 华
慢性阻塞性肺疾病(Chronicobstructivepulmonarydisease,COPD),简称慢阻肺,是由于有毒颗粒或气体作用导致气道和(或)肺泡的破坏形成的,主要表现为持续呼吸道症状和不可逆气流受限的全身性涉及多器官系统损害的复杂疾病,其对全身健康状况存在广泛影响[1, 2]。社区获得性肺炎(communityacquiredpneumonia,CAP)是医院外获得的感染性肺实质炎症,包括具有明确潜伏期的病原体并在平均潜伏期内发病的肺炎,是老年患者重要的死亡原因之一[3]。呼吸道细菌感染使慢阻肺进入急性加重期,反复急性加重使肺功能下降加剧,患者生活质量受严重影响,同时患者免疫力下降,容易合并肺炎[4]。肺炎是导致慢阻肺患者入院的主要因素,且合并肺炎患者并发症多,也是导致患者死亡的常见原因[5]。慢阻肺急性加重导致患者缺氧、系统性炎症加重,血管内皮损伤,血小板聚集,激活凝血系统,使血液处于高凝状态[6]。目前慢阻肺急性加重期患者伴有高凝及纤溶亢进态已被临床医生熟知,但关于COPD合并肺炎患者凝血功能变化报道较少,本文就此进行探索,为临床诊治提供参考。
1资料与方法
1.1纳入与排除标准 纳入标准:⑴慢阻肺符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的《慢性阻塞性肺疾病诊治指南(2013年修订版)》标准[7]及慢性阻塞性肺疾病急性加重诊治专家组制定的《慢性阻塞性肺疾病急性加重诊治中国专家共识(草案)》[8];⑵肺炎诊断符合《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》[9]。排除标准:⑴合并高血压、糖尿病、血液系统疾病、严重肝肾功能疾病、肿瘤等疾病患者;⑵2周内口服或静脉使用糖皮质激素者;⑶3月内有手术或外伤者;⑷凝血功能障碍者;⑸2周内有抗凝及抗血小板聚集药物使用者。
1.2研究对象一般资料 选取2016年9月至2017年8月于我院诊治的COPD患者120例,所选取患者均经临床诊断明确,依据病史及胸部X线或CT分是否合并肺炎分为COPD并肺炎组(n=54)和AECOPD组(n=66),并选择同期于我院健康体检中心行健康体检者50例作为健康对照组。AECOPD并肺炎组中男33例,女21例,年龄61-79岁,平均(69.8±8.6)岁;AECOPD组男40例,女26例,年龄60-81岁,平均(70.1±9.0)岁;对照组中男30例,女20例,年龄60-80岁,平均(71±8.8)岁。3组资料在性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.3检测指标及方法 采用Sysmex(日本希森美康)XN-10全自动血细胞分析仪检测白细胞计数(WBC)、中性粒细胞百分数(NEUT%)、血小板(PLT);Stago(法国思塔高)STA-EVOLUTION全自动血凝分析仪检测血浆纤维蛋白原(Fbg)、血浆凝血酶原时间(PT)、血浆凝血酶时间(TT)、活化部分凝血活酶时间(APTT);日立7600-020全自生化分析仪检测C-反应蛋白(CRP)、D-二聚体(D-D);Radiometer(丹麦雷度)AQT90FLEX免疫分析仪检测降钙素原(PCT);JAEGER(德国椰格)MS-10S肺功能检测仪检测用力肺活量(FVC)、第一秒用力呼气容积(FEV1);Radiometer(丹麦雷度)ABL90FLEX血气分析仪检测血气指标PaO2、PaCO2。

2结 果
2.1三组患者凝血指标比较COPD并肺炎组D-D、Fbg高于AECOPD组和对照组,且AECOPD组高于对照组(P<0.05);COPD合并肺炎组、AECOPD组PT水平高于对照组(P<0.05),COPD合并肺炎组与AECOPD组比较差异无统计学意义(P>0.05);三组间APTT、PLT、TT水平比较差异无统计学意义(P>0.05)。见表1。
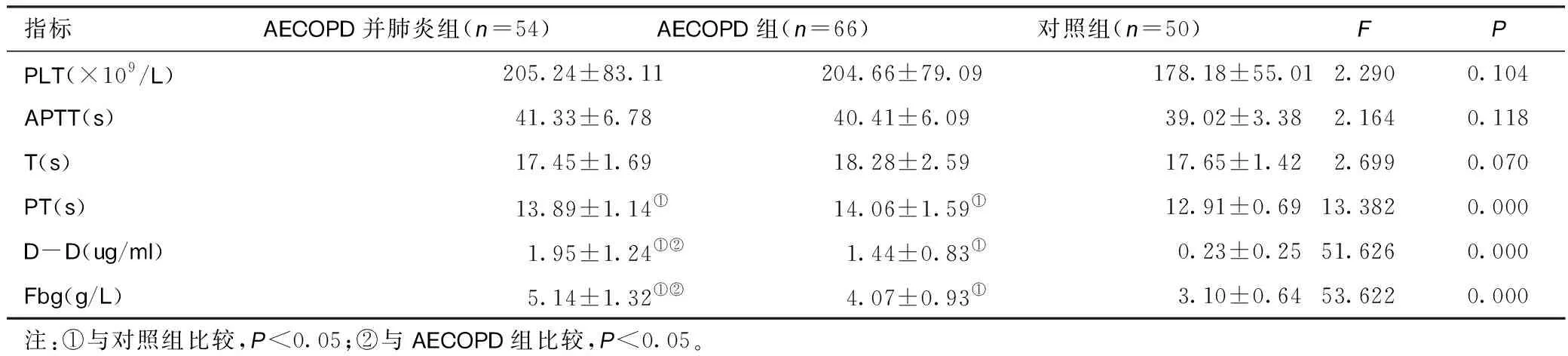
表1 三组患者凝血指标比较
2.2三组患者炎症指标比较COPD并肺炎组WBC、NEUT%、PCT、水平高于AECOPD组和对照组(P<0.05),COPD合并肺炎组与AECOPD组比较差异无统计学意义(P>0.05);COPD并肺炎组CRP水平高于AECOPD组和对照组,且AECOPD组高于对照组(P<0.05)。见表2。
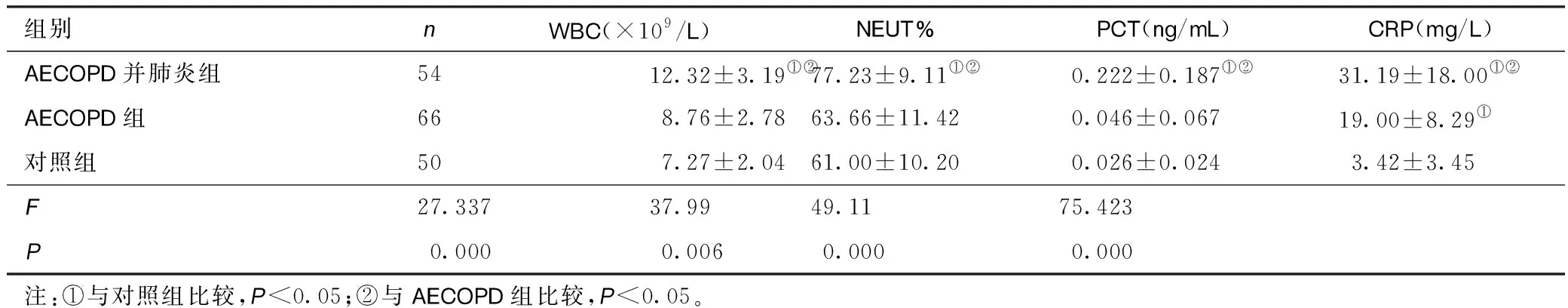
表2 三组患者炎症指标比较
2.3三组患者肺功能及血气指标比较COPD并肺炎组、AECOPD组FEV1、FEV1/FVC低于对照组(P<0.05),COPD并肺炎组低于AECOPD组(P<0.05)。COPD并肺炎组PaO2低于AECOPD组,PaCO2高于AECOPD组,差异有统计学意义(P<0.05)。见表3。
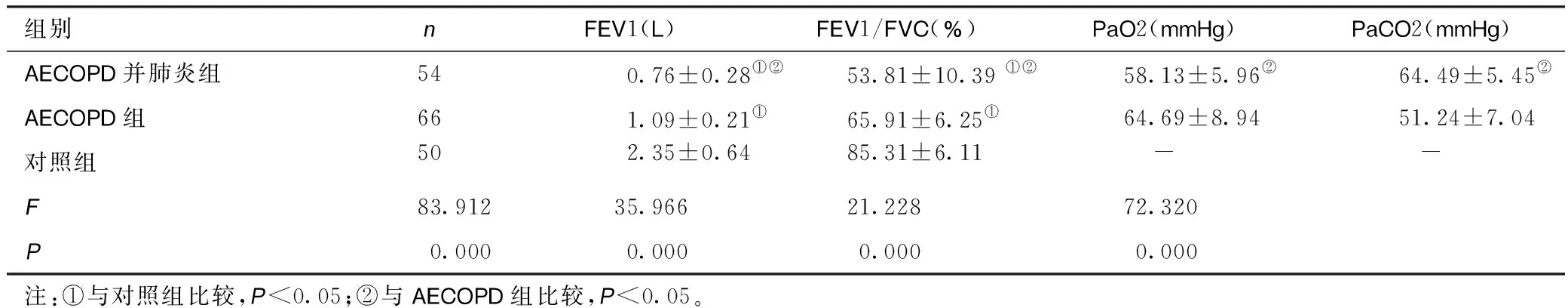
表3 三组患者肺功能及血气指标比较
3讨 论
全球人口COPD的患病率和死亡率较高,全球COPD的患病率达8.9%-11.7%[10, 11],是仅次于肿瘤、心血管疾病及脑血管疾病的第四大致死性疾病,并具有逐年上升趋势,预计到2020年将成为全球第三大致死性疾病[12]。COPD患者在其病程中,反复出现急性加重,中位发作频率为2.4-3次/年,慢阻肺急性加重可对COPD患者的自然病程产生诸多不利影响,是导致患者病情加重的常见危险因素,是患者住院和死亡的主要原因,且COPD反复发生急性加重可导致肺功能迅速恶化,患者的生活治质量严重下降,经济负担加重及病死率增加[4, 13]。研究显示,慢阻肺急性加重的诱因中下呼吸道感染占80%,并且其中40%-50%为细菌感染[14, 15],同时慢阻肺患者生理机能降低,免疫功能低下,呼吸道防御能力明显下降,更容易发生感染[16],因此,可以认为慢阻肺患者尤其是急性加重期常合并肺炎。COPD急性加重是以小气道病变为主,终末气道病变不显著,而COPD合并肺炎时,其病变不仅累积小气道,还可累积肺泡管、肺泡及肺间质。本研究结果显示COPD合并肺炎患者肺功能FEV1及FEV1/FVC明显低于单纯AECOPD,PaO2明显低于AECOPD,PaCO2明显高于AECOPD,这说明COPD合并肺炎患者存在明显的呼吸功能下降、低氧血症和高碳酸血症,因此COPD合并肺炎患者存在的病情较单纯AECOPD更加严重。有研究显示FEV1%是慢阻肺并发肺炎患者病情发展的重要危险因素[17],应尽早对COPD并肺炎患者进行呼吸干预,降低患者不良预后风险。
研究显示炎症反应是COPD发病的中心环节,参与了COPD及COPD合并肺炎的全部过程[18]。炎性指标水平与细菌感染存在相关性,是评价细菌感染的重要指标。CRP、WBC、NEUT%、PCT等是临床常用的炎症指标。WBC、NEUT%,受较多因素影响,特异性低,在应激状态、创伤、恶性肿瘤等情况可出现升高。CRP是一种非特异性炎性因子,在体内肿瘤坏死因子和白介素等炎症因子的刺激下合成增加,在不同类型感染性疾病及自身免疫性疾病均可出现不同程度升高。PCT是无激素活性的降钙素的前体物质,经细胞内蛋白水解酶水解为降钙素后发挥抗炎调节功能,其含量受体内其他激素分泌影响较小,在健康人体内PCT水平很低。当细菌感染时,PCT水解为降钙素受抑制,释放入血水平增高,细菌感染24小时达峰浓度[19],且PCT水平的高低与细菌感染的严重程度呈正相关[20],同时PCT水平在非特异性炎症、肿瘤及自身免疫性疾病等情况下升高不明显,其可作为判断COPD是否合并肺炎的重要指标。本研究发现,COPD合并肺炎患者炎症指标明显高于单纯AECOPD患者。因此可认为COPD合并肺炎患者炎症较AECOPD患者严重,存在明显的应激损害反应,与既往研究结果相似[21]。
慢阻肺稳定期患者长期缺氧,可出现代偿性红细胞在增多,血液粘滞度增高;当慢阻肺处于急性加重期时,患者炎症加重,体液丢失,血液浓缩血液粘滞度明显升高,红细胞聚集性增强,易导致血液的凝固性增加,从而发展为血栓前状态[22]。AECOPD、COPD合并肺炎患者存在Fbg升高和PT水平升高,且COPD合并肺炎患者Fbg高于单纯AECOPD患者,PT水平两组患者中比较无差异,这说明AECOPD、COPD合并肺炎患者存在显著得的凝血功能异常。PT主要反应外源性凝血功能。AECOPD、COPD合并肺炎患者体内存在缺氧、炎症介质释放、细菌内毒素,导致血管内皮细胞损伤和功能紊乱[23]。内皮细胞是凝血、纤溶的调控中心,其功能受损可直接影响凝血、纤溶平衡。受损后的内皮细胞vWF、组织因子(TF)表达及释放增加,内皮下组织暴露,在钙离子存在的条件下,活化FⅦ,启动外源性凝血系统,导致凝血或纤溶系统活化[24]。纤维蛋白原(Fbg)是由肝脏实质细胞合成,是凝血系统的重要蛋白之一,是凝血过程中凝血因子相继激活的最终底物,具有止血、介导血小板聚聚、影响血液粘度等功能,纤维蛋白原增高也是血液高凝状态的重要指标之一[25],因此AECOPD、COPD合并肺炎患者存在明显的高凝状态,既往研究显示[26,27],慢阻肺急性加重患者存在显著的高凝状态,本研究结果与之相似,同时本研究结果表明COPD合并肺炎患者高凝状态较单纯AECOPD患者严重。应用肝素等抗凝治疗后,可缓解血液高凝状态,防止肺内血栓形成,改善肺部循环状态,促进肺部毛细血管气体交换,达到改善肺功能、缺氧及酸中毒的作用[28]。D-D是纤溶酶原激活后降解交联的纤维蛋白多聚体的一种特异性降解产物,是一个特异性的纤溶过程标记物,可早期提示体内存在继发性纤溶,同时也是体内高凝状态的分子标记物之一[29]。本研究结果显示,AECOPD、COPD合并肺炎患者D-D明显高于健康对照组,且COPD合并肺炎患高于单纯AECOPD患者,这说明在AECOPD、COPD合并肺炎患者不仅存在高凝状态而且存在纤溶功能亢进,且COPD合并肺炎患者纤溶功能亢进强于单纯AECOPD患者。D-D水平的升高提示患者凝血酶活性增加及血管内纤维溶解、血栓形成,导致肺栓塞风险增加。因此,在监测COPD合并肺炎患凝血功能的同时,对纤溶指标的检测和分析,对全面评估患者病情、及时采取适当的干预措施、改善患者预后具有重要作用。
综上所述,COPD合并肺炎患者体内存在显著的炎症反应、高凝状态和纤溶功能亢进,临床工作中应对患者凝血、纤溶及炎症指标进行全面及时的监测,及时采取恰当的干预措施,提高治疗效果、改善患者的预后。由于本研究病例数量有限,病例入组可能存在选择偏倚,故结论存在局限性,尚有待于今后大样本、严格设计的深入研究进一步验证。

