Cajal间质细胞对肠易激综合征大鼠内脏敏化的作用及机制
张蓉,卢王,张静瑜,秦明,王景杰
肠易激综合征(irritable bowel syndrome,IBS)是临床上最常见的功能性胃肠疾病,发病率呈逐年上升趋势。该病的显著特点是内脏敏化[1],即当患者摄入辛辣食物、运动或情绪激动时常诱发肠道发生过度的蠕动反应,但是在正常人群中上述刺激并无此作用[2-4]。有研究表明,肥大细胞大量浸润可能参与了IBS的内脏敏化过程[5]。c-kit信号通路与IBS内脏敏化密切相关[6-8]。有研究者提出IBS患者大量分泌胃肠道干细胞因子可刺激肥大细胞上的c-kit激酶活性,导致肥大细胞在肠道局部增生,并促进肥大细胞脱颗粒反应,进而引起内脏敏化的发生[9-11]。在胃肠道,c-kit分布于Cajal间质细胞(interstitial cells of Cajal,ICC),并参与调节ICC的增殖和正常生理功能[12]。作为胃肠道的起搏细胞,ICC参与了胃肠道慢波形成和神经肌肉信号传递过程,与胃肠动力密切相关[13]。肥大细胞与ICC在IBS内脏敏化中发挥何种作用,以及c-kit信号上调是通过肥大细胞还是ICC来诱发内脏敏化,值得深入研究。本研究采用色甘酸钠(disodium cromoglycate,DC)抑制肥大细胞脱颗粒及ICC增殖,探讨肥大细胞和ICC对IBS内脏敏化的作用及其机制。
1 材料与方法
1.1 实验动物及试剂 清洁级雌性SD大鼠孕鼠购自空军军医大学实验动物中心。羊抗兔IgG(1:500)、ABC复合物(1:500)、肥大细胞稳定剂DC购自美国Sigma公司;兔抗c-kit血清(1:3000)购自美国Santa-Cruz公司;Alexa Fluor 488标记的驴抗大鼠IgG抗体(1:1000)购自美国Jackson公司;甲磺酸伊马替尼(imatinib mesylate,STI-571)购自美国Abcam公司。
1.2 IBS造模及分组 采用清洁级雌性SD大鼠孕鼠,待孕鼠生产后,将母鼠与乳鼠分离喂养4周准备进行实验[14]。采用腹部回缩反射法(AWR)对4周龄正常大鼠以及经与母鼠分离处理后的模型大鼠进行检测。具体方法如下:乙醚麻醉大鼠,将测压球囊经直肠插入5cm,用胶布固定,置于安静环境;待大鼠苏醒后缓慢向球囊打气,分别检测引起大鼠腹部抬起及背部拱起的压力阈值,每一阈值均重复检测3次,每次持续30s,间隔5min,数据取平均值。采用SPSS 19.0软件统计并计算正常大鼠压力阈值的95%CI。经与母鼠分离处理的大鼠压力阈值如果超出此95%CI上限,即视为造模成功[15-16]。
实验共分7组,每组10只。正常对照组(A组):正常大鼠,不加干预;结肠扩张组(B组):给予结肠扩张刺激;IBS模型组(C组):造模成功的IBS大鼠,不加干预;IBS结肠扩张组(D组):造模成功的IBS大鼠,给予结肠扩张刺激;IBS+STI-571组(E组):造模成功的IBS大鼠,腹腔注射STI-571 0.5ml/(kg·d),连续5d,再给予结肠扩张刺激;IBS结肠扩张+DC组(F组):造模成功的IBS大鼠,腹腔注射DC 20mg/(kg·d),连续5d后给予结肠扩张刺激;IBS结肠扩张+STI-571+DC组(G组):造模成功的IBS大鼠,腹腔同时注射STI-571 0.5ml/(kg·d)和DC 20mg/(kg·d),连续5d后给予结肠扩张刺激。结肠扩张方法为:将气囊缓慢插入大鼠结肠至距离肛门35mm处固定约30s,静置5min后再用注射器向气囊注入1.0ml蒸馏水。
1.3 大鼠腹直肌肌电检测 取每组5只大鼠,将电极置于大鼠腹中线两侧,电极间距3~4cm,采用RM6280B生物信号采集处理软件(成都仪器厂生产)记录和分析腹壁肌电活动。记录安静无刺激状态下的腹直肌放电幅值,维持30s。间期休息5min后,对结肠扩张组进行结肠扩张刺激,再次记录给予肠道压力后的腹直肌放电幅值。电生理记录仪参数设置:采集频率40kHz,扫描速度200ms/div,灵敏度500μV,时间常数0.001s,滤波频率3kHz。
1.4 激光共聚焦显微镜观察大鼠ICC增殖活化情况 每组取5只大鼠进行灌注内固定后立即剖腹,取乙状结肠处0.4cm×0.2cm大小组织,置于含4%多聚甲醛固定液X-100的0.1mol/L PBS中固定6h(4℃),取出标本移入30%蔗糖液24h(4℃)。超低温切片机(美国NUAIR公司)切片,厚10μm。将标本置于0.3%H2O2–甲醇液中浸泡30min封闭内源性过氧化物酶;用0.1% Triton浸泡30min,PBS漂洗;加入免疫血清稀释的1:200 c-kit兔多抗,4℃孵育过夜(约14h);第2天将切片和铺片置于室温下复温1h,经PBS漂洗后加入四甲基异硫氰酸罗丹明(TMRITC,1:60稀释)标记的抗兔IgG二抗及异硫氰酸荧光素(FITC)标记的抗小鼠IgG二抗,室温孵育3h;PBS漂洗,将铺片平置于载玻片上,与切片标本同时采用60%缓冲甘油封片。每张铺片或切片取4~6个视野,于激光共聚焦显微镜下观察大鼠ICC增殖活化情况,并将数字化图像储存于LSCM系统中进行图像分析。
1.5 DCN神经元单位放电测定 取每组另外5只大鼠进行骶髓后连合核(dorsal commissural nucleus,DCN)神经元单位放电测定。选择S1处(参照Paxnos图谱第2版,位于L6-S3之间)的锥板,将其咬除,暴露脊髓,去除硬脊膜,通过反馈式电热毯将动物体温控制在正常生理范围内[直肠温度(37±1)℃]。采用单管玻璃微电极细胞外记录的方法,以玻璃微电极(5~10MΩ)在暴露脊髓背侧正中线约0.8~1.0mm、深度600~1000μm范围内寻找典型的电活动范围(wide dynamic range,WDR)单细胞电位,待放电稳定后开始记录。
1.6 统计学处理 采用SPSS 19.0 软件进行统计分析。计量资料以表示,组间比较采用非参数检验。荧光半定量结果经ImageJ 1.43软件处理得到荧光光度值。DCN放电频率、荧光光度值、腹直肌电差异采用Kruskal-WallisH检验及Nemenyi秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 IBS大鼠内脏敏化现象 各组大鼠腹直肌肌电检测结果如图1所示。未经结肠扩张刺激前,IBS大鼠腹直肌肌电频率和幅度均高于正常对照组(A组vs.C组,P<0.05),即静息状态下IBS大鼠腹痛反应高于正常大鼠。结肠扩张刺激可导致正常及IBS大鼠腹痛反应增高(A组vs.B组,C组vs.D组,P<0.05),且IBS结肠扩张组的腹痛反应明显高于结肠扩张组(B组vs.D组,P<0.05,表1),表明IBS大鼠存在内脏敏化现象。

图1 各组大鼠腹直肌肌电检测结果(n=5)Fig.1 Test results of the the myoelectricity of rectus abdominis in each group of rats (n=5)
表1 各组大鼠腹直肌肌电检测结果(±s,n=5)Tab.1 Test results of the myoelectricity of rectus abdominis in each group of rats (±s,n=5)
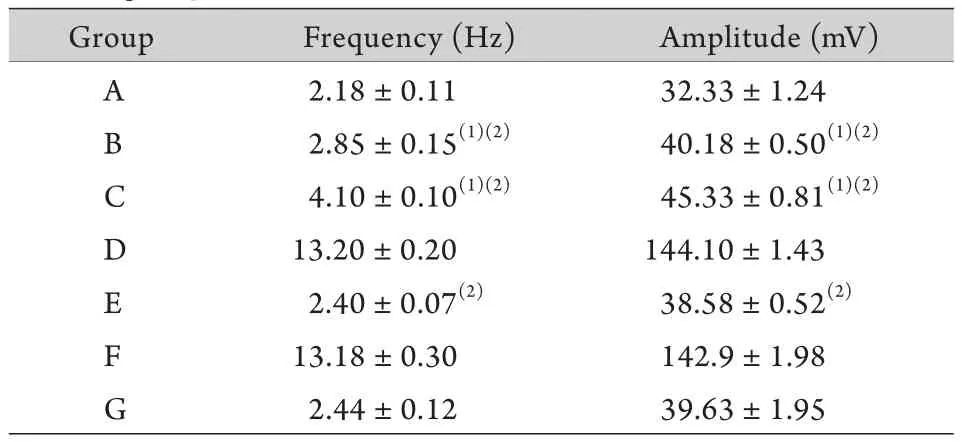
表1 各组大鼠腹直肌肌电检测结果(±s,n=5)Tab.1 Test results of the myoelectricity of rectus abdominis in each group of rats (±s,n=5)
A.Group A (normal control); B.Group B (normal control with colonic expansion); C.Group C (IBS model); D.Group D (IBS model with colonic expansion); E.Group E (IBS model with colonic expansion and receiving STI-571); F.Group F (IBS model with colonic expansion and receiving DC); G.Group G (IBS model with colonic expansion and receiving both STI-571 and DC).(1)P<0.05 compared with group A; (2)P<0.05 compared with group D
Group Frequency (Hz) Amplitude (mV)A 2.18±0.11 32.33±1.24 B 2.85±0.15(1)(2) 40.18±0.50(1)(2)4.10±0.10(1)(2) 45.33±0.81(1)(2)D 13.20±0.20 144.10±1.43 E 2.40±0.07(2) 38.58±0.52(2)C F 13.18±0.30 142.9±1.98 G 2.44±0.12 39.63±1.95
2.2 DC抑制肥大细胞活性对IBS大鼠腹痛的影响 F组肌电频率和幅度分别为(13.18±0.30)Hz和(142.90±1.98)mV,D组肌电频率和幅度分别为(13.20±0.20)Hz和(144.10±1.43)mV,两组之间差异无统计学意义(P>0.05),即采用DC抑制肥大细胞脱颗粒,并不能有效抑制接受结肠扩张刺激的IBS大鼠的腹痛反应。G组肌电频率和幅度分别为(2.44±0.12)Hz和(39.63±1.95)mV,E组肌电频率和幅度分别为(2.40±0.07)Hz和(38.58±0.52)mV,两组之间差异无统计学意义(P>0.05),即在抑制ICC增殖的基础上使用DC也不能抑制腹痛反应,提示肥大细胞在IBS内脏敏化中未发挥主导作用。此外,抑制ICC增殖可以有效降低IBS动物的腹痛反应(D组vs.E组,P<0.05,图1,表1)。以上结果表明ICC而非肥大细胞在IBS内脏敏化过程中发挥了关键作用。
2.3 IBS内脏敏化与ICC变化的关系 结肠刺激可导致正常大鼠结肠ICC密度轻微增高,但差异无统计学意义(A组vs.B组,P>0.05);IBS大鼠结肠ICC密度高于正常大鼠(P<0.05);对比C、D两组发现,在IBS基础上给予结肠球囊扩张刺激进一步加剧了IBS大鼠肠道ICC的增殖,导致ICC密度明显增高,差异有统计学意义(P<0.05),提示IBS大鼠结肠内ICC增殖活力明显高于正常大鼠;通过D、E两组比较发现,STI-571明显抑制了IBS大鼠肠道的ICC增殖(P<0.05);而通过D、F两组比较发现,DC对IBS大鼠肠道ICC增殖活化的作用不大(P>0.05,图2)。
2.4 IBS内脏敏化过程中扩张刺激引起的DCN放电频率的变化 由图3可见,正常状态下大鼠(A组)放电频率较为规律,IBS大鼠(B组)DCN放电频率较稳定,但明显高于正常大鼠(P<0.05)。给予结肠刺激后的IBS大鼠(D组)DCN放电频率明显增加,且高于正常结肠扩张刺激大鼠(B组,P<0.05)。与结肠刺激IBS大鼠(D组)相比,给予STI-571腹腔注射的结肠扩张IBS大鼠(E组)DCN放电频率明显下降(P<0.05)。给予DC腹腔注射的IBS结肠扩张大鼠(F组)DCN放电频率与仅给予结肠刺激的IBS大鼠(D组)相比,差异无统计学意义(P>0.05)。提示DCN异常电活动参与了IBS的内脏敏化过程。
3 讨 论

图2 DC对IBS大鼠肠道ICC活化的影响(双重荧光免疫组织化学法)Fig.2 Effect of DC on the activity of ICC in IBS rats (Double immunofluorescence histochemistry)
IBS的显著特征是内脏高敏感和胃肠道的异常运动。有研究认为,肥大细胞的活化会引起脱颗粒改变,造成组织胺的释放,进而引起炎性物质或神经活性物质的改变[17-18]。新近研究表明,在IBS发生过程中,胃肠动力起搏及调节的肠道ICC在数量、超微结构及功能方面均发生了明显变化,并有新的、电活动异常的ICC再生,这种再生及原有变异的ICC可产生不规律的异常电生理活动[2]。更为重要的是,异常电活动可以通过ICC与胃肠神经丛形成突触样联系,传递给支配相应胃肠运动的中枢神经核团[19]。
本研究结果显示,给予肥大细胞稳定剂DC以及给予IBS大鼠结肠扩张刺激后,大鼠腹直肌肌电活动及DCN的放电频率均呈现明显变化,与给予ICC抑制剂的大鼠比较明显增高,差异有统计学意义(P<0.05),提示在IBS的内脏敏化和胃肠异常运动方面,ICC的异常改变及其电生理活动变化所产生的结果明显强于以往认为的肥大细胞的作用,这与Brijs等[20]的研究结果类似。同时,本研究从形态学上证实IBS大鼠胃肠道ICC发生了明显增殖,这可能是IBS内脏敏化的形态学基础。此外,本研究通过电生理实验证实ICC产生的异常兴奋电信号可以上传至骶髓DCN,导致DCN敏化而过度兴奋,过度兴奋的DCN进一步将异常电信号上传至大脑皮层引发腹痛或者下传至腹部靶器官,进而加重其所支配的胃肠道运动功能产生异常。
本研究所关注的ICC是介于胃肠神经-平滑肌之间,自身存在自发性节律电活动并可将这种自发性节律电活动以放大方式传播至受其支配的平滑肌,从而引发平滑肌收缩的关键细胞,各种胃肠调节环节通过调节ICC节律放电的产生及传播而对胃肠平滑肌的蠕动节律和动力进行调节,表明ICC在胃肠动力以及顺序蠕动调控中处于关键性地位。Wang等[21]在旋毛虫诱导的IBS动物模型中发现,感染初期,ICC突起发生斑片状破坏,同时发生胞内线粒体数量减少、中间丝网络和细肌丝丢失等超微结构变化,并有新的ICC再生,使ICC与平滑肌和肠道局部神经元之间的联系中断,功能上表现为ICC电活动异常,并失去电活动的同步性,出现多个异位起搏点,造成电失偶联的发生,以及局部慢波频率的紊乱。另外,损伤后的ICC可以再生,而再生后的ICC形态与正常ICC不同,尤其是对刺激的反应阈值明显降低,电活动出现明显异常,预示IBS可导致ICC出现敏化反应,发生IBS时ICC的病理改变是导致胃肠功能紊乱和内脏感觉异常最直接的病理生理学基础。
综上所述,本研究通过形态学、电生理学等方法证实ICC在IBS内脏敏化中起主导作用,而肥大细胞并未起到关键作用,这为IBS的临床治疗提供了新的思路,并为进一步研究IBS内脏敏化的分子机制指明了新的方向,有助于进一步全面理解IBS发病机制以及新型药物的研发过程。

