铁皮石斛水提物对PM2.5所致人外周血淋巴细胞DNA损伤和炎症反应的抑制作用
包永芬*,程梦琳*,白育庭,尚云龙,陈玲芳,单士刚
(湖北科技学院1.基础医学院,2.临床医学院,湖北咸宁 437100;3.浙江康恩贝制药股份有限公司,浙江杭州 310000)
铁皮石斛(Dendrobium officinale Kimura et Migo)为兰科(Orchidaceae)石斛属(Dendrobium)多年生草本植物,是我国传统的名贵中药材,道家经典《道藏》将其列为中华“九大仙草”之首。现代毒理学研究表明,铁皮石斛无遗传毒性、无致突变作用,可作为新资源食品应用[1]。现代药理学研究表明,其具有抗氧化、抗疲劳、调节免疫力、降血糖、抗肿瘤和防辐射性损伤等作用[2-6]。雾霾是近年来困扰我国许多城市和地区的空气污染问题。目前我国至少有30%的国土、约8亿人口长期承受不同程度雾霾的困扰[7]。雾霾可通过炎症机制和氧化损伤机制对人体健康造成损害。流行病学研究表明,机体血中炎症标志物水平增加与居民长期暴露于空气污染环境相关[8]。PM2.5因颗粒小,比表面积大,可吸附大量的有毒有害物质,且在大气中滞留时间长,易进入肺泡、肺间质进入血管,到达其他器官,对机体健康造成严重影响。PM2.5附着大量的有害物质,其中多环芳烃为主的有机物和各种重金属是主要致DNA损伤的成分[9-10]。人群免疫功能损伤、心血管疾病和呼吸系统疾病等与PM2.5浓度增加密切相关[11-13],并且均有炎症因子参与。本研究以PM2.5处理培养人外周血淋巴细胞(human periph⁃eral blood lymphocytes,hPBL),随后加入铁皮石斛水提物(Dendrobium officinale water extract,DOWE),检测DOWE对PM2.5所致hPBL DNA损伤和炎症反应的抑制作用。
1 材料与方法
1.1 药材和样品制备
新鲜铁皮石斛于2015年3月30日采自云南,经鉴定为兰科植物铁皮石斛,标本保存在浙江康恩贝制药股份有限公司浙江现代中药与天然药物研究院(编号20150330)。取铁皮石斛适量,去根、叶后保留茎部,适度粉碎置圆底烧瓶中,加入8倍量蒸馏水浸没药材,浸泡30 min后,加热至煮沸,保持微沸60 min,分离煎出液;药渣加入4倍量蒸馏水,依法再次煎煮30 min;合并2次煎出液,置50℃水浴锅中缓慢蒸发,浓缩至0.5 L,干燥、粉碎,即得DOWE,于4℃保存备用。严格按照《中华人民共和国药典》(2010年一部)方法检测DOWE主要成分。结果表明,干粉中浸出物28.7%,多糖35.5%,甘露糖17.3%。实验前用磷酸盐液冲液(PBS)0.01 mol·L-1的溶解成不同浓度的溶液,过滤,4℃保存备用。
1.2 试剂和仪器
RPMI 1640培养基、青霉素-链霉素、胎牛血清和0.05%胰蛋白酶(美国Gibco公司);淋巴细胞分离液(天津灏洋生物);CCK8试剂盒(碧云天生物技术研究所);白细胞介素1β(interleukin-1β,IL-1β)和IL-2 ELISA试剂盒(武汉博士德生物工程有限公司);肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)ELISA试剂盒(美国R&D公司)。FOR⁃MA3111型CO2恒温培养箱(美国Thermo公司);TE200倒置相差显微镜(日本Nikon公司);SNP1-PM10/PM2.5空气采样仪(美国AT公司);PM2.5重量分析纤维滤膜、超声振荡清洗仪和64R型低温高速离心机(美国Beckman公司);Bio-Rad酶标分析仪(680型)(美国Bio-Rad公司)。
1.3 PM2.5的采集和制备
选取武汉市医学院校门口(车流量大、污染较重)为采样点,应用智能TSP中流量采样器采集2015年3~8月的大气PM2.5于专用质量分析纤维滤膜上,洗脱、过滤,真空冷冻干燥成干粉,收集干粉于-20℃保存备用。经分析发现,所收集物质绝大部分颗粒物粒径基本<2.5 μm,较大颗粒表面平整光滑,棱角钝化,且黏附较多更加细小的颗粒物。PM2.5中的微生物种群分属于3个细菌类群:厚壁菌门、β变形细菌门和绿弯菌门。用生理盐水稀释成相应浓度的PM2.5溶液,高压蒸汽灭菌10 min,4℃保存。临用前超声振荡使颗粒物充分混匀。
1.4 细胞制备和培养
取健康志愿者外周血10 mL,与10 mL PBS混合均匀,缓慢滴加等密度的人淋巴细胞分离液,离心(500×g,20 min),取中间白色絮状层,用8 mL PBS稀释离心2次,每次250×g离心10min。弃上清液,取淋巴细胞加至4 mL RPMI 1640细胞培养液中,加入10%胎牛血清、青霉素100 kU·L-1、链霉素100 mg·L-1和PHA 20 mg·L-1(均为终浓度),制成hPBL单细胞悬液备用。
1.5 CCK8测定hPBL存活
将上述单细胞悬液调整细胞密度至1×108L-1,接种于96孔板,每孔100 μL(空白对照组加入等体积的培养基),37℃,5%CO2培养48 h,分别加入不同浓度PM2.5溶液(终浓度为10,20,40,80和160 mg·L-1)培养24 h;或预先加入DOWE(终浓度为25,50,100,200和400 mg·L-1)培养1 h,随后加入PM2.5溶液(终浓度为40 mg·L-1)继续培养24 h。细胞对照组和空白对照组加入等体积生理盐水。加入10 μL CCK-8,继续孵育30 min,于450 nm波长处测定吸光度(A450nm)值。细胞存活率(%)=(实验组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。
1.6 彗星实验测定hPBL DNA损伤
调整细胞密度至1×108L-1,接种于96孔板,每孔100 μL,培养48 h,分别加入不同浓度PM2.5溶液(终浓度为10,20,40,80和160 mg·L-1)处理淋巴细胞24 h;或预先加入DOWE(终浓度为25,50,100,200和400 mg·L-1)预处理淋巴细胞1 h,再加入PM2.5溶液(终浓度40 mg·L-1)继续培养24 h。细胞对照组加入等体积生理盐水。用彗星实验测定DNA损伤[14-15],用CASP 软件分析DNA损伤指标Olive尾矩。Olive尾矩为尾部DNA占总DNA百分比与尾长(μm)的乘积。
1.7 ELISA法测定hPBL分泌IL-1 β,IL-2和TNF- α水平
将1×109L-1单细胞悬液1 mL接种于48孔培养板中培养48 h,加入不同浓度DOWE(终浓度为25,50,100,200和400 mg·L-1)预孵育1 h,细胞对照组加入等体积生理盐水,随后加入PM2.5溶液(终浓度40 mg·L-1),24 h后收集各组培养上清液,按照ELISA试剂盒说明书检测IL-1β,IL-2和TNF-α浓度。
1.8 统计学分析
实验结果数据x±s标示,采用SPSS软件进行统计学分析,组间差异性比较采用单因素方差分析,实验组与对照组间比较用t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 PM2.5对hPBL存活和DNA损伤的影响
如图1A所示,PM2.510,20和40 mg·L-1作用24 h,hPBL存活率与细胞对照组相比无明显差异;PM2.580和160 mg·L-1时,细胞存活率降低至约70%(P<0.05)。彗星实验结果(图1B)所示,与细胞对照组相比,H2O2阳性对照组和PM2.510,20,40,80和160 mg·L-1组hPBL Olive尾矩明显增加(P<0.05,P<0.01),且呈浓度-效应关系(r=0.92,P<0.01),表明 PM2.510~160 mg·L-1可导致 hPBL DNA损伤。为了保证实验中有足够数目的存活细胞且可导致DNA损伤,后续实验选择PM2.540 mg·L-1作用24 h作为DNA损伤实验的造模条件。
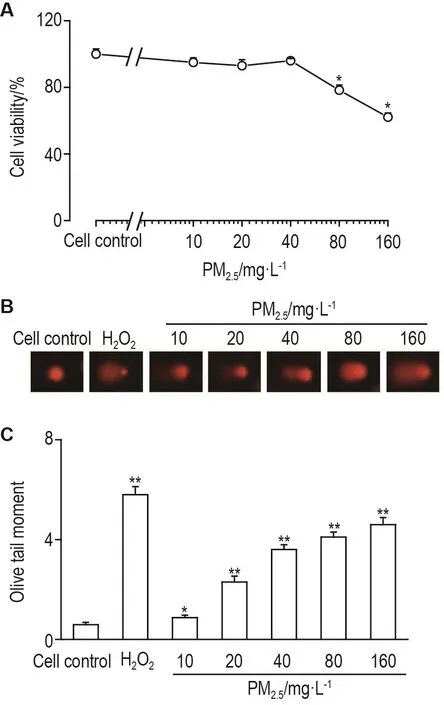
Fig.1 Effect of PM2.5on viability(A)and DNA damage(B,C)of human peripheral blood lymphocytes(hPBLs).
2.2 DOWE对hPBL存活的影响
如图 2A 所示,DOWE 25,50,100,200和400 mg·L-1组细胞存活率均>90%,与细胞对照组相比无统计学差异。如图2B所示,与细胞对照组比较,PM2.540 mg·L-1组细胞存活率无明显差异;与PM2.540 mg·L-1组比较,DOWE 25,50,100,200和400 mg·L-1组细胞存活率亦无明显差异。表明DOWE在该浓度范围内对细胞存活无明显影响。
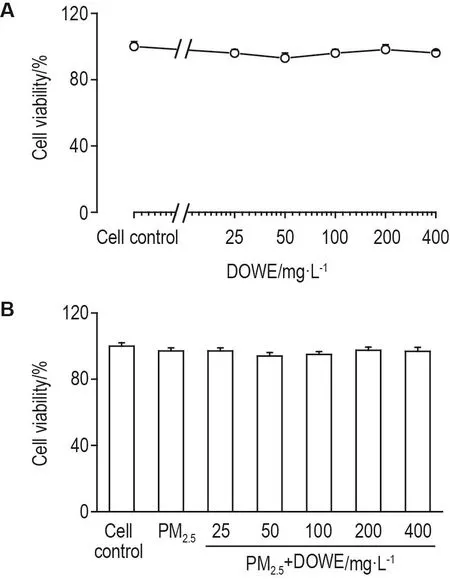
Fig.2 Effect of Dendrobium officinale water extract(DOWE)on viability of hPBLs assayed with CCK-8 assay.A:hPBLs were incubated with DOWE for 24 h;B:hPBLs were incubated with DOWE for 1 h and further incubated with PM2.540 mg·L-1for 24 h.±s,n=3.
2.3 DOWE对PM2.5所致hPBL DNA损伤的影响
如图3所示,与细胞对照组比较,PM2.540 mg·L-1组细胞Olive尾矩明显增加(P<0.01);与 PM2.540 mg·L-1组比较,DOWE 25 mg·L-1组细胞Olive尾矩无明显变化,DOWE 50,100,200和400 mg·L-1组细胞Olive尾矩均明显降低(P<0.05),且呈浓度-效应关系(r=0.83,P<0.01),表明DOWE对PM2.5所致hPBL DNA损伤具有一定的保护作用。
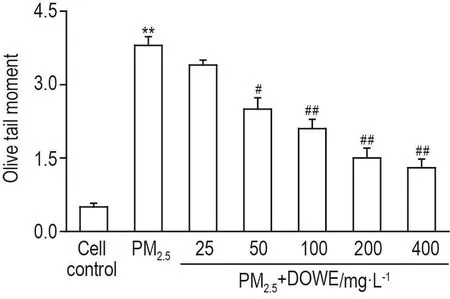
Fig.3 Effect of DOWE on PM2.5-induced DNA damage of hPBLs.hPBLs were incubated with DOWE for 1 h and further incubated with PM2.540 mg·L-1for 24 h.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with PM2.5group.
2.4 DOWE对PM2.5所致hPBL分泌IL-1 β,IL-2和TNF- α水平的影响
如图4所示,与细胞对照组比较,PM2.540 mg·L-1组IL-1β,IL-2和TNF-α分别水平明显升高(P<0.01);与PM2.5组相比,DOWE 25,50,100,200和400 mg·L-1可明显抑制IL-1β,IL-2和TNF-α分泌(P<0.05,P<0.01),对 IL-1β 的抑制 率分别为22.8%,34.2%,45.6%,55.7%和64.6%;对IL-2的抑制率分别为25.0%,36.8%,47.1%,60.3%和69.1%;对TNF-α抑制率分别为17.2%,24.6%,36.1%,59.8%和68.0%。
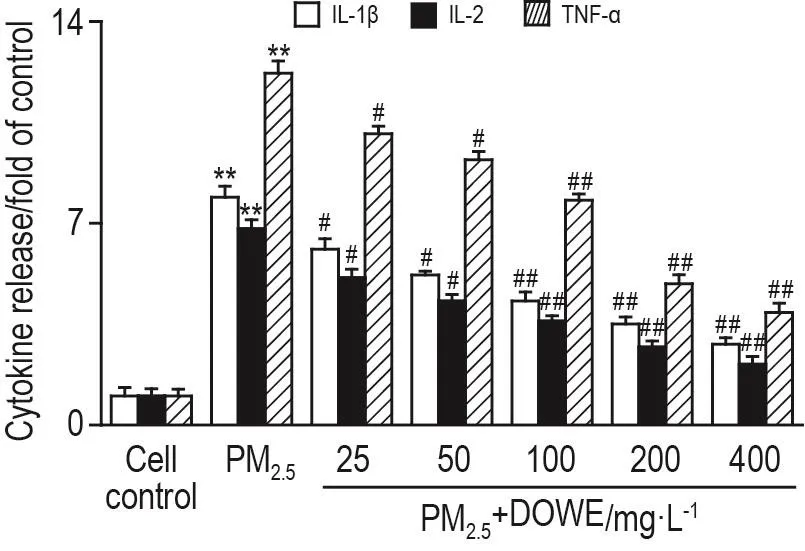
Fig.4 Inhibitory effect of DOWE on PM2.5-induced interleukins-1 β(IL-1 β),IL-2 and tumour necrosis factor- α (TNF- α) production of hPBLs examined by ELISA.See Fig.3 for the cell treatment.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with PM2.5group.
3 讨论
近年来,随着现代工业的发展,大气颗粒物污染频繁发生,尤其是PM2.5对人类健康造成的危害日益严重,引起广泛关注。PM2.5成分复杂,含有重金属和多环芳烃等多种有害物质,PM2.5对细胞DNA的损伤作用也可能与其上附着的重金属和多环芳烃等有害物质有关,这些有害物质经人体代谢后,其代谢产物可与DNA形成共价加合物,并且在此过程中会形成大量活性氧,造成DNA的氧化损伤[16-17]。
本研究结果表明,PM2.510,20和40 mg·L-1对hPBL存活无明显影响,80和160 mg·L-1使hPBL存活率降低至约70%。因此,选取PM2.540 mg·L-1作为后续实验的浓度。彗星实验结果所示,与细胞对照组相比,H2O2阳性对照组和PM2.510,20,40,80和160 mg·L-1组hPBL Olive尾矩明显增加,且呈浓度-效应关系(r=0.92,P<0.01),表明PM2.510~160 mg·L-1可导致hPBL DNA损伤。由此推测,在日常的大气PM2.5暴露下,PM2.5的浓度升高可能导致人体DNA损伤。DOWE 50,100,200和400 mg·L-1对hPBL存活率无明显影响,但可逆转PM2.540 mg·L-1导致的hPBLOlive尾矩增加,且呈浓度-效应关系,提示DOWE对PM2.5所致hPBLDNA损伤具有一定的保护作用。上述结果亦提示,可将Olive尾矩作为PM2.5对人体DNA损伤的评价指标。
国内外空气PM2.5的流行病学研究表明,PM2.5浓度增加与人体免疫功能异常、呼吸系统疾病和心血管疾病等密切相关[12-13],并且主要作用机制中均有炎症因子的参与。IL-1具有广泛的生物学作用,参与宿主的感染和损伤应答,是机体调节免疫与炎症反应的重要介质。IL-2的转录和合成被视为T细胞活化的标志,反映细胞免疫功能。TNF-α是一种重要的炎症介质,在启动和维持炎症反应中起着非常重要的作用。已有的动物实验研究表明,小鼠经气管滴注不同来源的PM2.5后,其肺组织和血液中IL-1和IL-6表达增加[18]。Tablin等[19]研究报道,小鼠连续暴露于环境PM2.52周后,可引起血清中IL-2和TNF-α表达升高。据报道,PM2.5可引起TNF-α和(或)TNF-α mRNA表达水平的增加[20-22]。Sakai等[23]在动物实验研究中,使小鼠暴露于柴油机废气后,发现暴露组小鼠TNF-α的表达增加。本研究结果发现,PM2.5刺激后,hPBL分泌 IL-1β,IL-2和TNF-α明显增加,DOWE可抑制hPBL IL-1β,IL-2和TNF-α的分泌。提示PM2.5可诱导暴露人群产生明显的炎症反应,DOWE可对该炎症反应有一定的抑制作用。
综上所述,PM2.5可以引起hPBL DNA损伤和炎症反应,DOWE对PM2.5所致hPBL DNA损伤具有一定的保护作用,且可抑制PM2.5诱导的hPBL炎症反应,但其可能的作用机制还待继续研究。本研究结果提示,使用铁皮石斛等有可能缓解雾霾导致的DNA损伤和炎症反应,为使用中药防治雾霾导致的人体损伤提供了实验依据。

