麦角甾醇与顺铂联合用药协同抑制人肺癌A549细胞增殖
吴梅佳,黄 挺,米完完,应园园,王航利,张梦迪,黄绳武
(1.浙江中医药大学药学院,浙江杭州 311402;2.杭州红十字会医院普外科,浙江杭州 310003)
肺癌是世界上发病率最多和死亡率最高的恶性肿瘤之一,在我国发病率和死亡率也占据首位,其中最常见的类型是非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。由于肺癌早期诊断过于困难,大多数患者就诊时已到达中晚期。单纯手术切除的效果有限,目前放化疗、靶向治疗和免疫治疗是中晚期患者的主要治疗方式。
铂类药物因其广泛的抗癌谱和较强的抗肿瘤活性,一直是临床上治疗肺癌的重要药物之一。在目前化疗方案中,大部分需要用到铂类药物。除顺铂(cisplatin)以外,先后有卡铂、奈达铂和奥沙利铂等铂类药物在多个国家上市。但铂类药物的耐药性、无靶向性和不良反应等大大地限制了其临床应用[2]。
近年来,麦角甾醇(ergosterol,ERG)抗癌作用的相关内容陆续有报道。Yasukawa等[3]发现,ERG(从真姬菇中分离出的单体)对小鼠皮肤癌有很好的治疗作用。近期,有研究筛选了13个对11种细胞系有抗癌活性的药用菌,发现皱盖假芝提取物对癌症的抑制效果最好。对皱盖假芝提取物分离纯化,发现其中的单体ERG能诱导乳腺癌细胞凋亡[4]。Lin等[5]发现,ERG与两性霉素B联合治疗,能够有效地诱导人肝癌细胞坏死。ERG的抗肺癌作用迄今尚未见报道。
目前许多研究表明,癌细胞产生耐药与诱导聚ADP-核糖聚合酶1(poly ADP-ribose polymerase-1,PARP-1)的表达变化密切相关。有文献报道,ERG过氧化物在体外能够抑制PARP-1的活性[6]。因此推测,ERG可能具有增强顺铂对肺癌细胞A549化疗敏感性的功能。本研究通过体外培养的肺癌A549细胞,采用MTT、划痕实验、Hoechst33258染色、流式细胞术和Western蛋白质印迹等实验检测活化胱天蛋白酶3和活化PARP-1蛋白表达,探讨ERG在体外是否增加顺铂对A549细胞的敏感性,从而具有协同抗肺癌的作用。
1 材料与方法
1.1 细胞和试剂
人NSCLC细胞A549购自中国科学院上海生命科学研究院;RPMI 1640培养基(美国Gibco公司,1676918);胎牛血清(fetal bovine serum,FBS,美国Gibco公司,1616966);胰酶(吉诺生物医药技术有限公司,15061103);噻唑蓝(MTT)试剂(美国Biosharp公司,B0016K012500);二甲亚砜(DMSO)(美国Gibco公司,WXBB3106V);磷酸盐缓冲液(PBS)(吉诺生物医药技术有限公司,20150420);BCA蛋白浓度测定试剂盒(增强型)、Hoechst33258凋亡染色试剂盒和细胞周期与细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);Annexin V-PI流式凋亡试剂盒(美国BD公司,4293719);兔抗鼠β肌动蛋白多克隆抗体,兔抗鼠活化胱天蛋白酶3多克隆抗体和兔抗鼠活化PARP-1多克隆抗体(美国ImmunoWay Biotechnology公司);山羊抗兔IgG二抗(美国Rockland公司,C41217-04);0.22 μm PVDF膜(美国Biosharp公司);ERG对照品(含量95.5%,111845-201403),顺铂(中国食品药品检定研究院,含量99.8%,100401-201302)。
1.2 仪器
BCM-1000A生物洁净工作台(苏州安泰空气技术有限公司);IX71荧光倒置显微镜和CX31光学显微镜(日本奥林巴斯公司);AG 22331离心机(德国Eppendorf公司);TU-100恒温金属浴(上海一恒科技有限公司);Odyssey红外激光双色成像系统(美国LI-COR公司);TS-1水平摇床(海门市其林贝尔仪器制造有限公司);BS124S电子分析天平〔赛多利斯科学仪器(北京)有限公司〕;MS 3 digital涡旋混合器(德国IKA公司);DK-450B电热恒温水槽(上海森信实验仪器有限公司);层析冷柜(德国Thermo公司);VCX500超声波破碎仪(美国SONICS公司);TC20细胞计数器(美国Bio-Rad公司);MLS-3750高压灭菌锅和MDF-U53V超低温冰箱(日本Sanyo公司);MK3酶标仪(德国Thermo公司)。
1.3 MTT法检测细胞存活
对数生长期的A549细胞,以5×107L-1密度接种于96孔板中,每孔100 μL,于37℃、5%CO2培养箱中培养至细胞融合达80%去上清,加入ERG 15.75,31.5,63,126和252 μmol·L-1,顺铂16.75,33.5,67,134 和 268 μmol· L-1,ERG 15.75~252 μmol·L-1+顺铂 33.5 μmol·L-1各 100 μL,细胞对照组加入100 μL培养液。每个浓度设5个复孔,分别于加药后12,24,48和72 h后进行MTT检测。每孔加入20 μL MTT溶液(5 g·L-1),37℃孵育4 h后,弃上清,每孔加入150 μL DMSO振荡15 min,采用酶标仪于492 nm处测定各孔吸光度(A492nm)值并计算抑制率。抑制率(%)=(1-A实验组/A对照组)×100%。采用SPSS软件计算不同时间点下各个药物的半数抑制率IC50值。采用q值判断ERG和顺铂联用的性质。q=EAB/(EA+EB-EA×EB),式中EA和EB为各药单用抑制率,EAB为两药合用抑制率。q>1.15为协同作用,0.85~1.15为相加作用,<0.85为拮抗作用。
1.4 划痕实验检测细胞侵袭迁移能力
选取作用24 h时间点下的ERG、顺铂和两药联用组浓度,细胞分为4组:细胞对照组、ERG 31.5 μmol·L-1组、顺铂 33.5 μmol·L-1组和 ERG 31.5 μmol·L-1+顺铂 33.5 μmol·L-1组。取对数生长期A549细胞,以1.5×108L-1的细胞密度接种于6孔板中,每孔2 mL,于37℃,5%CO2培养箱中培养至细胞融合达80%。待细胞铺满,用PBS洗细胞3次。各组给药以后,显微镜下拍照,记录0 h时刻痕迹。放入37℃,5%CO2的培养箱中培养24 h,显微镜下拍照,记录24 h时刻痕迹,计算划痕宽度缩短率。划痕宽度缩短率(%)=(1-24 h宽度/0 h宽度)×100%。
1.5 Hoechst33258染色检测细胞凋亡
药物分组同1.4项所述。24 h后PBS清洗2次,加入4%多聚甲醛室温固定20 min,吸出甲醛,PBS清洗3次,加入Hoechst33258染液,37℃染色30 min,滴入抗荧光淬灭剂后封片,于荧光显微镜下观察细胞核形态。
1.6 流式细胞仪检测细胞凋亡和细胞周期
1.6.1 细胞凋亡率测定
药物分组同1.4项所述。24 h后收集上清及细胞,100×g离心5 min后弃去上清,预冷的PBS洗涤3次后用100 μL 1×流式缓冲液重悬,采用AnnexinⅤ-PI双染流式细胞术检测各组凋亡情况。每个给药孔加入5 μL FITC与5 μL PI荧光染料,于室温下黑暗处孵育15 min,每孔加入400 μL 1×缓冲液,用涡旋混合器低转速下混合均匀,在1 h内采用流式细胞仪检测细胞凋亡率。
1.6.2 细胞周期测定
药物分组同1.4项所述。药物作用24 h后,收集上清及细胞,200×g离心10 min,PBS洗涤1次后,用75%乙醇固定过夜,离心弃掉乙醇,用PBS洗涤2次,将细胞重悬于300 μL PBS中,加入PI,室温避光染色30 min,置流式细胞仪上测定各周期细胞比例。
1.7 Western蛋白质印迹法检测活化的胱天蛋白酶3和PARP-1蛋白表达
药物分组同1.4项所述。24 h后收集上清及细胞,提取细胞总蛋白。用BCA法测定总蛋白浓度,调整各个样品的上样量一致,将蛋白质样品与2×上样缓冲液以体积比1∶1混合后于100℃金属浴中煮沸5 min,加入相应浓度的SDS-PAGE胶,电泳至溴酚蓝距离胶底部1 cm处即停止电泳,然后电转移至0.22 μm的PVDF膜上,5%BSA封闭1 h,稍洗后分别加入适量活化胱天蛋白酶3(1∶500)、活化PARP-1(1∶1000)和β肌动蛋白(1∶2000)一抗于4℃下孵育过夜,TBST漂洗3次,每次5 min,加入对应来源的荧光二抗,常温孵育1 h,TBST洗膜3次,每次5 min,采用Odyssey红外荧光扫描成像系统扫膜并定量分析条带的积分吸光值。以目标蛋白和内参蛋白的积分吸光度的比值表示蛋白相对表达水平。
1.8 统计学分析
实验结果数据用x±s表示,实验重复3次。采用SPSS 17.0软件进行统计学处理,采用单因素方差分析法,两组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 ERG与顺铂联合用药对A549细胞的抑制作用
ERG 15.75~252 μmol·L-1和顺铂 16.75~268 μmol·L-1均能抑制A549细胞的生长且呈浓度依赖性。在不同药物作用时间点下,ERG 15.75~252 μmol·L-1+顺铂 33.5 μmol·L-1各组对 A549 细胞的抑制率相较于ERG 15.75~252 μmol·L-1及顺铂(33.5 μmol·L-1)单用组均有显著提高(P<0.05,P<0.01),表明ERG与顺铂联用明显增强了顺铂对A549的敏感性(表1和表2)。顺铂单用组IC50值在24 h时为35.68 μmol·L-1,考虑到ERG作为一个中药单体,与顺铂联用的目的在于增效减毒,以期降低顺铂用量的同时,并不降低其药效甚至达到更好的药效。因此,用于后续实验的两药联用组中顺铂的浓度确定为 33.5 μmol·L-1。ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1组在12,24,48和72 h,q值分别为1.04,1.16,1.05和0.97。表明ERG 31.5 μmol·L-1+顺铂33.5μmol·L-1组在作用时间为24h时,具有协同作用。
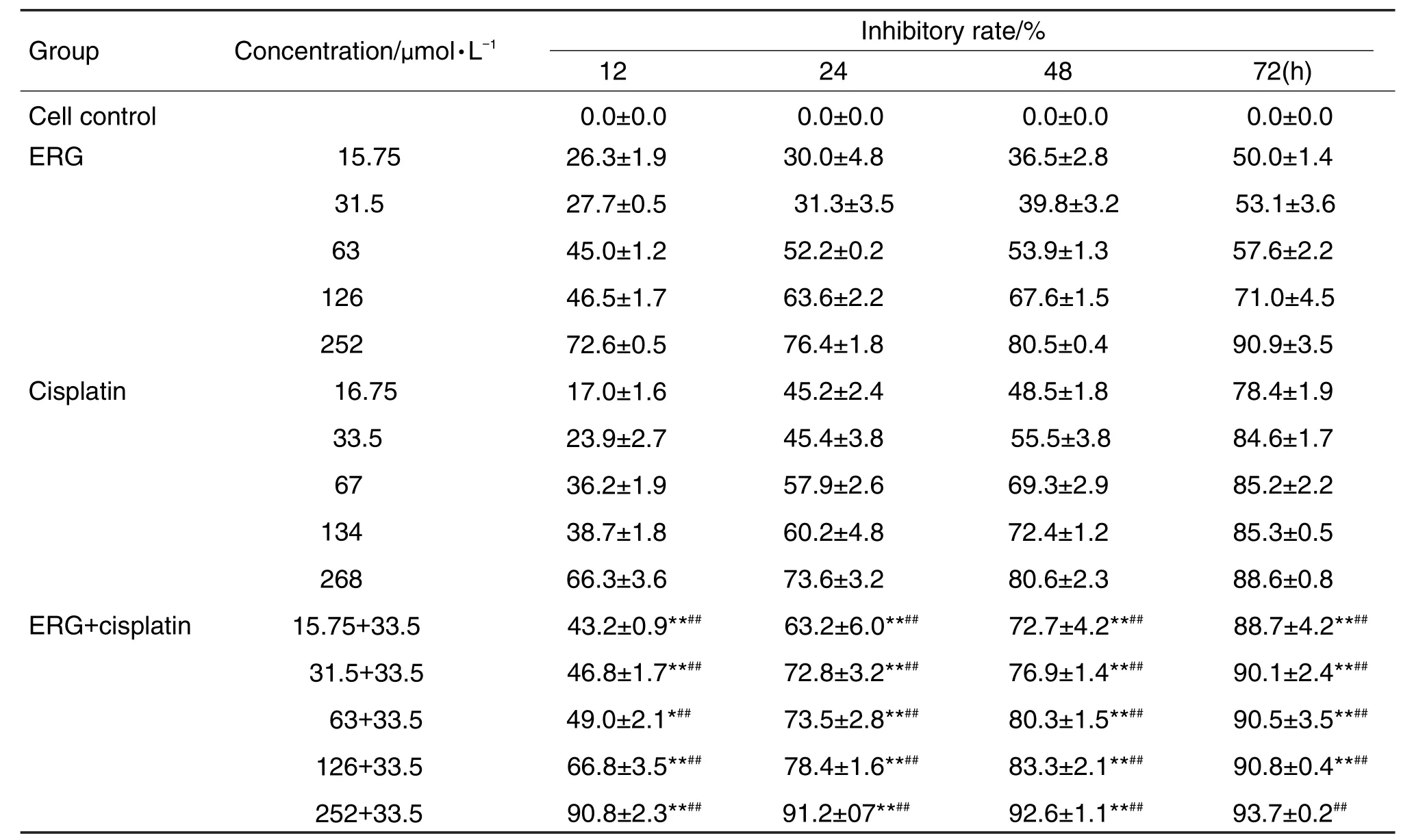
Tab.1 Effect of ergosterol(ERG)combined with cisplatin on A549 cell viability
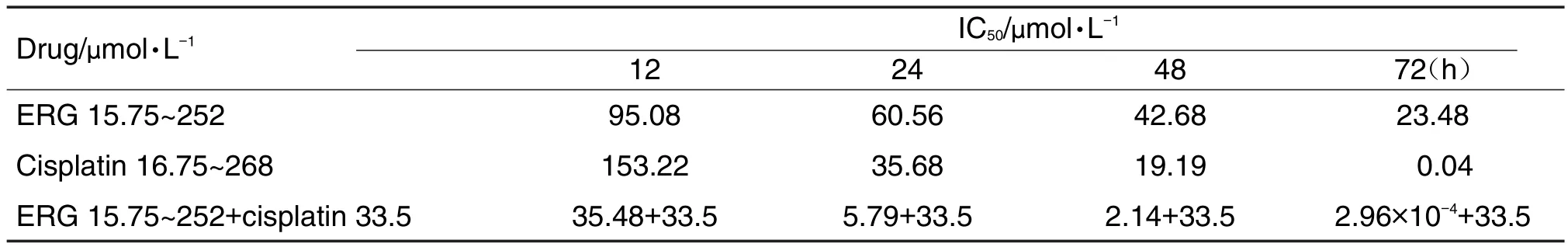
Tab.2 Effect of ERG combined with cisplatin on IC50at different time points
2.2 ERG与顺铂联合用药对A549细胞侵袭迁移能力的影响
划痕实验结果显示(图1),细胞划痕24 h后,各组划痕宽度缩短率分别为(23±3)%,(20±5)%,(5±4)%和(41±6)%。与细胞对照组相比,ERG 31.5 μmol·L-1组和顺铂 33.5 μmol·L-1组的划痕直径缩短率明显减小(P<0.01),ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1组的划痕直径缩短率最小,细胞基本无迁移现象。表明两药联用相较于药物单用组,能极显著减弱A549细胞的侵袭迁移能力。

Fig.1 Effect of ERG combined with cisplatin on migra⁃tion ability of A549 cells by inverted microscope.The cells were treated with drugs for 24 h.↔:the width of scratching boundary.
2.3 ERG与顺铂联合用药对A549细胞凋亡和细胞周期的影响
2.3.1 Hoechst33258染色结果
Hoechst33258染色结果见图2,在荧光显微镜下观察,细胞对照组的细胞发出较弱的蓝色荧光,细胞核大小较均一,染色质分布均一,无明显的形态学改变;而实验组凋亡细胞形态学明显改变,出现核浓染、碎裂,形状不规则,大小不一,发出亮蓝色荧光(图中白色箭头指向处)。ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1组出现凋亡样的细胞数量明显多于二者单用组,表明两药联用能有效诱导A549细胞凋亡。
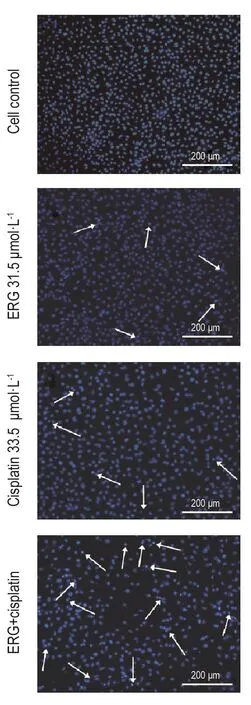
Fig.2 Effect of ERG combined with cisplatin on A549 cell apoptosis by inverted microscope.See Fig.1 for the treatment.Arrows show the apoptotic cells.
2.3.2 流式仪检测结果
细胞凋亡情况结果如表3和图3所示,单用顺铂组的细胞凋亡率在各个浓度下均要高于单用ERG组,而两药联用组的凋亡率均显著高于相同浓度下单用药组(P<0.01),且ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1组细胞凋亡率最高,表明ERG和顺铂联用能促进A549细胞凋亡。
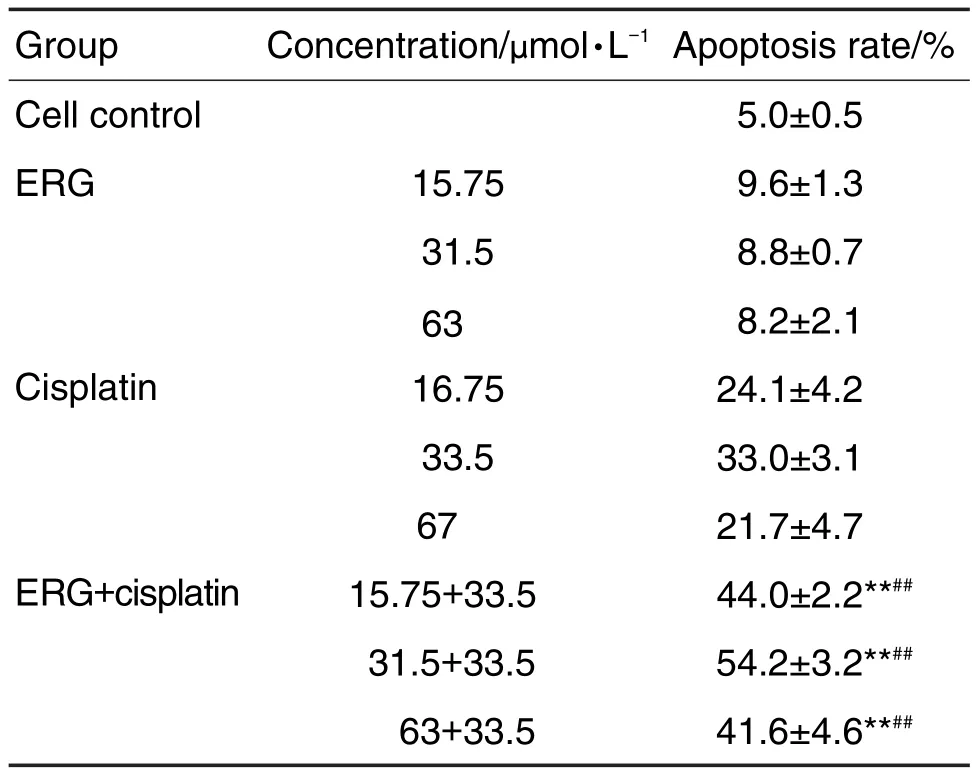
Tab.3 Effect of ERG combined with cisplatin on A549 cell apoptosis by flow cytometry
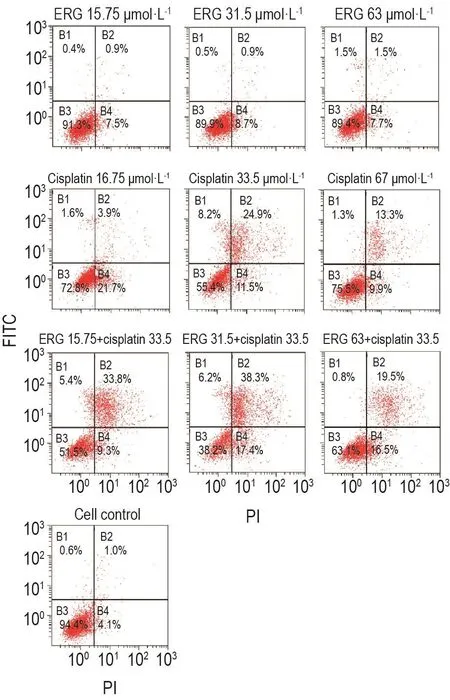
Fig.3 Effect of ERG combined with cisplatin on A549 cell apoptosis by flow cytometry after 24 h treatment.
2.3.3 ERG与顺铂联合用药对A549细胞周期的影响
图4结果表明,当ERG浓度为31.5 μmol·L-1时,对A549细胞周期产生明显的G0/G1期阻滞,G0/G1期比例为(85.3±2.0)%,与细胞对照组(70.4±2.0)%相比明显升高(P<0.01)。而顺铂33.5 μmol·L-1可阻滞A549细胞周期于S期,比例为(41.5±2.5)%,与细胞对照组(12.7±0.9)%相比明显升高(P<0.01)。两药联用时,A549细胞G2/M期比例增加为(20.0±1.5)%,与细胞对照组(15.8±1.3)%相比明显升高(P<0.05),表明两药联用可能通过将A549细胞阻滞在G2/M期来抑制其增殖。
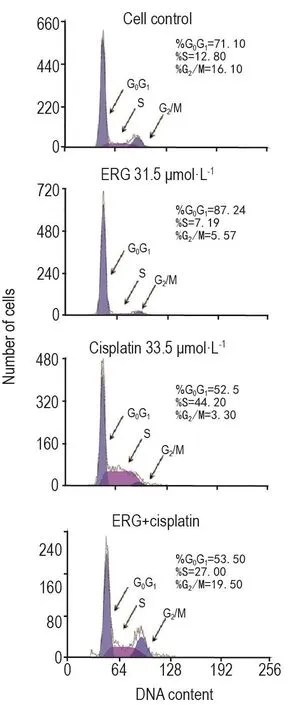
Fig.4 Effect of ERG combined with cisplatin on A549 cell cycle by flow cytometry.See Tab.3 for the treatment.
2.4 ERG与顺铂联合用药对A549细胞内凋亡相关蛋白的影响
实验得到蛋白标准曲线为Y=0.0043X+0.0663,R2=0.9999,线性范围为2.273~45.455 mg·L-1。Western蛋白质印迹结果如图5所示,与细胞对照组相比,ERG 31.5 μmol·L-1能够显著上调 A549 细胞胞浆活化胱天蛋白酶3蛋白的表达(P<0.05),而顺铂 33.5 μmol·L-1及 ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1均能够极显著上调活化胱天蛋白酶3蛋白的表达(P<0.01);与单独用药组相比,二者联合给药后活化胱天蛋白酶3蛋白的表达与单一用药组相比显著上调(P<0.01)。活化PARP-1蛋白的表达结果中,与细胞对照组相比可知,ERG 31.5 μmol·L-1不能引起A549细胞凋亡相关蛋白活化PARP-1蛋白表达的增加,而顺铂33.5 μmol·L-1及 ERG 31.5 μmol·L-1+顺铂 33.5 μmol·L-1均能增加活化 PARP-1蛋白的表达(P<0.01);与顺铂33.5 μmol·L-1组相比,ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1组给药后活化PARP-1蛋白的表达显著上调(P<0.01)。ERG 31.5 μmol·L-1+顺铂33.5 μmol·L-1组执行凋亡的活化胱天蛋白酶3和活化PARP-1蛋白明显增多,表明两药联用能显著诱导细胞的凋亡。
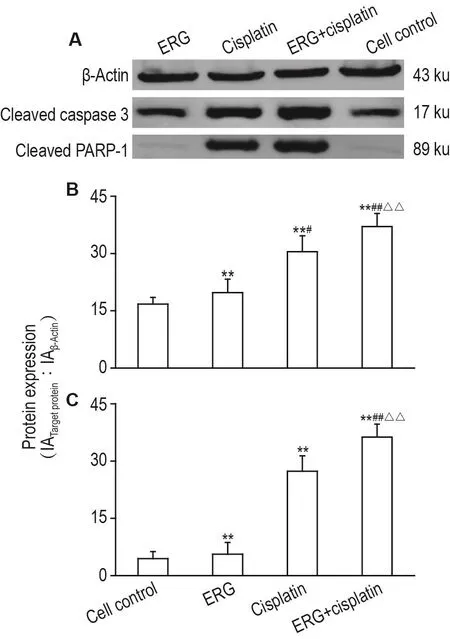
Fig.5 Effect of ERG combined with cisplatin on protein expression of cleaved caspase 3(A,B)and cleaved poly ADP-ribose polymerase-1(PARP-1)(A,C)in A549 cells by Western blotting.See Fig.1 for the cell treatment.B and C were the semi-quantitative result of A,respectively.±s,n=6. **P<0.01,compared with cell control group;##P<0.01,compared with ERG 31.5 μmol·L-1group;△△P<0.01,compared with cisplatin 33.5 μmol·L-1group.
3 讨论
本研究结果表明,ERG的浓度在15.75~252 μmol·L-1,顺铂的浓度在16.75~268 μmol·L-1,ERG(15.75~33.5)μmol·L-1+顺铂33.5 μmol·L-1,对A549细胞有一定的增殖抑制作用,且呈较好的量效关系。ERG 31.5 μmol·L-1和顺铂 33.5 μmol·L-1联合给药具有协同作用。采用流式细胞仪检测发现,ERG与顺铂联用的凋亡率明显高于ERG和顺铂单用。且随着药物浓度的增加,细胞早期凋亡率呈现增加的趋势。由于许多中药成分会通过影响细胞周期来发挥抗癌作用[7-8],本研究着重考察了ERG对A549细胞周期的影响。ERG 31.5 μmol·L-1能引起A549细胞G0/G1期的细胞增多和S期细胞的减少,顺铂 33.5 μmol·L-1单用能引起A549细胞G0/G1期的细胞减少和S期细胞的增多,ERG 31.5 μmol·L-1和顺铂 33.5 μmol·L-1联合给药能引起A549细胞G0/G1期、S期细胞减少和G2/M期细胞的增多,表明两药联用可能通过导致细胞G2/M期阻滞抑制其增殖,从而抑制肺癌的发生和发展。
已有研究报道,PARP-1作为第一个被发现的细胞凋亡蛋白酶亚基,其参与的细胞死亡是通过从线粒体中释放凋亡蛋白或消耗细胞质中NAD+来实现的[9]。凋亡蛋白胱天蛋白酶7和胱天蛋白酶3在胱天蛋白酶断裂位点(DEVD)将PARP-1切割成分子量为89和27 ku的2个片段[10]。PARP-1断裂后,PARP-1不仅失去了催化活性[11],而且使细胞内能量不被耗尽,继而保证细胞凋亡过程中的能量供应[12]。本研究发现,ERG与顺铂联合用药能上调活化胱天蛋白酶3,活化PARP-1的表达也随之增多,导致活化胱天蛋白酶3下游的PARP-1由于酶切作用而活性被抑制,可以推断PARP-1的抑制可能是胱天蛋白酶信号通路中的一个普遍的机制。关于胱天蛋白酶介导的PARP-1活性抑制的作用,则是为了抑制后者对DNA片段化水解的顺利进行以及凋亡过程中的能量供给[13]。完整的胱天蛋白酶信号通路凋亡机制需要进一步深入研究。ERG与顺铂联用在其他肺癌细胞系上的增殖抑制作用研究,尚需进一步深入探讨。
综上所述,降低顺铂的用量,与ERG联用可显著抑制肺癌A549细胞增殖及迁移,进而诱导细胞凋亡。从肿瘤化疗角度看,药物联用对于降低抗肿瘤药物毒性具有重要的临床意义,这一结果为指导临床用药提供了一定的参考。

