吡非尼酮对舰船烟雾所致吸入性肺损伤大鼠的防护作用
段欣欣,王成彬,2,韩志海,吕建新
(1.温州医科大学检验医学院和生命科学学院,浙江温州 325000;2.解放军总医院检验科,北京 100853;3.海军总医院呼吸与危重症医学科,北京 100048)
舰船火灾是作战时经常遇到的情况,舰船内部非金属材料在燃烧时释放出大量的有毒气体、粉尘及颗粒物质,船员极易因暴露于此环境而引起肺组织和呼吸道的吸入性损伤。吸入性损伤发病隐匿,病情危重,具有热力损伤和化学物质损害的特点[1-2],若未及时治疗,可迅速发展为呼吸衰竭,危及生命。近年来,海军舰船大量新型复合材料的应用增加了烟雾成分的复杂性,主要包括CO,CO2,H2S和NOx等有害气体,有时甚至含氯化氢、氯化氰、氰化氢等高毒性气体,对人体的危害比单一的有毒气体毒性要大得多,严重者可迅速致人死亡[3]。舰船火灾有害烟气生成速度快、种类多、成分复杂、危害大,污染舰船室内大气环境,严重伤害船员身体健康[4],已成为国内外研究热点之一。
当人体吸入有毒气体、热力物质或刺激性颗粒后,会引起上呼吸道、气管支气管以及肺实质损伤[5],使单核巨噬细胞及中性粒细胞等活化和聚集,释放氧自由基及多种炎症性细胞因子等,同时肺组织血管内皮细胞和中性粒细胞发生黏附导致肺组织内微血管阻塞,局部组织缺氧缺血加重,血管内皮通透性增加,使肺组织水肿进一步加速,加重肺部炎症反应[6-7]。目前对烟雾吸入性损伤的药物治疗主要有皮质激素类、肺表面活性物质类和表皮生长因子[8]。皮质激素的大量使用带来的不良反应大,可致机体免疫力下降,产生药物依赖和激素抵抗等一系列不良反应,肺表面活性物质类制剂的主要来源是动物肺组织,制备困难,来源少[9],且在用药剂量和给药时机等方面还需要进一步的研究。表皮生长因子的最佳给药时机和给药途径等问题也仍在研究中[10],故目前尚缺乏安全有效的早期干预和延缓疾病进展的手段。
吡非尼酮(pirfenidone,PFD)是一种近年来上市的新型小分子药物,临床可用于轻度特发性肺纤维化的早期治疗[11],同时该药还在肾脏疾病(局灶性节段性肾小球硬化症)、肥厚性心肌病、类风湿性关节炎和恶性肿瘤等方面有广泛研究[12]。有研究表明,PFD可抑制多种细胞因子的产生,如白细胞介素6(interleukin-6,IL-6),IL-17和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等[13],具有抗炎和抗氧化作用[14]。PFD抑制大鼠肺组织中NF-κB和丝裂原活化的蛋白激酶信号通路相关因子发挥保护作用的药物机制已成为国内外学者研究的热点[15-16]。同时韩枫等[17]的研究结果表明,PFD对百草枯所致急性肺损伤大鼠具有一定的保护作用,但目前还尚未有PFD对舰船烟雾所致大鼠吸入性肺损伤保护作用的研究。本研究采用自制烟雾吸入性损伤装置,在大鼠正常活动状态下,进行自主烟雾的吸入,排除麻醉及其他影响,采用舰船内部7种非金属材料并按一定比例配制,气体检测仪实时监测装置内部各种气体成分变化,模拟舰船燃烧环境,构建舰船烟雾致肺损伤大鼠模型。同时使用PFD进行干预,初步探讨PFD对舰船烟雾所致急性肺损伤的防护作用。
1 材料与方法
1.1 实验动物、药品、试剂和主要仪器
清洁级健康成年雄性Wistar大鼠54只,体质量160~200 g,由解放军总医院实验动物中心提供,合格证号SCXK(京)2016-0006。大鼠于动物中心清洁房中饲养,温度21~24℃,湿度50%~60%,昼夜12 h节律,自由进食、饮水。本实验通过解放军总医院伦理委员会审查,所有大鼠均在麻醉状态下处死。
PFD(纯度99%,湖北威德利化学科技有限公司);IL-6,IL-17和TNF-α ELISA检测试剂盒(上海江莱生物科技有限公司);丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程研究所)。
Cobasb血气分析仪(瑞士罗氏),1510酶标检测仪(美国Thermo Fisher公司),TopPette微量加样器(Dragonlab公司),BX53TR光学显微镜(Olympus公司),ST16R台式离心机(美国Thermo Fisher公司),88870006数字金属浴(美国Thermo Fisher公司),FA2004B精密电子天平(上海精密科学仪器有限公司)。
1.2 发烟材料
发烟材料(海军总医院馈赠),包含聚双马(Ⅲ型)泡沫材料:主要组分为双马来酰胺聚合物;NH/福乐斯发泡橡塑绝热制品:主要组分为橡胶和塑料复合体;EA-100阻燃白胶:主要组分为胶黏剂、无机填料;LZN-1高性能阻尼材料:主要组分为橡胶、硫化剂、胶黏剂等;JYJPJ85/SC舰船用低烟无卤电缆:主要组分为聚乙丙烯塑料;WQF-2硅丙乳胶漆:主要组分为硅丙乳胶;装饰板:主要组分为铝板、木板和胶黏剂。将7种舰船非金属材料按一定用量比,称量后剪成均匀小块,置于洁净的塑料袋中密封保存备用。
1.3 自制烟雾发生装置
自制烟雾吸入性损伤装置(图1)由发烟室和动物室两部分组成。两室中间有孔相通,发烟室内部安有风扇使烟雾均匀流通在整个装置。发烟室内径31 cm×40 cm×28 cm,内置遥控电磁加热器、发烟铁盘、鼓风扇。动物室内径31 cm×40 cm×28 cm,室壁的透视窗口用于观察动物烟熏后的状况,外部壁上安有烟雾检测仪监测装置内舰船烟雾的成分,包括O2,CO,CO2和H2S,遥控电磁炉开关、温湿度监控仪,用于实时监控发烟装置内的温度和湿度。

Fig.1 Smoke generator.A:Front view of the smoke generator;B:Overlooking of the smoke generator,consisting of a smoke room and an animal room(As the shown by the black arrow in the figure).There is a hole between two rooms,and smoke is kept inside the interior of the fan so that smoke is evenly circulated throughout the device.
1.4 舰船烟雾致吸入性肺损伤大鼠模型的制备
取配比称量处理好的舰船材料放入发烟室的铁盘上,置于遥控电磁炉加热器上,关闭发烟室门,打开动物室门,放入要致伤的大鼠后关闭,检查装置气密情况,打开发烟装置总电源开关、气体成分分析仪、气体采样泵及温湿度监测器开关,使用遥控装置打开电磁炉加热器开关并将其调至功率最大档位,1 min后可观察到发烟室内迅速充满烟雾,加热3 min后关闭电磁加热器。待达到暴露时间15 min后,打开动物室取出大鼠,置于空气中。
1.5 动物分组及处理
清洁级健康雄性Wistar大鼠54只,采用随机数字表法将大鼠分为3组,正常对照组、烟雾吸入损伤组和PFD 300 mg·kg-1(溶于5%二甲亚砜生理盐水)组,每组18只。由前期实验摸索可知,PFD剂量为500 mg·kg-1时,大鼠死亡率可达83%,剂量为200 mg·kg-1时,保护作用效果不明显,大鼠死亡率为67%,剂量为300 mg·kg-1时,大鼠未发生死亡,故以300 mg·kg-1为最终用药剂量。正常对照组和烟雾吸入损伤组ip给予2 mL 5%二甲亚砜。给药30 min后,烟雾吸入损伤组与PFD组分别放入自制发烟装置中,舰船烟雾吸入15 min后,取出置于通风环境中。每组分别于12,24和48 h各取6只腹主动脉取血。
1.6 动脉血气分析
各组暴露后12,24和48 h大鼠腹主动脉取血1 mL,于30 min内采用罗氏Cobasb血气分析仪进行动脉血气分析。
1.7 ELISA法检测血清中IL-6,IL-17和TNF- α的含量
各组暴露后12,24和48 h大鼠血液样本,1006×g离心15 min后取上清液。按说明书采用双抗体夹心法检测血清中的IL-6,IL-17及TNF-α的水平。
1.8 肺含水率和MDA含量的测定
腹主动脉取血后,处死大鼠,取右肺前叶,拭干表面血液后称湿重并记录,放入60℃烤箱烤72 h至恒重并记录干重。肺含水率(%)=(肺湿重-肺干重)/肺湿重×100%。
取右肺中叶组织100 mg,置于液氮中研磨,按1∶9比例加入生理盐水,制成10%的肺组织匀浆,取0.1 mL匀浆液,用BCA法定量匀浆中蛋白含量,然后按照试剂盒说明书进行MDA含量测定。
1.9 HE染色检测肺组织病理变化
取右肺下叶置于4%甲醛中浸泡固定24 h,石蜡包埋,4 μm连续切片,常规HE染色后光镜下观察。
1.10 统计学分析
实验结果计量资料以x±s表示,采用SPSS 17.0进行统计分析,多组间比较采用单因素方差分析(One-way ANOVA),组间比较采用最小显著法(LSD-t),P<0.05表示差异有统计学意义。
2 结果
2.1 PFD对大鼠动脉血气的影响
与正常对照组相比,烟雾吸入损伤组O2分压(partial pressure of oxygen,paO2)降低,CO2分压(arterial blood carbon dioxide partial pressure,paCO2)升高(P<0.05),说明舰船烟雾吸入对大鼠paO2和paCO2有一定的影响;与舰船烟雾吸入损伤组相比,PFD组paO2升高,paCO2降低(P<0.05),说明PFD能改善舰船烟雾吸入后大鼠的paO2与paCO2,PFD组与正常对照组相比,能恢复到正常对照组水平(表1)。
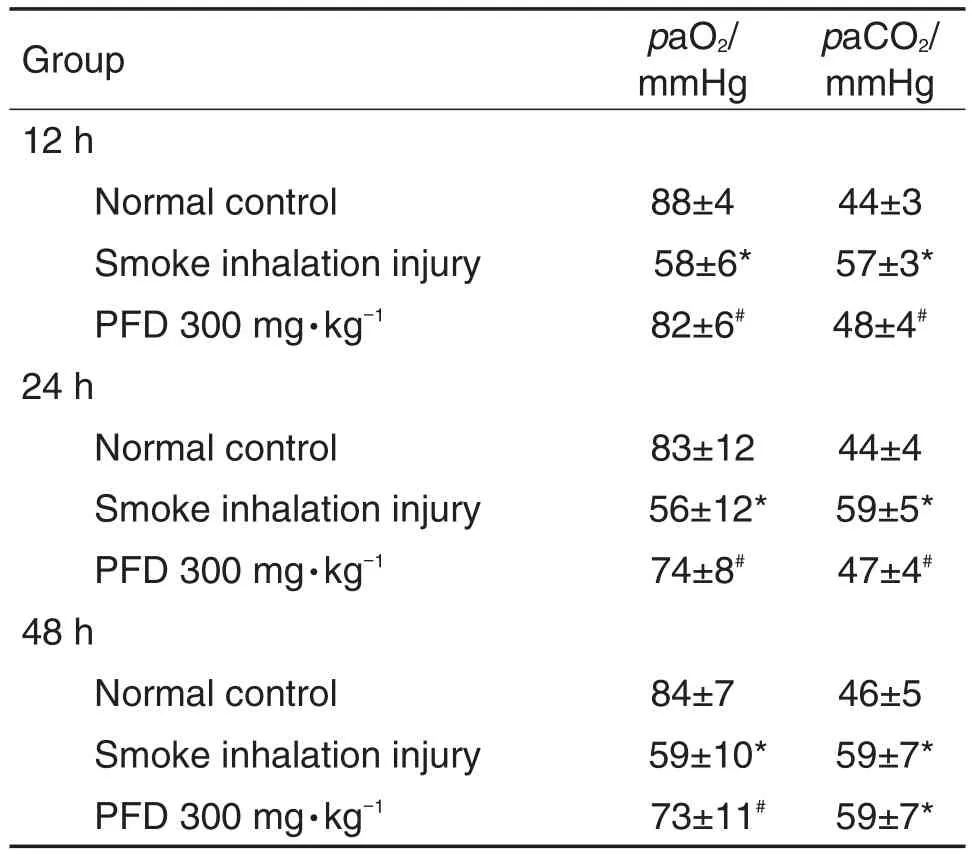
Tab.1 Effect of pirfenidone(PFD)on partial pressure of oxygen(paO2)and arterial blood carbon dioxide partial pressure(paCO2)in rats with smoke inhala⁃tion injury
2.2 PFD对大鼠血清IL-6,IL-17和TNF- α水平的影响
与正常对照组相比,烟雾吸入损伤组各时相点IL-6,IL-17及TNF-α含量均上升(P<0.05);与烟雾吸入损伤组相比,同时相点PFD组IL-6,IL-17及TNF-α含量均下降(P<0.05);说明PFD能降低炎症因子的表达。PFD组与正常对照组相比无明显的改变(表 2)。
2.3 PFD对大鼠肺组织含水率和MDA含量的影响
与正常对照组相比,烟雾吸入损伤组在烟雾吸入损伤暴露后,肺组织的含水率和MDA水平均明显升高(P<0.05);与烟雾吸入损伤组比,PFD组肺组织的含水率和MDA水平均则明显降低(P<0.05)(表3)。

Tab.2 Effect of PFD on serum interleukin-6(IL-6),IL-17 and tumor necrosis factor- α(TNF- α)levels in rats with smoke inhalation injury

Tab.3 Effect of PFD on water content of lung tissue and content of MDA in rats with smoke inhalation injury
2.4 PFD对大鼠肺组织大体观察及组织病理的影响
肺大体观察可见各时相点正常对照组大鼠两肺呈肉粉色,颜色均匀,未见肿胀、出血及坏死;烟雾吸入暴露处理后可见两肺明显充血水肿,肺表面早期有针尖样出血点,部分可见多处斑片状出血,气管内有白色泡沫状液体;PFD组大鼠各时相点肺部出血水肿较烟雾吸入损伤组减轻;烟雾吸入损伤组,12 h肺组织表面明显可见出血块,24和48 h肺组织表面为针尖样出血点(图2)。
光镜下观察可见各时相点正常对照组大鼠肺泡结构完整、清晰,肺泡壁薄、光滑,肺泡间隔均匀一致,间充质无充血或细胞浸润;烟雾吸入暴露处理后可见大鼠肺泡壁、肺泡间隔增厚及肺泡上皮组织增生,肺泡间隔可见炎症细胞浸润,肺泡扩张或萎陷,间隔增厚,间充质血管充血,微血栓形成,PFD组,肺泡间充质、肺泡壁和上皮组织炎症细胞浸润较烟雾吸入损伤组减轻,但仍有部分炎细胞浸润。烟雾吸入损伤组在12 h时炎症细胞浸润较多,24和48 h炎症细胞浸润逐渐减少。PFD组12 h仍有少许炎症细胞浸润,24和48 h肺泡中炎症细胞浸润减少,肺泡萎陷程度减轻(图3)。

Fig.2 Effect of PFD on general view of lung tissue of rats with smoke inhalation injury.See Tab.1 for rat treatment.The arrows show bleeding points.

Fig.3 Effect of PFD on lung histopathology of rats with smoke inhalation injury(HE staining).See Tab.1 for rat treatment.Arrows show inflammatory cell infiltration.
3 讨论
本研究动脉血气分析显示,大鼠在烟雾吸入处理后出现低氧血症,paO2降低,paCO2升高,PFD可升高各时间点烟雾吸入损伤组大鼠的paO2,降低paCO2;各时间点PFD干预组可有效降低肺含水率,其中12 h组肺含水率降低最为明显。MDA是脂质过氧化反应的最终产物,其含量可反映组织中自由基的多少及脂质过氧化程度[18],烟雾吸入损伤组MDA含量增加表明烟雾吸入破坏肺组织的细胞膜结构,各时间点PFD组肺组织MDA含量与烟雾吸入损伤组相比显著下降,表明PFD对烟雾吸入肺损伤作用机制可能与清除自由基、抑制脂质过氧化和减轻氧化应激反应相关,这与Maher[19]的研究结论相符。肺组织的HE染色结果表明,大鼠在烟雾吸入处理后出现明显的病理学变化,主要表现为组织水肿、充血、炎细胞浸润,而PFD干预组对肺组织病理学变化有改善作用。有研究表明,PFD的早期治疗可明显改善肺组织水肿和低氧血症的症状[20]。
在烟雾吸入性损伤病理生理变化中,过氧化反应和炎症反应是两个重要的过程,细胞因子介导的炎症反应在吸入性损伤的致病机制中发挥着关键的作用[21]。烟雾吸入性损伤使肺泡巨噬细胞过度刺激产生大量氧自由基、IL-6和TNF-α等,使毛细血管通透性增加,导致水肿程度加重[22]。Tsuchiya等[23]的研究表明,PFD可能通过抑制氧自由基的产生,从而抑制NF-κB和NF-κB诱导的一些细胞因子如IL-6和TNF-α,进而改善肺水肿和肺部炎症反应。IL-6可促进细胞间黏附分子Ⅰ的表达,并促进淋巴细胞的分化和炎性激活,使炎性损伤反应进一步加强[24]。本研究结果显示,PFD可降低烟雾吸入致肺损伤大鼠血清IL-6水平;TNF-α被认为是引起急性肺损伤最重要的细胞促炎因子之一,是一种多功能促炎因子,可激活NF-κB介导其他细胞因子的合成与释放,启动炎症级联反应,促进中性粒细胞的吞噬能力,促进中性粒细胞脱颗粒和释放溶酶体,增强PMN呼吸爆发,产生过多的氧自由基,诱导肺毛细血管内皮细胞过度活化,阻碍肺组织有效灌流和充分氧合[25]。本研究结果显示,PFD可降低烟雾吸入致肺损伤大鼠血清的TNF-α水平。IL-17是一种细胞促炎因子,也是炎症反应的微调因子,有研究表明其可能在T细胞、C-X-C趋化因子(IL-8和巨噬细胞炎性蛋白-2等)与中性粒细胞的激活和募集之间起介导作用,并参与调控机制[26]。另外,IL-17还刺激支气管上皮细胞和成纤维细胞合成、释放中性粒细胞活化因子,增强弹性蛋白酶活性。本研究结果显示,PFD降低烟雾损伤大鼠血清中的IL-17水平。
综上所述,PFD可能通过抑制氧自由基的产生,从而抑制NF-κB或其他信号途径诱导的一些细胞因子的合成与释放来减轻炎症反应对烟雾吸入性大鼠肺损伤作用。实验研究证明,PFD对烟雾吸入性损伤具有一定的防护作用,但具体通过作用何种信号途径及作用机制,以及用药浓度和最适用药节点的选择上还需进一步深入研究。

